Эндометриоз – эстрогензависимое гинекологическое заболевание [1], поражающее от 5 до 15% женщин репродуктивного возраста и характеризующееся ростом эндометриальной ткани за пределами миометрия. Эндометриоз занимает по частоте встречаемости третье место среди всех гинекологических заболеваний после воспалительной патологии и миомы матки [1; 2]. По данным литературы, этим заболеванием страдает около 8,5 млн женщин Северной Америки и 176 млн женщин всего мира [2]. В России заболеваемость в последние годы выросла с 376 до 435 на 100 тыс. женщин [3].
Эндометриоз известен уже достаточно давно. Его описание было дано еще Рокитанским в 1860 году, который его назвал «аденомиома» матки. Полвека спустя Каллен описал его уже более систематически, назвав аденомиозом матки, идентифицировав ткань эндометрия в толщине миометрия. В 1921 г. Сампсон объяснил источник его происхождения, предложив теорию ретроградного распространения ткани эндометрия во время менструации за пределы полости матки [4].
На сегодняшний день эндометриоз матки хорошо известен многим как аденомиоз. Диагностика аденомиоза в основном является прерогативой морфологов, подтверждаясь обнаружением при гистологическом исследовании стромы и желез эндометрия за пределами слизистой матки. Гистологическое строение очагов зависит от многих причин и может изменяться как в сторону увеличения и преобладанием в них количества клеток стромы, так и желез, изменяясь от активного до неактивного процесса. При отсутствии активности очаги аденомиоза могут подвергаться склерозу, хотя эти процессы во многом зависят от гормональной активности женщины [4]. Активные и неактивные очаги аденомиоза оказывают влияет на клиническую картину и/или симптоматику у больных. В клинике преобладает болевой (тазовые боли) и геморрагический (кровотечение) синдромы [2; 4], которые могут встречаться и при других гинекологических заболеваниях, таких как миома матки, полипы слизистой матки [1], что зачастую не позволяет с достоверностью и большой долей вероятности поставить данный диагноз без гистологического исследования.
На сегодняшний день большинство фундаментальных и клинических работ посвящены разработке теорий происхождения и изучению морфологического субстрата аденомиоза. Морфологическое изучение аденомиоза должно продолжаться в неотрывной связи с его клиническими проявлениями, что делает изучение более интересным и значимым. Однако это затруднено из-за невозможности изучать аденомиоз у женщин в его начальных стадиях развития. Данные трудности удается преодолеть только на экспериментальных моделях, что, конечно, не дает права их с большой вероятностью экстраполировать на человека.
Поэтому целью нашего исследования стало изучение морфометрических изменений очагов внутреннего эндометриоза (аденомиоза) у женщин репродуктивного возраста и влияние на них сопутствующей гинекологической патологии.
Материалы и методы исследования. Нами проведен клинико-анатомический анализ 30 случаев активного аденомиоза на операционном гинекологическом материале и 10 случаев без активности процесса. Характеристика материала: 6 (20%) случаев – аденомиоз I степени, 10 (32%) случаев – аденомиоз II степени, 14 (42%) случаев – аденомиоз III степени. Степень аденомиоза определяли в соответствии с классификацией Б.И. Железнова и А.Н. Стрижакова [5]. Возраст пациенток в исследуемой нами группе составил от 32 до 50 лет (средний возраст 43,6±6,1 года). Менструальная функция у всех женщин была сохранена на момент исследования. Данные о гормональной терапии и сопутствующей негинекологической патологии отсутствовали.
Забор материала производили по единой схеме: вырезали кусочки миометрия из дна, стенок, углов и области перешейка матки. Миометрий исследовали на всю толщину для выявления глубины поражения или степени аденомиоза. Вырезали по три кусочка миометрия (эндометрий с подлежащими тканями, миометрий на расстоянии 1 см от эндометрия и периферические отделы миометрия у серозного листка). У всех женщин была выявлена миома матки в ее различных вариантах, как важное сопутствующее заболевание. Причем локализация и размеры узла широко варьировали у каждой женщины и в исследовании не учитывались, так же как и выраженность болевого и геморрагического синдромов.
Материал проводили стандартным методом, заливали в парафин и изготовляли срезы толщиной 5-6 мкм. Полученные срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону. Полученные микропрепараты изучали при помощи светового микроскопа Carl Zeiss Axio Imager Z1, делая их цифровую съемку. Морфометрическое изучение осуществляли при помощи программы UTHSCSA Image Tool 3.0 (разработанной в University of the Texas Health Science Center of San Antonio, Tеxas, USA, 2007 и свободно доступной в Интернете). Вычисляли длину ядер (мкм) железистого эпителия и его высоту (мкм) в очагах аденомиоза, их площадь (мкм2) и периметр, а также площадь желез (мкм2), количество сосудов, лимфоцитов и процентное соотношение стромы и железистого компонента.
Для статистического метода использовали пакет приложения EXCEL и программу STATISTICA 6.0. Для проверки распределения на нормальность применяли критерий Шапиро-Уилка (где если полученное значение р больше чем 0,05, то распределение является нормальным). Данные оформляли как среднее ± стандартное отклонение.
Для выявления взаимосвязи между парой признаков определяли коэффициент корреляции Пирсона. При определении влияния нескольких качественных переменных на одну зависимую переменную использовали дисперсионный анализ (Analysis Of Variance/ANOVA) с использованием поправки критерия Ливена. Достоверными считали данные различия при р≤0,05.
Результаты исследования и их обсуждение. Комплексное морфологическое исследование операционного материала показало, что аденомиоз практически не встречался в изолированном виде. Во всех случаях в нашем исследовании он сочетался с миомой матки. В 33% случаев все формы аденомиоза сочетались с гиперпластическим процессом эндометрия (ГПЭ) в его различных проявлениях, как правило, было отмечена простая железистая гиперплазия эндометрия, в остальных случаях изменения эндометрия соответствовали фазам менструального цикла.
При макроскопическом исследовании матка была увеличена во всех случаях. Это связано как с ростом миомы тела матки, так и с формой и активностью очагов аденомиоза. При очаговом аденомиозе наблюдалось утолщение одной или нескольких стенок матки, при диффузном – миометрий был утолщен на всем протяжении. Узловой вариант аденомиоза характеризовался наличием лишенного капсулы нечетко очерченного интрамурального узла различных размеров с классическим морфологическим типом строения на разрезе. Среди клинико-морфологических форм аденомиоза были отмечены: диффузная форма – в 17 случаях (57%), очаговая форма – в 10 случаях (33%), смешанная форма была отмечена в 3 наблюдениях (10%). У 20 пациенток (66%) изменения эндометрия соответствовали пролиферативной фазе менструального цикла (без учета ее стадий), в остальных случаях – отмечены секреторные изменения эндометрия (также без учета стадий).
Гистологически в миометрии определяли проникающие на различную глубину эндометриоидные очаги. Во всех случаях нами были обнаружены 2-компонентные очаги аденомиоза, в различных соотношениях были представлены железистые и стромальные структуры: доля железистого компонента при активном аденомиозе составила 35,7±14,9%, доля стромы – 64,5±14,4%, достоверно не отличаясь от неактивных очагов – доля железистого компонента и стромы соответственно (38,5±10,2% и 61,5±11,4 % при р=0,12 и 0,34).
В зависимости от активности процесса эндометриоидные очаги имели свои особенности строения. В случаях активного аденомиоза (прогрессирующего течения заболевания) железы выстилал многорядный призматический эпителий высотой в среднем 21,6±3,4 мкм, в гиперхромных ядрах которого обнаруживались единичные митозы, длина ядер в среднем составила 11,7±1,5 мкм (рис.).
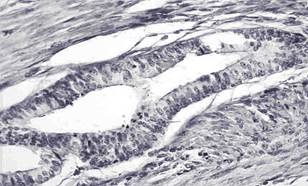
Эндометриоидная железа в миометрии с многорядным эпителием. Пролиферация эпителия. Внизу эндометриоидная клеточная строма. Окраска гематоксилином и эозином. Ув. х400
Железы имели тубулярное строение, строма имела клеточный характер с разным количеством лимфоцитов в строме и количеством сосудов синусоидного и капиллярного типа. В зависимости от степени выраженности аденомиоза количество лимфоцитов варьировало от 4 до 16, с их средним значением – 7,5±4,9 лимфоцитов на мм2; количество сосудов варьировало от 2 до 15 и в среднем составило 8,9±3,5 на мм2.
Неактивный аденомиоз (не прогрессирующее течение заболевания) характеризовался наличием в миометрии стабильных эндометриоидных очагов. В них отсутствовали какие-либо признаки функциональной активности: железы были выстланы призматическим однорядным или кубический эпителием, железы подвергались зачастую кистозной трансформации. Митозы в клетках отсутствовали, строма была фиброзирована, не содержала сосудов синусоидного типа и воспалительный инфильтрат в виде лимфоцитов. Длина ядер эпителия желез – 8,1±1,1 мкм, высота эпителия желез – 17,1±1,9 мкм.
Исследование статистической взаимосвязи между одной парой признаков представлено в таблице.
Данные корреляционного анализа Пирсона в группе женщин с активным аденомиозом
|
Пара переменных |
Коэффициент Пирсона |
|
|
R |
p |
|
|
Активность процесса / степень аденомиоза |
0,98 |
0,00001 |
|
Наличие ГПЭ / степень аденомиоза |
0,98 |
0,00001 |
|
Наличие миомы / степень аденомиоза |
0,42 |
0,00001 |
|
Возраст пациенток / степень аденомиоза |
-0,16 |
0,38 |
|
Степень аденомиоза / количество сосудов |
-0,8 |
0,12 |
|
Степень аденомиоза / количество лимфоцитов |
-0,8 |
0,21 |
|
Степень аденомиоза / доля стромы в очагах |
-0,82 |
0,00000 |
|
Степень аденомиоза / доля железистого компонента в очагах |
0,82 |
0,00000 |
|
Длина ядер желез в очагах аденомиоза / степень аденомиоза |
-0,25 |
0,17 |
|
Высота эпителия аденомиозных очагов / степень аденомиоза |
0,57 |
0,001 |
|
Длина ядер желез в очагах аденомиоза / количество лимфоцитов |
0,45 |
0,01 |
Однако при оценке влияния группы переменных: фаза менструального цикла, наличие ГПЭ, миомы матки, активности процесса на такие морфометрические параметры, как высота эпителия желез в очагах аденомиоза, процент содержания железистого компонента в очагах активного аденомиоза показал отсутствие достоверного влияния этих факторов (F=472,58, p=0,0001), за исключением формы аденомиоза (очаговая, диффузная, смешанная, где F=4,51, p=0,02 и F=113,45, p=0,00001). Не удалось найти влияния выше перечисленных факторов на такие морфометрические параметры, как длина ядра и высота эпителия желез, количество лимфоцитов и сосудов (F=5,56, p=0,043).
Наряду с нашими данными ряд клинических и экспериментальных исследований показали, что в активных эндометриодных очагах часто сочетаются такие патологические процессы, как гиперплазия эндометрия, гипертрофия миометрия, особенно периваскулярная. Это, как мы знаем, лежит в основе появления лейомиомы матки, которая также часто, если не сказать, что практически в 100% случаях, сочетается с эндометриозом [6; 7] и является гормонально зависимым заболеванием. Наличие миомы приводит к изменению формы матки и возможному «забросу» клеток слизистой оболочки во время менструаций за ее пределы, а гиперплазия, сочетающаяся с аденомиозом, как признак гормональной активности женщины способствует их активной пролиферации в миометрии [1; 4].
В активных очагах аденомиоза нарастает количество лимфоцитов и сосудов, которые отсутствуют в неактивных очагах. Ангиогенез и лимфоциты сами по себе играют важную роль в развитии многих патологических процессов, в том числе и опухолевых. Аденомиозу присущи все признаки опухолевого процесса, при этом он еще и проявляет гормональную зависимость. Об этом могут свидетельствовать активно изменяющиеся морфометрические параметры ядра эпителия клеток желез и сочетающаяся при этом лимфоидная инфильтрация, находящиеся в прямой зависимости друг от друга. Эти два параметра всегда сопутствуют активному аденомиозу и изменяются в зависимости от фаз менструального цикла [2; 7].
В экспериментах на лабораторных животных была выявлена зависимость морфологического изменения очагов аденомиоза от уровня гормонов, точнее от эстрогенов [8], снижение которых приводило к регрессу активных очагов в миометрии матки подопытных. По данным ряда авторов, наибольшие изменения в структуре очагов: изменение их активности и увеличение количества рецепторов к гормонам, были зафиксированы в секреторною фазу менструального цикла [9].
Активность аденомиоза зависит от качественного строения очагов, изменения их клеточности с преобладанием стромы над железистыми компонентами, которые находятся между собой в прямой зависимости, что было определено и в нашем исследовании, и в работах других авторов [10]. Мы через изучение влияния косвенных признаков, так же как и исследования Huang T.-S. et al. [11] на эстроген-индуцированной модели показали, что активность и пролиферация клеток очагов аденомиоза выше в пролиферативной фазе менструального цикла, в отличие от исследований некоторых других авторов [9]. Возможно, это связано с достаточно выраженными процессами ангиогенеза, идущими в очагах активного аденомиоза, активация которых способствует росту и развитию эндометриоидных очагов с морфологической точки зрения [11].
Выявленная прямая взаимосвязь между морфометрическими показателями и основными клинико-морфологическими характеристиками аденомиоза при парном влиянии признаков друг на друга оказалась очень важной и значимой. Активность процесса находится в прямой зависимости от миомы, ГПЭ, степени выраженности аденомиоза, что указывает на большое влияние гормонального фона и его роль в прогрессировании заболевания [11]. Оценка же влияния их в совокупности на основные морфометрические показатели очагов аденомиоза (параметры ядра и эпителия, количество лимфоцитов, сосудов) оказалась менее выраженной, чем все они по отдельности. Это еще раз подтверждает гипотезу, что влияние одного фактора может быть значимым на определенный исследуемый параметр, а целая группа может не оказывать на них значимого влияния. Однако стоит отметить, что, несмотря на сказанное, ряд работ выявляют определенную зависимость между активностью очагов аденомиоза и уровнем гормонов, меняющимся как от фаз менструального цикла, так и от их продукции гормонально активными образованиями яичников [9; 11], что в нашем исследовании сочетается с сопутствующей патологией – ГПЭ.
Изменения в человеческом организме при аденомиозе на сегодняшний день являются довольно сложными и не находят однозначного толкования и объяснения в разных исследовательских группах. Таким образом, аденомиоз – заболевание преимущественно позднего репродуктивного и пременопаузального периодов. При прогрессировании аденомиоза более активным очагам присуща воспалительная инфильтрации и увеличение сосудов в строме эндометриоидных очагов миометрия. Чем больше степень поражения миометрия при аденомиозе, тем более выраженными становятся пролиферативные процессы, идущие в этих очагах, а изменения основных морфометрических изменений ядер и эпителия желез находятся в сложной зависимости от основных клинико-морфологических параметров, таких как форма аденомиоза и сопутствующая гиперплазия эндометрия с наибольшими изменениями при его диффузной форме.
Библиографическая ссылка
Привалихина А.В., Ярцев А.А., Спицын П.С., Плотникова А.Ю., Кузнецов Н.А., Макарова А.А., Гервальд В.Я., Пашков А.Ю., Климачев В.В., Семенихина Н.М. МОРФОМЕТРИЧЕСКАЯ ХАРАКТЕРИСТИКА ЭНДОМЕТРИОЗА МАТКИ У ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА // Современные проблемы науки и образования. – 2018. – № 1. ;URL: https://science-education.ru/ru/article/view?id=27431 (дата обращения: 19.04.2024).



