В настоящее время для биотерапии опухолей считается многообещающим сочетание стратегий, направленных как на разрушение опухолевых клеток, так и на индукцию иммунного ответа против них путем активации врожденного и адаптивного иммунитета. Перспективной в этом плане является онколитическая виротерапия (ОВ) с использованием непатогенных для человека вирусов, избирательно накапливающихся в опухолевых клетках. Стимуляция долгосрочных противоопухолевых иммунных реакций в организме опухоленосителя считается важным компонентом индукции противоопухолевого эффекта при проведении виротерапии, которая может стать основой нового подхода к лечению рака; возможно, в сочетании со стандартной терапией [1].
При выборе ОВ для разработки биотерапевтических продуктов принципиальным моментом является их непатогенность для человека. Первыми официально разрешенными вирусными противоопухолевыми препаратами стали генномодифицированные штаммы аденовируса человека с повышенной избирательностью действия на опухолевые клетки [2, 3]. Помимо них предложены еще некоторые онколитические вирусы, которые проходят клинические испытания, такие как пикорнавирусы родов: polio- [4], сене-SVV [5]; энтеровирусы ECHO [6] и Коксаки А21 [7]. Однако наиболее привлекательными в качестве противоопухолевых препаратов являются онкотропные вирусы животных, к которым у человека нет приобретенного в детстве иммунитета (вирусы болезни Ньюкасла, энтеровирусы, парвовирусы животных, вирус везикулярного стоматита и поксвирусы: осповакцины и оспы птиц) [8]. Одними из перспективных представляются вирусы семейства Paramyxoviridae, в частности вирус болезни Ньюкасла (ВБН), не являющийся патогенным для человека [9] и обладающий онколитическим и иммуностимулирующим действием.
В США была проведена I фаза клинических испытаний штамма PV701 ВБН. В этом исследовании принимали участие 79 пациентов с различными прогрессирующими онкологическими заболеваниями, которым не помогала традиционная терапия. У некоторых пациентов под действием внутривенного введения PV701 наблюдалось развитие частичного ответа на лечение [10]. Liang и соавт. (2003) сообщали об обширном исследовании, в котором терапию опухолей ЖКТ проводили вакциной из аутологичных опухолевых клеток, модифицированных нелитическим штаммом La Sota ВБН. Это была III фаза исследования, в которой сравнивали 310 пациентов с резецированным колоректальным раком I–IV стадий и проведенной иммунотерапией с 257 пациентами, получавшими только хирургическое лечение. Медиана общей выживаемости в группе с вакцинациями составляла более 7 лет по сравнению с 4,46 годами в группе только с резекцией. Данные были статистически значимыми [11].
В последние годы предложен ряд препаратов на основе вирусов (Ригвир, Канцеролизин, Онкорин); исследования по отбору и генетической модификации ОВ с целью усиления их противоопухолевых свойств продолжаются.
Цель исследования. Экспериментальное изучение влияния введения вакцинного штамма ВБН на рост перевивной опухоли карциномы Герена, продолжительность жизни и показатели клеточного иммунитета крыс-опухоленосителей.
Материал и методы исследования. В работе использован препарат «Вакцина против Ньюкаслской болезни (НБ) живая сухая (штамм Ла-Сота)».
Работа выполнена на 19 белых беспородных крысах-самцах. Для индукции опухолевого процесса животным подкожно перевивалась карцинома Герена. Вирус-вакцину ВБН вводили в разовой дозе 5000 прививных доз (1 флакон) паратуморально, 2 раза в неделю, всего 4 раза: 1-й группе крыс введение начинали через 1 день после перевивки опухоли, 2-й группе – за неделю до перевивки. Животным контрольной группы подкожно вводили физиологический раствор. В 1-й и 2-й группах было по 7 животных, в 3-й (контрольной) – 5 крыс. Все процедуры введения препарата фиксировались в листе введения.
Наблюдение за животными и замеры опухоли с вычислением ее объема проводили ежедневно, фиксируя результат в протоколе эксперимента. Сведения о погибших животных отмечали в протоколе.
Правовые и этические нормы содержания и использования животных соблюдались в соответствии с Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986).
В периферической крови, собранной из бедренной вены животных, определяли субпопуляционный состав лимфоцитов 2 раза в неделю в течение двух недель по окончании введения вируса второй группе. Относительное (процентное) количество Т- и В-лимфоцитов (CD3+, CD4+, CD8+, CD25+, CD45RA+ клеток) исследовали методом проточной цитофлюориметрии с помощью моноклональных антител (МАТ) фирмы BD Pharmingen Rat T/B/NK Cell Cocktail, BD Pharmingen Rat Activated T Lymphocyte, BD Pharmingen Rat T Lymphocyte Cocktail по методике, рекомендованной производителем.
Интерпретация результатов производилась согласно стандартам иммунофенотипирования и специально разработанным алгоритмам.
Результаты исследования и их обсуждение. Как видно из рисунка 1, у крыс 2-й группы с введением ВБН до перевивки отмечен меньший объем опухоли по сравнению с теми, кому ВБН вводили после перевивки карциномы Герена; различия регистрировались на протяжении 6 недель наблюдения, однако не достигали статистической достоверности вследствие широкой индивидуальной вариабельности внутри каждой из сравниваемых групп.
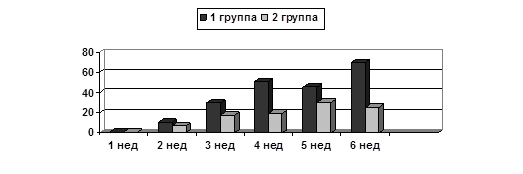
Рис. 1. Средние объемы опухоли у крыс 2-й и 1-й опытных групп, получавших ВБН.
Ось Х – недели после перевивки; Ось Y – объем опухоли (см3)
Крысы 2-й группы, которым введение ВБН начинали до перевивки, погибли на 21-й, 28-й, 37-й, 57-й дни после нее; средняя продолжительность жизни составляла 35,8±10,1 дней. Крысы 1-й группы, которым ВБН вводили после перевивки опухоли, погибли на 29–45-й дни после перевивки, средняя продолжительность жизни составляет 34,0±2,1 дня.
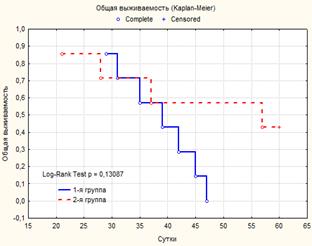
Рис. 2. Общая выживаемость крыс 1-й и 2-й групп, получавших ВБН
Как видно из рисунка 2, различия общей выживаемости крыс в зависимости от времени введения ВБН были статистически недостоверны; их продолжительность жизни после перевивки не отличалась и от контроля (таблица). Однако в отличие от крыс, которым ВБН вводили после перевивки опухоли Герена, среди животных, получавших ВБН до перевивки, были такие, у которых опухоль не перевилась или регрессировала на ранних сроках (2–3 недели после перевивки). Таких крыс было 3 из 7, их не учитывали при расчете продолжительности жизни, поскольку они живы более 6 месяцев. В 1-й группе таких крыс не было, опухоль развилась у всех 7 животных и не регрессировала ни у одного (таблица).
Динамика роста перевиваемой карциномы Герена и продолжительность жизни крыс опытных и контрольной групп
|
Группы крыс |
Объем опухоли (см3) |
Число выживших животных |
Продолжительность жизни после перевивки (дни) |
||||
|
1 месяц |
1,5 месяца |
2 месяца |
1 месяц |
1,5 месяца |
2 месяца |
||
|
1 |
51,4 |
70 |
– |
7/7 |
4/7 |
0/7 |
34,0±2,1 |
|
2 |
19,5 |
25,4 |
– |
5/7 |
4/7 |
3/7 |
35,8±10,1 |
|
3 |
78,7 |
93,9 |
– |
4/5 |
2/5 |
0/5 |
37,2±6,2 |
Результаты иммунологических исследований, проведенных у животных, получавших ВБН, и контрольных в динамике наблюдения, представлены на рисунке 3.
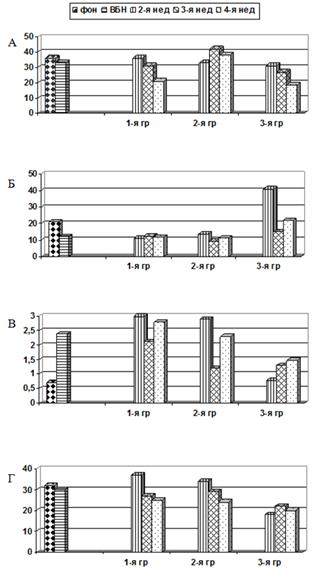
Рис. 3. Уровни CD3+CD4+ (А), CD3+CD8+ (Б), CD3+CD25+ (В), CD45RA+ (Г) в динамике наблюдения у крыс после перевивки карциномы Герена. Ось Y – %
Как видно из рисунка 3А, уровень CD3+CD4+ лимфоцитов в динамике проведения эксперимента в контрольной и в 1-й опытной группах снижался, а во 2-й опытной (с предварительным введением ВБН) не имел статистически значимых отличий от исходных и возрастал по сравнению с контрольной (3-й) и 1-й группой. Так, через 3 недели уровень CD3+CD4+ у крыс 2-й группы составлял 42,0±5,7%, а в контроле – 27,3±2,3% (р<0,05); через 4 недели различия сохранялись (38,7±11 против 18,5±1,6%; р<0,05). У животных 1-й группы происходило статистически достоверное снижение этих лимфоцитов через 4 недели (с 35,9±4,5 до 20,6±3,7%, р<0,05). Интересно, что введение ВБН животным, которым опухоль еще не перевивали, не вызвало изменения уровня CD3+CD4+, в отличие от уровня CD3+CD8+ клеток, количество которых снижалось под воздействием введения ВБН еще до перевивки опухоли (рис. 3Б).
Как видно из рисунка 3Б, после перевивки опухоли количество CD3+CD8+ оказалось максимальным в контрольной группе, особенно на 2-й неделе после перевивки. В этот срок, а также через 4 недели оно статистически достоверно превышало уровни этих клеток у крыс обеих опытных групп (через 2 недели 41,1±7,0% против 11,0±2,4% в 1-й и 13,5±2,5% во 2-й группе; через 4 недели 22,1±4,9% против 11,6±2,0% в 1-й и 11,3±1,3% во 2-й группе; во всех случаях р<0,05).
Как видно из рисунка 3В, введение ВБН вызывает повышение уровня активированных Т-клеток с маркером ранней активации (CD25+), который в дальнейшем после перевивки в обеих опытных группах менялся волнообразно. Количество этих клеток у контрольных животных постепенно возрастало, хотя ко 2-й неделе было статистически достоверно ниже, чем в обеих опытных группах (0,78±0,28% против 2,91±0,33% и 2,99±0,34% соответственно, р<0,05), а к 4-й неделе и не достигало значений, наблюдаемых у опытных крыс 1-й группы (1,47±0,3% и 2,79±0,16% соответственно, р<0,05).
Как видно из рисунка 3Г, уровни В-лимфоцитов не меняются после введения ВБН, однако через 2 недели после перевивки опухоли у крыс 1-й и 2-й групп они превышают контрольные показатели в 2 раза, а затем снижаются до уровня контрольных животных.
Комбинация иммунотерапии и виротерапии опухолей предполагает их синергизм, включающий инициацию иммунного ответа на антигены вирусов, а также частично разрушенных под действием онколитических вирусов опухолевых клеток. Механизмы цитопатического действия ВБН связаны с индукцией апоптоза, апоптоз-опосредованного некроза, аутофагии и синцитиеобразованием. Хотя штамм ВБН Ла-Сота и считается нелитическим, т.е. не приводящим к образованию синцития, у него описан такой механизм повреждения опухолевых клеток, как индукция апоптоза [12], показанный in vitro, а его иммуногенные свойства могут быть использованы для стимуляции противоопухолевого ответа [13].
В нашей работе оценка показателей Т- и В-клеточного звена у крыс продемонстрировала, что введение ВБН до перевивки опухоли Герена вызывает выраженное повышение уровня Т-лимфоцитов с маркером ранней активации (CD3+CD25+) при снижении уровня CD3+CD8+ клеток. Мы предполагаем, что такая подготовка дает возможность сохранять более высокие уровни CD3+CD25+ и CD3+CD4+ лимфоцитов при последующей перевивке опухоли Герена по сравнению не только с контрольными животными, но и с теми, кому опухоль перевивали раньше, чем начинали вводить ВБН. Отсутствие роста опухоли у части животных, предварительно получавших ВБН, на наш взгляд, связано с полученной стимуляцией Т-клеток, сохраняющейся и в динамике наблюдения. Введение вакцины против ВБН способно не только оказывать профилактическое действие при применении для иммунизации против бронхита птиц, но и предупреждать развитие перевиваемой опухоли, хотя последнее получено и не у всех животных. Возможно, для достижения более полного эффекта следует комбинировать применение ВБН с другими методами противоопухолевых воздействий.
Заключение. Итак, показатели Т- и В-клеточного звена в исследуемых группах крыс демонстрируют, что ВБН в ранние сроки после введения вызывает выраженное повышение уровня Т-лимфоцитов с маркером ранней активации при снижении уровня CD3+CD8+ клеток. При последующей перевивке опухоли Герена таким животным отмечена стимуляция у них CD3+CD4+ и CD3+CD25+ лимфоцитов, в отличие от контрольных крыс. Судя по полученным результатам, стимуляция Т-клеточного звена иммунной системы крыс с помощью предварительного введения ВБН способствует индукции у части животных противоопухолевого эффекта в виде отсутствия роста опухоли или ее регрессии в ранние сроки.
Библиографическая ссылка
Златник Е.Ю., Ситковская А.О., Шульгина О.Г., Бондаренко Е.С., Золотарева Е.И., Гречкин Ф.Н., Харагезов Д.А., Каймакчи Д.О. ВЛИЯНИЕ ВИРУСА БОЛЕЗНИ НЬЮКАСЛА НА ПОКАЗАТЕЛИ КЛЕТОЧНОГО ИММУНИТЕТА КРЫС-ОПУХОЛЕНОСИТЕЛЕЙ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. – 2018. – № 4. ;URL: https://science-education.ru/ru/article/view?id=27948 (дата обращения: 23.04.2024).



