Ревматоидный артрит (РА) – хроническое воспалительное аутоиммунное заболевание неизвестной этиологии, в иммунопатогенез которого вовлечены цитокины. Цитокины играют фундаментальную роль в возникновении воспаления, и считается, что цитокины продуцируются большим количеством клеток и являются главными участниками деструкции хрящевой ткани [1]. Синтез цитокинов является индуцибельным и зависит от их генетического полиморфизма их генов, а также от различных комбинаций и формирования генных сетей, которые работают в строгом взаимодействии друг с другом, что позволяет говорить о важности межгенных и внутригенных отношений в формировании общих и специфических защитных ответов организма, дестабилизация которых может привести к пролонгированной хронической воспалительной реакции и аутоиммунному процессу [2].
Проводимые по всему миру масштабные геном-ассоциированные исследования (GWAS) позволили идентифицировать 101 локус, белковые продукты которых вовлечены в патогенез ревматоидного артрита, среди которых особое место отводится полиморфным генам цитокинов [3], прежде всего провоспалительным, таким как TNFα, IL-1, IL-6, стимулирующим воспаление и деградацию кости и хряща. Согласно литературным данным основная роль TNF-α в иммунопатогенезе РА состоит в его способности индуцировать продукцию других провоспалительных цитокинов, включая IL-1 и IL-6, хемокинов, привлекающих лейкоциты в очаг воспаления в ткани, активацию остеокластов и хондроцитов, развитие системных осложнений, в частности сопутствующей сердечно-сосудистой патологии и метаболического синдрома. IL-1β индуцирует продукцию цитокинов синовиальными мононуклеарами, хондроцитами, эрозию костей остеокластами. Вклад IL-6 в патогенез РА до сих пор изучается, в клинических исследованиях показано, что его системные эффекты при РА приводят к развитию острофазового ответа, который характеризуется выработкой острофазовых белков [4]. Между тем результаты исследований, касающихся изучения ассоциации полиморфизма генов TNFα, IL-1, IL-6 с РА, до настоящего времени противоречивы. Постулируется, что различные аллельные варианты генов цитокинов, их гаплотипические сочетания и межгенные взаимодействия могут приводить к возникновению дисбаланса между активностью про- и противовоспалительных цитокинов, что приводит к мультисистемным иммунным осложнениям при ревматоидном артрите [5]. В связи со сложностью оценки межгенных взаимодействий необходимо применять различные математические техники. В настоящее время одним из наиболее эффективных и популярных методов анализа межгенных взаимодействий является биоинформатический метод сокращения многофакторной размерности Multifactor Dimensionality Reduction (MDR), целью которого являются моделирование межгенных взаимодействий и возможность представлять графически иерархическую структуру и характер взаимодействий между различными генами [6].
В связи с вышеизложенным цель: сравнительный анализ межгенных взаимодействий генов цитокинов IL1B, TNFА, IL-6 методом сокращения многофакторной размерности (Multifactor Dimensionality Reduction – MDR) у больных ревматоидным артритом русской популяции.
Материалы и методы. Контингент обследуемых лиц. Отбор больных с диагнозом «ревматоидный артрит» осуществлялся врачами-ревматологами вне зависимости от возраста, стадии и клинического варианта РА в период с 2004 по 2007 гг. (70 человек: мужчин – 17,1%; женщин – 82,9%, средний возраст 51,7±1,3 года). В качестве критериев диагностики заболевания были приняты Критерии Американской ревматологической Ассоциации (1987 г.). Принадлежность к популяционной группе определялась по данным генеалогического анамнеза до третьего поколения (согласно рекомендациям 8-го Международного Симпозиума в 1980 г., Лос-Анджелес, США).
Методы исследования. В исследовании использовалась коллекция образцов ДНК, выделенной из венозной крови с использованием реактивов PROTRANS DNA Box 500. Определение SNPs в полиморфных сайтах генов –308 G/A TNFA, +3953 C/T IL-1b проводилось методом полиморфизма длин рестрикционных фрагментов, состоящим из следующих этапов: ПЦР (праймеры ООО «Синтол»), инкубация с эндонуклеазами рестрикции NcoI и TaiI соответственно [2]. Генотипирование SNP –174 G/C IL-6 осуществлялось аллельспецифической ПЦР (реактивы ООО НПФ «Литех»). Детекция осуществлялась методом горизонтального электрофореза в 3%-ном агарозном геле.
Статистическая обработка. Анализ межгенных взаимодействий проводили методом сокращения многофакторной размерности (Multifactor Dimensionality Reduction, MDR) в среде открытой программы MDR v.2.0 beta8. Математическая основа – непараметрический кластерный анализ, служащий альтернативой логистической регрессии для обнаружения и описания нелинейного типа взаимодействия между дискретными генетическими предикторами [6, 7]. Возможности программы MDR позволяют представить вклад каждого полиморфизма в риск развития ревматоидного артрита в виде дендрограммы и/или в виде схемы Фрюхтерман–Рейнгольда, в которых цветовое обозначение показывает направленность межгенных взаимодействий, а именно: красный и оранжевый цвета – синергизм, желтый – независимое влияние; зеленый и синий – антагонизм. Достоверность полученных результатов оценивалась на основе валидности или воспроизводимости тестируемых моделей (сross-validation consistency, CVC), а также расчета ошибки предсказания модели (рrediction error). Оптимальной моделью считается модель с воспроизводимостью (Cross-validation) не менее 9 из 10 и точностью предсказания (Testing balance daccuracy) не менее 70%.
Результаты и обсуждение. С помощью программы MDR нами построены оптимальные модели межгенных взаимодействий генов провоспалительных цитокинов TNFA, IL-1B, IL-6 для общей группы больных и группы больных женщин. Для больных ревматоидным артритом характерна четырехлокусная модель IL1B(+3953)*Т, TNFA(-308)*G, TNFA(-308)*А, IL-6(-174)*G, содержащая два аллеля по однонуклеотидному полиморфизму –308 TNFA. Данная модель характеризовалась 100%-ной воспроизводимостью (Cross Validation consistency) и 73%-ной точностью предсказания (Testing balanced accuracy), данные представлены в таблице 1.
Таблица 1
Модели межгенных взаимодействий TNFA, IL-1B, IL-6 при ревматоидном артрите
|
Модель |
Точность предсказания |
Воспроизводимость тестируемой модели |
|
IL-6(-174)*G |
0,705 |
8/10 |
|
IL1B (+3953)*Т, IL-6(-174)*G |
0,654 |
6/10 |
|
IL1B (+3953)*Т, TNFA(-308)*А, IL-6(-174)*G |
0,73 |
10/10 |
|
IL1B (+3953)*Т, TNFA(-308)*G, TNFA(-308)*А, IL-6(-174)*G |
0,73 |
10/10 |
Исходя из максимальных значений коэффициента перекрестной проверки и точности предсказания для данного анализа оптимальным межгенным взаимодействием является трехкомпонентная модель IL1B (+3953)*Т, TNFA(-308)*А, IL-6(-174)*G, которая характеризуется коэффициентом перекрестной проверки 10/10 и точностью предсказания 73%. Вклад каждого полиморфизма при риске развития ревматоидного артрита представлен в виде дендрограммы (рис. 1).

Рис. 1. График энтропии, отражающий межгенные взаимодействия в полученной модели
Длинные линии в дендрограмме описывают слабую взаимосвязь между генами. Чем короче линии, соединяющие два предиктора, тем сильнее взаимодействие. Красные линии характеризуют наиболее сильные синергетические взаимодействия. На следующем этапе оценили информационную ценность отдельного маркера, взаимодействие пары генов оценили с помощью схемы Фрюхтерман–Рейнгольда (рис. 2).
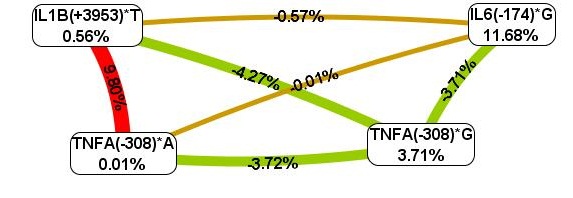
Рис. 2. Схема Фрюхтерман–Рейнгольда для межгенных взаимодействий TNFA, IL-1B, IL-6
у больных ревматоидным артритом
Согласно схеме Фрюхтерман–Рейнгольда из четырех анализируемых полиморфизмов наибольшим предсказательным потенциалом обладает полиморфизм IL-6(-174)*G – 11,68%. В то же время оптимальным межгенным взаимодействием является двухлокусная модель IL1B (+3953)*Т, TNFA(–308)*А, на долю комбинации которых приходится 9,80% фенотипической энтропии, что демонстрирует выраженный синергический эффект полиморфизмов при формировании предрасположенности к ревматоидному артриту (рис. 1, 2). Данные аллели являются высокопродуктивными, и подобное взаимодействие, вероятно, ведет к чрезмерной выработке основных провоспалительных цитокинов IL1B и TNFA. Аллельные варианты IL1B (+3953)*Т и IL-6(-174)*G, TNFA(-308)*А и IL-6(-174)*G оказывают выраженный независимый эффект в формировании ревматоидного артрита, а аллели TNFA(-308)*G и TNFA(-308)*А, TNFA(-308)*G и IL-6(-174)*G, TNFA(-308)*G и IL1B (+3953)*Т имеют отрицательные эффекты.
Согласно литературным данным РА чаще встречается у женщин [2, 3], поэтому на втором этапе с целью выявления дополнительных факторов риска у женщин были построены модели межгенного взаимодействия, результаты представлены в таблице 2.
Таблица 2
Модели межгенных взаимодействий при ревматоидном артрите у женщин
|
Модель |
Точность предсказания |
Воспроизводимость тестируемой модели |
|
IL-6(-174)*G |
0,69 |
10/10 |
|
IL1B (+3953)*С, IL-6(-174)*G |
0,60 |
5/10 |
|
IL1B (+3953)*Т, TNFA(-308)*А, IL-6(- 174)*G |
0,75 |
10/10 |
|
IL1B (+3953)*С, IL1B (+3953)*Т TNFA(- 308)*А, IL-6(-174)*G |
0,75 |
10/10 |
В результате MDR-анализа у женщин, больных ревматоидным артритом, была установлена четырехлокусная модель IL1B (+3953)*С, IL1B (+3953)*Т TNFA(-308)*А, IL-6(-174)*G, которая характеризовалась 100%-ной воспроизводимостью (Cross Validation consistency) и точностью предсказания 75% (Testing balanced accuracy). В отличие от общей группы больных, в формирование данной модели вовлечены оба аллеля однонуклеотидного полиморфизма +3953 IL1B. Также оптимальной моделью оказалась трехлокусная комбинация IL1B (+3953)*Т, TNFA(-308)*А, IL-6(-174)*G, которая характеризуется коэффициентом перекрестной проверки 10/10 и точностью предсказания 75%.
Согласно схеме Фрюхтерман–Рейнгольда (рис. 3) из четырех анализируемых полиморфизмов наибольшим предсказательным потенциалом обладает полиморфизм IL-6(-174)*G – 12,51%. Однокомпонентная модель IL-6(-174)*G, характеризуется коэффициентом перекрестной проверки 100% и точностью предсказания 69,35%.
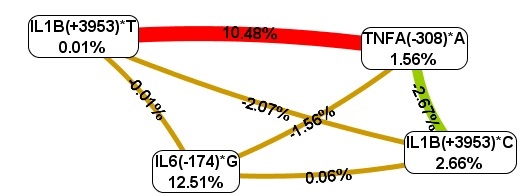
Рис. 3. Схема Фрюхтерман–Рейнгольда для межгенных взаимодействий TNFA, IL-1B, IL-6 у больных ревматоидным артритом женщин
В то же время оптимальным межгенным взаимодействием является двухлокусная модель IL1B (+3953)*Т, TNFA(-308)*А, на долю комбинации которых приходится 10,48% фенотипической энтропии, что демонстрирует выраженный синергический эффект полиморфизмов при формировании предрасположенности к ревматоидному артриту у женщин, как и в общей группе больных. Кроме того, установлены различные варианты межгенных взаимодействий: синергизм пары IL1B (+3953)*Т, TNFA(-308)*А, независимость наследования аллельных вариантов IL1B(+3953)*Т и IL-6(-174)*G, TNFA(-308)*А и IL-6(-174)*G, IL1B(+3953)*С и IL-6(-174)*G, IL1B(+3953)*С и IL1B (+3953)*Т друг с другом, антагонизм аллелей TNFA(-308)*А и IL1B (+3953)*С. Последнее взаимодействие, вероятно, можно объяснить их разнонаправленным действием на экспрессию IL1B и TNFA.
Следует отметить, что формирование четырехлокусных и трехлокусных моделей прошло на основе полиморфизма -174 IL-6, обладающего наибольшим предсказательным потенциалом.
Заключение. В настоящее время не вызывает сомнения тот факт, что ни один из маркеров в отдельности и даже несколько генов-кандидатов не позволяют достоверно предсказать риск мультифакторных заболеваний, в связи с чем ведется поиск адекватных математических моделей данных патологий. Известно, что носительство тех или иных сочетаний генов может определять возникновение клинически гетерогенных форм болезни и эффективность лечения [7]. В данной статье представлен подход с использованием метода сокращения многофакторной размерности, который позволил рассмотреть все возможные комбинации SNPs провоспалительных цитокинов, выбранных для анализа межгенных взаимодействий, в отношении риска развития ревматоидного артрита. Генетический полиморфизм генов провоспалительных цитокинов исследуется на наличие или отсутствие ассоциации с ревматоидным артритом в различных этнических группах. При исследовании различных популяций были получены данные, как подтверждающие, так и не подтверждающие [8] ассоциацию генов цитокинов с предрасположенностью к ревматоидному артриту [3]. Большая часть работ типа «случай – контроль», даже если в них включено изучение различных генов, посвящена монолокусному анализу генов цитокинов без оценки возможных межгенных взаимодействий. Как показывает наше исследование, генетический полиморфизм -308 G/A TNFА b +3953 T/C IL-1B не ассоциированные с предрасположенностью к ревматоидному артриту [2], вовлечен в значимые комбинации с полиморфизмом -174 G/C IL-6. Вероятнее всего именно данный полиморфизм является маркером риска предрасположенности к ревматоидному артриту у русских Челябинской области.
Библиографическая ссылка
Сташкевич Д.С., Беляева С.В., Хромова Е.Б., Бурмистрова А.Л. МОДЕЛИ МЕЖГЕННЫХ ВЗАИМОДЕЙСТВИЙ ГЕНОВ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ IL-1B, IL-6, TNFA У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Современные проблемы науки и образования. – 2018. – № 5. ;URL: https://science-education.ru/ru/article/view?id=28122 (дата обращения: 19.04.2024).



