Различные варианты переднего спондилодеза являются методом выбора клиницистов при травматических, дегенеративных и неопластических поражениях позвоночника [1–3]. По показаниям в ряде случаев при выраженной нестабильности применяются методы задней и комбинированной фиксации [4, 5]. Причиной поиска новых материалов и способов стабилизации позвонков послужили неудовлетворительные результаты хирургического лечения нестабильных повреждений позвоночника, связанные, как правило, с отсутствием костного сращения, несостоятельностью фиксации, развитием псевдоартроза и прогрессированием деформации в отдаленном периоде после операции [6–8]. Одним из факторов, влияющих на неблагополучный исход лечения, является несовершенство применяемых материалов при стабилизации позвоночника [9–11]. Биоинертные материалы, в частности титан и его сплавы, обладают высокими фиксирующими свойствами, низкой токсичностью, однако вялотекущие процессы коррозии все же происходят и обусловлены прежде всего разнородностью состава, высокой электропроводностью и электролитической активностью [12]. С одной стороны, коррозия может явиться причиной снижения механической прочности имплантата, с другой − может приводить к появлению токсичных продуктов коррозии, не только воздействующих на клетки локально в парапротезной зоне, но и создающих токсические концентрации в органах, приводя к нарушению их функции [13, 14]. Титан и его сплавы остаются предметом выбора в качестве материалов для изготовления имплантатов из-за превосходной биологической совместимости, механических свойств и коррозионной стойкости в связи с наличием на своей поверхности так называемой стабильной оксидной пленки [15]. Однако в определенных условиях, например при нанесении царапин в процессе установки имплантата и/или при придании определенной формы и размеров металлическим имплантатам во время операции на позвоночнике, целостность стабильной защитной оксидной пленки может быть нарушена, что приводит к прямому контакту между металлом и агрессивной окружающей биологической средой, вызывая процессы коррозии [15].
Эти данные способствуют поиску новых материалов для изготовления имплантов в травматологии и ортопедии, в том числе спинальных. Одним из таких материалов является биокерамика на основе оксида алюминия, имеющая прочность на сжатие до 4000 МПа, что значительно превосходит данный показатель кортикальной кости (130–167 МПа), в связи с чем она может быть использована для изготовления фиксирующих погружных имплантов, в том числе спинальных. Имея высокие показатели прочности на изгиб (до 450 Мпа), алюмооксидная (корундовая) керамика, кроме того, обладает выраженными биоинертными свойствами, высокой коррозионной устойчивостью и отсутствием токсичности. В зарубежной и отечественной литературе широко представлены публикации, посвященные использованию межтеловых имплантатов, изготовленных из алюмооксидной, гидроксиапатитной, трикальцийфосфатной керамики [16, 17]. В то же время не найдено исследований, посвященных передней стабилизации позвоночника пластинами, изготовленными из корундовой керамики.
Цель исследования
Изучить в эксперименте in vitro эффективность передней фиксации субаксиальных шейных позвоночных сегментов биокерамическими имплантатами при флексионных нагрузках.
Материалы и методы исследования
Материалом исследования послужили полноразмерные полимерные модели С5 и С6 шейных позвонков (рис. 1), изготовленные методом 3D-печати из полиамида PA 2200, фиксация которых in vitro осуществлялась керамическими имплантами: эндофиксатором межтеловым, изготовленным из пористой биоинертной керамической композиции Al2O3-ZrO2, с наличием добавок (Y2O3, Cr2O3, SrO) с пористостью в диапазоне от 15 до 25%, и керамической пластиной с винтами, которые изготовлены из монолитной (плотной) биоинертной керамической композиции Al2O3-ZrO2. Исследования проводились согласно ГОСТу Р 57390–2017, который предназначен для тестирования сборных спинальных имплантатов. ГОСТ позволяет пользователю принимать самостоятельное решение относительно того, какие именно испытания проводить для конкретного сборного спинального имплантата. В связи с этим на универсальном измерительном комплексе INSTRON 3369, используемом для оценки механических свойств материалов и деталей, нами проведена серия исследований, каждое из которых сопровождалось сгибательным статическим механическим тестированием в виде сжатия при изгибе. Для оценки фиксирующих и удерживающих свойств имплантатов нами проводился анализ следующих биомеханических параметров: нейтральная зона (NZ), эластическая зона (EZ), индекс, диапазон движений (ROM) [Ошибка! Источник ссылки не найден.18]. Для обеспечения трансформации поступательного движения платформы МТS-машины в сгибательный маневр (рис. 2) нами предварительно была подготовлена металлическая оснастка в виде двух опор для каудального и краниального позвонков (рис. 3). В центре, на вершине краниальной опоры сформирован сферовидный паз, в который укладывался металлический шар d=15 мм для равномерного распределения нагрузки от платформы во время тестирования. Оснастка позволяла фиксировать полимерные позвонки симметрично во фронтальной и аксиальной проекциях с формированием между смежными замыкательными пластинками лордотического угла 6о [19]. Подготовка образца проводилась следующим образом: к металлическим опорам 4 шурупами жестко фиксировались полимерные модели позвонков. В межтеловой промежуток укладывался керамический имплантат высотой 6 мм, шириной 12 мм, глубиной 14 мм. Затем спереди укладывалась керамическая пластина, которая фиксировалась к телам позвонков 4 керамическими шурупами диаметром 4 мм и длиной 14 мм после предварительного формирования каналов в телах путем сверловки диаметром 3,5 мм и прохождения метчиком 4,0 мм. Стабильность фиксации пластины обеспечивается конструктивной особенностью винтов и отверстий пластин. Собранная конструкция устанавливалась на стенд MTS-машины, после чего верхняя платформа подводилась до соприкосновения к металлическому шару (рис. 3). Далее начиналась основная часть эксперимента, заключающаяся в осуществлении статического перемещения со скоростью 10 мм/мин до получения поломки конструкции (рис. 3). При этом регистрировалась типичная кривая зависимости «нагрузка – деформация» (рис. 4). В последующем данные подвергались статистической обработке с использованием критериев описательной статистики.

Рис.1. Фотография полноразмерных полимерных моделей С5 и С6 шейных позвонков, изготовленных методом 3D-печати
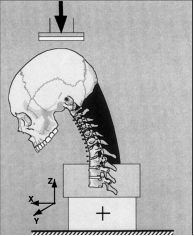
Рис. 2. Схема сгибательного маневра

Рис. 3. Фотография системы фиксированных керамическими имплантатами полимерных позвонков, установленных в металлическую оснастку, в момент разрушения пластины на универсальном измерительном комплексе Instron 3369
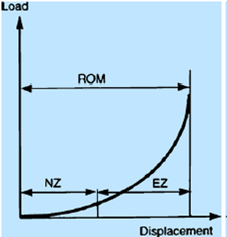
Рис. 4. Типичная кривая зависимости «нагрузка – деформация»
Полученные результаты
В ходе проведенных тестирований получены следующие результаты: величина нейтральной зона NZ составила 1,25±1,3°, эластической зоны EZ 3,75±1,5°, диапазона движений ROM = 5,0±1,7°. Начало поломки конструкции зарегистрировано при нагрузке 1500 Н (рис. 5). Разрушение конструкции было получено при 7000 Н.
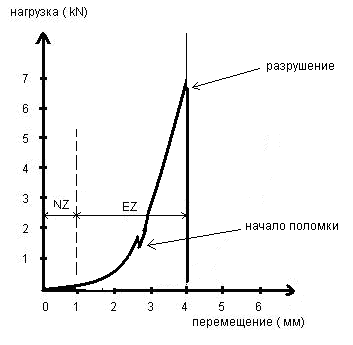
Рис. 5. График зависимости «нагрузка – деформация» (экспериментально полученные средние значения)
Обсуждение
Шейный отдел позвоночника с биомеханической точки зрения является несущей механической структурой с 6 степенями свободы движения [1, 20]. Основные из них – это сгибание/разгибание, боковые наклоны и ротация (рис. 1). Взаимодействие приложенной на позвоночные сегменты нагрузки и возникающей при этом деформации (изменение положения позвонков относительно друг друга) имеет нелинейный характер и может быть представлено графиком (рис. 2). Физиологический диапазон движений между позвонками (ROM) – это диапазон нормальных движений между двумя позвонками, отмеряемый от нейтральной позиции и состоящий из нейтральной зоны (NZ) и эластической зоны (EZ). NZ является начальной частью диапазона движений (ROM) между позвонками, измеряемого от нейтральной позиции, при котором движение продуцируется с минимальным внутренним сопротивлением. В пределах нейтральной зоны (NZ) возможны движения между позвонками с приложением очень небольших усилий, за ее пределами находится эластическая зона (EZ), которая заканчивается физиологическим лимитом, после которого наступает зона разрушения системы (FZ) либо пластичная деформация, в связи с чем эту зону некоторые авторы считают пластической зоной PZ.
M.M. Panjabi et al. [18Ошибка! Источник ссылки не найден.] определили термин «нестабильность» как увеличение подвижности позвоночно-двигательного сегмента выше физиологического лимита, сопровождающегося болевым синдромом и (или) появлением неврологической симптоматики. Стабильность определяется соответствующим взаимоотношением NZ и EZ. Несмотря на то что вклад нейтральной зоны в диапазон движений незначительный, доказано, что NZ является наиболее чувствительным параметром в диагностике дегенеративной и травматической нестабильности, так как NZ начинает повышаться раньше и значительнее, чем ROM и EZ. Так, например, при экстензионно-компрессионной травме осевая ротационная нестабильность увеличивается на 540% [18]. При взрывных переломах показатель NZ будет достоверно увеличиваться при сгибании на 49%, наклонах – на 80%, ротации – на 87%. В условиях задней стабилизации позвоночно-двигательного сегмента на шейном уровне NZ уменьшается при сгибании-разгибании на 80%, при ротации на 75% и при наклонах на 57%, ROM уменьшается сгибании и разгибании на 47% [21]. Учитывая значимость NZ, наблюдаемую при испытаниях на кадаверах и животных, M.M. Panjabi et al. внес поправку и уточнил термин «нестабильность» как снижение способности стабилизирующих систем позвоночника поддерживать нейтральные зоны позвоночно-двигательных сегментов в физиологическом интервале, таким образом, чтобы не формировались деформация, неврологический дефицит и боль [18].
В специальной литературе в настоящее время доминирует концепция стабильности позвоночника, состоящая из трех подсистем [20]. Пассивная мышечно-скелетная подсистема представляет собой позвонки, суставы, диски, связки, пассивные прочностные характеристики мышц. Активная мышечно-скелетная подсистема представлена мышцами и сухожилиями, окружающими позвоночный столб. Третьей подсистемой является нервный комплекс, включающий рецепторы в связках, сухожилиях и мышцах и центральную нервную систему. Оценка стабильности позвоночно-двигательного сегмента именно с этих позиций в физиологических условиях при дегенеративном поражении, травме и в условиях стабилизации инструментарием входит в круг интересов исследователей-вертебрологов и клиницистов. В доступной литературе выделен ряд работ [11, 21, 22], посвященных оценке фиксирующих свойств шейных имплантов при различных повреждениях, преимущественно в этих работах используются специальным образом подготовленные фрагменты позвоночника человеческих кадаверов, что очень проблематично как с позиций этики и гуманности, так и с позиции законодательной базы. Кроме того, сложно подобрать несколько кадаверов со сходными прочностными свойствами шейных позвонков. Подобное состояние дел обусловлено тем, что такие материалы, как кость, являются анизотропными, так как их упругие и прочностные свойства зависят от направления приложения нагрузки. Также, являясь вязкоупругим материалом, кость меняет свои свойства в зависимости от скорости приложенного относительного напряжения. Полностью воспроизвести физические и механические свойства костной ткани в настоящее время не представляется возможным. Поэтому в нашем исследовании мы пошли по пути применения материалов, модели из которых, полученные при 3D-печати, обладают сходными значимыми физико-механическими свойствами с шейными позвонками человека [11, 23]. Это позволило обеспечить, с одной стороны, высокую точность детализации, с другой – подобрать свойства полимера таким образом, чтобы обеспечить сходные количественные показатели по следующим характеристикам: прочность на разрыв, модуль упругости, удельная ударная вязкость. Наиболее предпочтительными для этих целей являются материалы, приближенные по своему модулю упругости к костной ткани, т.е. с прочностью на разрыв 40±5 МПа. В качестве субстрата для изготовления позвонков использовался полиамид PA 2200 – это гибкий и прочный пластик для 3D-печати SLS методом (селективное лазерное спекание, selective laser sintering). В качестве исходного материала используется оригинальный (производства EOS/Германия) гранулированный нейлоновый порошок белого цвета, из которого с применением лазерной 3D-печати и промышленных 3D-принтеров выращиваются корпусные детали, подвижные элементы, крепления и сборные механизмы целиком.
Типичное применение данного материала – полнофункциональные прототипы с высокой точностью детализации, без необходимости удаления поддерживающих структур. Они легко выдерживают высокие механические и температурные воздействия.
Полиамид применяется как конструкционный, электроизоляционный и антифрикционный материал в электротехнической, радиотехнической, автомобильной, авиационной, нефтедобывающей, приборостроительной, медицинской и других отраслях промышленности.
Материал полиамид (PA2200/ПА-12) имеет приближенные к кости физические и прочностные свойства: предел прочности – 45 МПа, модуль упругости при растяжении – 1700 МПа, в то время как у кортикальной кости модуль упругости – 1800 МПа. Модуль упругости титанового сплава Ti6Al4V (ASTM F136) составляет 90 000 МПа, а, например, стали – 200 000 МПа. Ряд проведенных биомеханических кадаверных исследований показывает, что NZ составляет для интактного уровня С5-С6 от 1,8+1,3° [18] до 10,3±2,3° [24]. При дестабилизации путем рассечения заднего связочного комплекса и диска NZ приближается к 16,5±2,2° [24]. При стабилизации уровня С5-С6 передними пластинами NZ составляет от 1,4±1,0° при использовании ригидных пластин до 3,2±2,2° при использовании компрессионных пластин [10, 21]. В то же время диапазон движений ROM в интактном сегменте С5-С6 составляет от 5,5± 2,6° [21] до 17,3±3,1° [24], при дестабилизации ROM достигает 20,5±1,9° [24]. В условиях стабилизации пластинами ROM варьирует от 3,3±2,3° (в случае блокированных пластин) и до 4,1±2,8° – без механизма, блокирующего миграцию винтов. EZ в интактном сегменте С5-С6 по данным литературы составляет 6,5–7,0°. В проведенной серии испытаний вычисленная NZ составила 1,25±1,3°, а ROM = 5,0±1,7°. Данные показатели являются сопоставимыми в количественном соотношении с результатами, полученными другими исследователями [3, 21Ошибка! Источник ссылки не найден.], и, следовательно, свидетельствуют о наличии необходимой надежности фиксирующих свойств керамических имплантов и достаточной жесткости стабилизации. Прочность на изгиб до 1000 МПа обеспечивает высокие прочностные и фиксирующие свойства биокерамических фиксирующих имплантатов, что позволит добиться надежной стабилизации из переднего доступа за счет конструктивных особенностей имплантатов и отработанной оперативной техники.
Заключение
Полученные в ходе эксперимента данные позволяют говорить о достаточности фиксирующих свойств керамических пластин и винтов при проведении передней стабилизации in vitro с использованием полимерных полноразмерных моделей позвонков, изготовленных методом 3D-печати. Кроме того, стоит считать, что импланты, изготовленные из композитной алюмооксидной биокерамики, обладают достаточными прочностными свойствами для удержания позвонков при нестабильной травме в условиях физиологической активности до момента формирования костно-керамического блока.
Библиографическая ссылка
Ластевский А.Д., Рерих В.В., Батаев В.А., Веселов С.В. ФИКСИРУЮЩИЕ СВОЙСТВА КЕРАМИЧЕСКИХ ИМПЛАНТОВ ПРИ ВЕНТРАЛЬНОЙ СТАБИЛИЗАЦИИ СУБАКСИАЛЬНЫХ ШЕЙНЫХ СЕГМЕНТОВ В ЭКСПЕРИМЕНТЕ (ОБЗОР ЛИТЕРАТУРЫ И РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ) // Современные проблемы науки и образования. – 2018. – № 6. ;URL: https://science-education.ru/ru/article/view?id=28429 (дата обращения: 19.04.2024).



