Термин «пилоидная» использовался с 1930 года для описания форм астроцитомы, имеющих в своем строении клетки волосообразные, биполярные отростки [1]. То, что сегодня мы называем пилоидной астроцитомой (ПА), имело множество разных наименований до того, как система классификации ВОЗ стала общепринятой; прежними терминами считались «полярная спонгиобластома» и «ювенильная астроцитома». ПА относится к группе опухолей низкой злокачественности (GRADE I по классификации опухолей центральной нервной системы ВОЗ).
Пилоидная астроцитома - наиболее часто встречающаяся опухоль головного мозга у детей и подростков, составляющая 33.2% от общего числа всех глиом, развивающихся в возрасте 0–14 лет, и 17,6% от числа всех первичных опухолей головного мозга в детском периоде [2]. Средний возраст среди старших возрастных групп составляет 22 года, а пациенты старше 50 лет поражаются ПА относительно реже.
ПА возникают в различных отделах центральной нервной системы, поражая зрительный нерв, зрительную хиазму/гипоталамус, таламус и базальные ганглии, полушария головного мозга, а также ствол мозга, однако большинство пилоцитарных астроцитом локализуется субтенториально.
ПА характеризуется бифазным паттерном, включающим в себя плотно расположенные биполярные клетки, содержащие скопления α-В-кристаллина в виде волокон Розенталя, а также свободно лежащие мультиполярные клетки с микрокистами и эозинофильными зернами, состоящими из α1-антихемотрипсина и α1-антитрипсина. Эти две составляющие могут наблюдаться в различных пропорциях, создавая значительное гистологическое разнообразие. Необходимо отметить, что возможно выявление признаков, характерных для high-grade новообразований, например клеточная и ядерная анаплазия, пролиферация эндотелия сосудов, фокусы некрозов и т.д. Однако эти признаки чаще являются дегенеративными изменениями вследствие медленного роста опухоли, чем признаками озлокачествления [3].
Пилоидная астроцитома проявляет немалое разнообразие генетических аберраций. Слияние BRAF-KIAA1549, запускающее MAPK каскад, встречается в более 70% опухолей. Обнаруживаются также и другие слияния гена BRAF, его делеция и мутация V600E. Все эти генетические отклонения активируют MAPK каскад, что приводит к повышению пролиферативной активности клетки. Другими механизмами запуска этого сигнального пути являются спорадическая инактивирующая мутация гена NF1 или мутация двух аллелей гена при нейрофиброматозе 1 типа, KRAS мутации, точечные мутации N546K и K656E гена FGFR1, а также его слияние с геном ТАСС1; мутации гена RAF1, включая крайне редкое слияние с геном SRGAP3, и мутации в генах NTRK-семейства [2].
Таким образом, многое известно о генетической природе пилоидных астроцитом. Но существенно менее изученными остаются вторичные механизмы прогрессирования этих опухолей, играющие роль в реализации тех пролиферативных потенций, которые заложены в опухолевых клетках за счет наличия мутаций и находят свое выражение в опухолевом росте и прогрессии. Понимание этих механизмов является крайне важным как с точки зрения фундаментальной, поскольку это углубляет наше представление о базовых основах канцерогенеза в целом, так и с практической точки зрения – далеко не всегда ПА в силу своей сложной локализации могут быть доступны для радикального удаления, что нередко приводит к рецидивированию патологического процесса. При этом эффективных средств таргетной терапии для лечения таких пациентов не существует, как и надежных инструментов прогнозирования течения ПА.
При этом факторы, вовлеченные в процесс прогрессирования опухоли, должны обладать достаточно специфическими свойствами – способностью к быстрой активации и длительному поддержанию пластических молекулярных перестроек в опухолевых клетках. На эту роль идеально подходит особый вид атипических изоформ протеинкиназы C – протеинкиназа M ζ (ПК Mζ). ПК Mζ представляет собой альтернативный сплайсинговый вариант ПКС ζ, не содержащий регулирующего аутоингибиторного домена, поэтому после своего синтеза она остается активной до тех пор, пока не подвергнется разрушению [4; 5]. При этом ПК Mζ является абсолютно специфичной для мозговой ткани [6; 7]. В целом роль ПК Mζ при опухолевых заболеваниях практически не изучена. Было выявлено, что при остром лимфобластном лейкозе подобный ПК Mζ белок синтезируется в опухолевых клетках, участвуя в процессах канцерогенеза [8]. Однако при опухолях головного мозга роль данного фактора не изучена. Поэтому целью данного исследования явилось изучение взаимосвязи активности экспрессии ПК Mζ в ПА с показателями безрецидивной выживаемости.
Материалы и методы исследования
Группы исследования и их характеристика
В рамках ретроспективного, слепого, рандомизированного исследования были изучены 50 образцов опухолей пациентов с установленным диагнозом пилоидной астроцитомы (Grade I по ВОЗ) (ПА), проходивших хирургическое лечение в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» в 2009–2014 годах. Данные пациенты наблюдались в течение минимум пяти лет, им проводились регулярные (не реже двух раз в год) контрольные магнитно-резонансные томографические исследования головного мозга на предмет наличия рецидивов. При этом были сформированы две равные группы (по 25 пациентов): с наличием рецидива (РГ) и отсутствием рецидива (БРГ) по крайней мере в течение пяти лет. В качестве рецидива расценивались возникновение характерной для локализации опухоли клинической картины и несомненные МР-признаки появления рецидива опухоли в том же месте, что и первичной опухоли. Срок до возникновения рецидива рассчитывался как время в днях от операции по поводу первичной опухоли до выявления признаков рецидива.
В рамках данного исследования средний возраст пациентов на момент операции составил 11.55±1.54 года. Лиц мужского пола было 52%, женского пола - 48%. В РГ средний возраст пациентов составил 8.95±1.68 года, в то время как в БРГ данный показатель был на уровне 14.15±2.51 года. В РГ среднее время до возникновения рецидива составило 819.92±126.72 дня.
Проведение иммуногистохимического исследования
Для проведения исследования использовали парафиновые блоки с фиксированными образцами опухолей (в случае РГ брались образцы опухолей от первой операции), из которых изготовляли срезы с толщиной слоя 3 микрометра, проводили их депарафинирование, применяя ксилол, и затем выполнялась гидратация с помощью различных растворов этанола. После этого полученные препараты инкубировали с кроличьими моноклональными антителами против антигена ПК Mζ человека (Abcam, Великобритания) и с антикроличьими мышиными IgG антитeлом против пероксидазы хрена (Cell Marque, «Sigma-Aldrich», США). Сайты связывaния проявляли с помощью тетрагидрохлорида 3,3'-диаминобензидина (Ventana Medical Systems, США).
Обработка и анализ результатов иммуногистохимического исследования
Проводилось изучение препаратов с помощью светового микроскопа при увеличении x400 тремя патологами. Для определения активности экспрессии ПК Mζ проводился подсчет процента клеток, экспрессирующих данный маркер (ПКЭ Mζ), кроме того, оценивалась экспрессия полуколичественным методом histoscore. Результаты подсчета усредняли.
При определении histoscore ПК Mζ процент клеток, имеющих слабое окрашивание, умножался на один, процент клеток с умеренной интенсивностью окрашивания умножался на два, и, наконец, процент клеток с выраженным положительным окрашиванием умножался на три, после чего результат суммировался. Для оценки активности экспрессии маркера применялся цитоколориметрический метод с использованием микроскопа Carl Zeiss Scope.A1, камеры Axiocam 105 color (Zeiss AG, Германия) и программ для формирования и анализа изображений ZEN 2 (Zeiss AG, Германия), ImageJ (NIH, США) и Adobe Photoshop (Adobe Systems, США). Данные подсчета активности экспрессии тремя патологами усреднялись.
Статистическая обработка результатов исследования
Статистическая обработка выполнялась с помощью программного обеспечения Statistica 10 (StatSoft, США). Для выявления достоверности различий показателей активности экспрессии ПК Mζ в двух группах применялся U-критерий Манна-Уитни. Для вычисления влияния как ПКЭ Mζ, так и histoscore ПК Mζ на выживаемость проводился корреляционный анализ между этими двумя показателями по методу Спирмена. Различия считали достоверными при значении p<0.05.
Результаты исследования и их обсуждение
Результаты
Процент клеток с положительной экспрессией ПК Mζ в обеих группах
В ходе анализа результатов исследования было показано, что ПКЭ Mζ в БРГ составил в среднем 24.14±1.25%. При этом средний показатель ПКЭ Mζ в РГ бы выше и составил 34.36±1.52% (рисунок 1). Выявленные различия были статистически достоверными (p=0.000034, z=4.14).
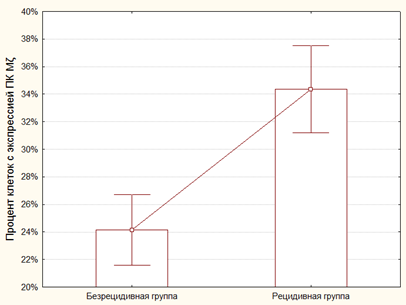
Рис. 1. Значения процента клеток, экспрессирующих ПК Mζ в БРГ и РГ. Уровень экспрессии данного маркера статистически достоверно выше в РГ, чем в БРГ (p=0.000034, z=4.14)
Показатели histiscore ПК Mζ в БРГ и РГ
Средний показатель histiscore ПК Mζ в БРГ составил 91.7±3.31%. При этом среднее значение histiscore ПК Mζ в РГ было выше и составило 120.46±3.6% (рисунок 2). Выявленные различия носили статистически достоверный характер (p=0.000006, z=4.51).
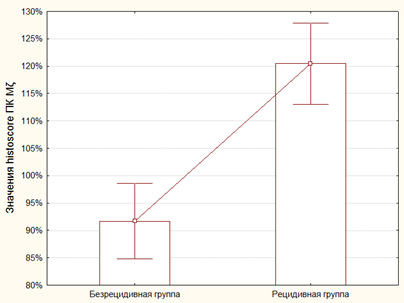
Рис. 2. Значения histiscore ПК Mζ в БРГ и РГ. Данный показатель статистически достоверно выше в РГ, чем в БРГ (p=0.000006, z=4.51)
Корреляция значений ПКЭ Mζ и histiscore ПК Mζ с временем до возникновения рецидива
При определении корреляционной зависимости между значениями ПКЭ Mζ и временем до возникновения рецидива было выявлено, что между данными показателями существует обратная корреляционная зависимость высокой степени (r=−0.9488) (рисунок 3А). Кроме того, при оценке наличия и выраженности корреляционной зависимости между histiscore ПК Mζ и временем до возникновения рецидива было обнаружено наличие обратной корреляционной зависимости между рассматриваемыми показателями также высокой степени (r=−0.9994) (рисунок 3Б).
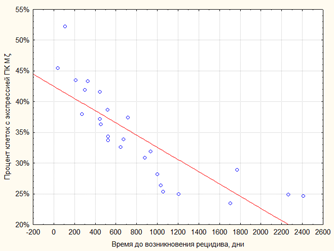 А
А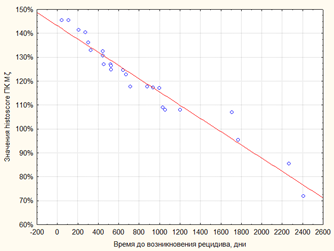 Б
Б
Рис. 3. Корреляция между показателями активности экспрессии ПК Mζ и временем до возникновения рецидива. А - выявляется наличие обратной корреляции между значениями процента клеток, позитивных для маркера ПК Mζ, и временем до возникновения рецидива высокой степени выраженности (r=−0.9488). Б - выявляется наличие обратной корреляции между значениями histoscore ПК Mζ и временем до возникновения рецидива высокой степени выраженности (r=−0.9994)
Обсуждение
Наиболее активно в рамках исследований ПА изучению подвергаются генетические модификации и перестройки. В пилоидных астроцитомах, как уже указывалось выше, наиболее принципиальными являются перестройки с участием гена BRAF. Чаще других выявляется слияние генов KIAA1549-BRAF, существенно реже наблюдается мутация BRAF V600E.
Тем не менее важнейшие патогенетические механизмы, не только непосредственно влияющие на процесс прогрессирования опухоли, но и определяющие функциональную активность отдельных опухолевых клеток, остаются во многом плохо охарактеризованными. В данном вопросе принципиальную роль играют эффекторные механизмы, способствующие реализации основных онкогенных потенций, заложенных в драйверных мутациях и перестройках онкогенов.
Как показывает наше исследование, ПК Mζ может играть очень важную роль в прогрессировании опухолевого процесса. Удалось показать наличие различий в активности экспрессии ПК Mζ между группой пациентов с пилоидными астроцитомами с безрецидивным течением послеоперационного периода и группой пациентов с рецидивным вариантом опухоли. Более того, мы выявили наличие корреляционной зависимости высокой степени между активностью экспрессии ПК Mζ и временем до возникновения рецидива.
Результаты данного исследования имеют как несомненную практическую, так и большую теоретическую значимость. С клинической точки зрения удалось выявить потенциальный ценный маркер для определения прогноза безрецидивной выживаемости, что будет способствовать разработке новых подходов к диагностике и наблюдению за такими пациентами. В фундаментальном отношении было показано, что ПК Mζ действительно может играть центральную эффекторную патогенетическую роль в развитии пилоидных астроцитом, так как выраженность её экспрессии коррелирует с активностью прогрессирования опухолевого процесса. Ключевое значение в канцерогенезе делает ПК Mζ перспективной мишенью для разработки средств таргетной терапии.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01034 мк.
Библиографическая ссылка
Никитин П.В., Рыжова М.В., Мурадян М.А., Галстян С.А., Зубова И.В. ПИЛОИДНЫЕ АСТРОЦИТОМЫ И ПРОТЕИНКИНАЗА MΖ: ЕСТЬ ЛИ СВЯЗЬ С ПРОГНОЗОМ? // Современные проблемы науки и образования. – 2019. – № 2. ;URL: https://science-education.ru/ru/article/view?id=28784 (дата обращения: 20.04.2024).



