Распространенность бесплодия составляет приблизительно 15% всех браков, при этом на мужские факторы приходится от 30 до 50% этого показателя [1]. Многочисленные исследования показывают, что качество и количество сперматозоидов у мужчин снижается из года в год [2].
Производство, передача, распределение и использование электроэнергии сопровождается воздействием на организм низкочастотных электромагнитных полей. Микроволновое излучение используется в многочисленных телекоммуникационных системах, поэтому изучение его влияния на биосистемы является актуальной задачей. Изучению влияния электромагнитных полей как высоких, так и низких частотных диапазонов на живые организмы посвящено достаточно большое количество работ. Были проведены комплексные исследования воздействия микроволнового излучения на компоненты мужской репродуктивной системы [3].
Щелочная фосфатаза (ЩФ) является ферментом, который катализирует отщепление фосфатных групп от нескольких субстратов. Этот фермент присутствует в секретах мужских половых желез, и его активность была обнаружена в сперме различных видов млекопитающих [4]. Присутствие ЩФ в секретах гениталий самцов предполагает роль в репродукции млекопитающих, и в частности в метаболизме сперматозоидов [5]. Однако до сих пор не было получено однозначных данных о роли ЩФ в процессах репродукции. Традиционным способом выяснения физиологической роли того или иного агента служит исследование его в условиях патологии или стрессовой ситуации.
Цель исследования: изучить свойства щелочной фосфатазы репродуктивной системы крыс в условиях гонадотоксического действия миллиметрового излучения слабой интенсивности и их связь с изменениями количественных и качественных параметров сперматогенеза.
Материал и методы исследования
Исследованию подвергались половозрелые самцы крыс (числом 42) линии Wistar массой 200 ± 10,0 г. Крыс содержали с 12/12-часовым циклом свет / темнота и свободным доступом к пище и воде в течение 8 недель, крысы были случайным образом разделены на две группы. Крыс в контрольной группе содержали в стандартных условиях, в то время как опытная группа О-1 подвергалась облучению микроволновым электромагнитным излучением низкой интенсивности, воздействие электромагнитным излучением осуществлялось в течение 30 дней по 30 мин. ежедневно. Для создания электромагнитного поля использовали генератор монохроматических электромагнитных волн («Явь-1-7,1»; λ = 7,1 мм; частота f = 42,194 ГГц). Таким образом, были сформированы две группы: контрольная (К) и опытная (О-1), по 21 животному в каждой. Работа с лабораторными животными выполнялась в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ № 755 от 12.08.88 МЗ СССР). Состояние тестикулярного сперматогенеза оценивали с помощью метода В.П. Маминой и Д.И. Семёнова [6]. Морфологическое исследование состояния ткани семенников и семенных канальцев проводилось на парафиновых срезах. Срезы семенников толщиной 7 мкм изготавливали на микротоме Microm HM-400 (Германия) и окрашивали гематоксилин-эозином. Полученные препараты изучались на универсальном микроскопе Nu (Германия), соединенном с цветной телевизионной камерой Pixera (США). Морфометрические исследования проводили с помощью компьютерной программы Image Tool (версия 3,0). Определяли продольные и поперечные диаметры извитых семенных канальцев, высоту сперматогенного эпителия, количество интерстициальных эндокриноцитов (клеток Лейдига) в пересчете на один семенной каналец. Для получения эякулята использовали метод электростимуляции семенного бугорка через слизистую прямой кишки [7], позволяющую получить max 0,6 мл семенной жидкости. Концентрацию сперматозоидов оценивали с использованием гемоцитометрической камеры Горяева. Две аликвоты (по 0,1 мл) спермы оставляли неразбавленными: одну использовали для получения семенной плазмы, а другую - для получения сперматозоидов для анализа активности ЩФ. Третью аликвоту (0,1 мл) спермы разводили в расширителе Kenney в концентрации 4,0х106 сперматозоидов/мл для анализа качества спермы (подвижность сперматозоидов, жизнеспособность, целостность митохондриальной мембраны). Кроме того, отдельно оценивали состояние сперматогенеза по морфологическим и кинетическим показателям эпидидимальных сперматозоидов. Концентрацию белка в семенной плазме и экстрактах сперматозоидов измеряли по методу Брэдфорда [8] с использованием БСА в качестве стандарта белка. Семенную плазму получали двумя последующими центрифугированиями аликвоты эякулята в центрифуге minispin plus при 12000 g в течение 15 минут при 4 °С. Полученный супернатант наблюдали на микроскопе для проверки отсутствия сперматозоидов или их фрагментов. Cперматозоиды дважды промывали в PBS (900 g в течение 3 минут при комнатной температуре). Затем осадок спермы обрабатывали ультразвуком в PBS и затем центрифугировали при 12000 g в течение 15 минут при 4 °С; наконец, осадок отбрасывали и супернатант анализировали на активность ЩФ. Активность ЩФ измеряли с помощью спектрофотометрического анализа, который отслеживает изменение поглощения при 405 нм, когда пара-нитрофенилфосфат (pNPP, бесцветный) превращается в пара-нитрофенол (желтый). Щелочную фосфатазу анализировали в 50 мМ трис-HCl-буфере при 25 °С при различных значениях рН (7,0, 8,0 и 9,0). Активность фермента выражали в виде удельной активности, нмоль / мин / мг белка [9].
Чтобы лучше охарактеризовать изоформу ЩФ, проводили термоингибирование ЩФ, как описано Bucci et al. [10]. Образцы выдерживали при 60, 65, 70 и 75 °С в течение 30 минут, затем помещали на лед и активность измеряли в течение 30 мин. при рН 9,0. Статистическую обработку полученных результатов проводили с использованием программы Statistica 6.0 (StatSoft). Поверку распределения результатов проводили по критерию Колмогорова-Смирнова, так как распределение показателей не отличалось от нормального (значимость различий оценивали по Стьюденту), для описания полученных количественных признаков данные представляли в виде средней (М) и ошибки средней (m). Различия между выборками считались достоверными при значении для р<0,05. Достоверность различий оценивали с помощью критерия Стьюдента. Количественная оценка линейной связи между двумя независимыми величинами определялась с использованием коэффициента ранговой корреляции по Спирмену
Результаты исследования и их обсуждение
В результате воздействия микроволнового излучения малой интенсивности было зафиксировано изменение структуры слоя клеток сперматогенного эпителия, изменение размеров клеток сперматогенного эпителия как в сторону увеличения, так и снижения. Отмечено достоверное увеличение случаев разрыва базальной мембраны. Если в контрольной группе в среднем наблюдалось 2-3 разрыва на 10 полей зрения, то в группе О-1 это число достигало 6-7. Морфометрические исследования показали в группе О-1 рост числа клеток Лейдига при снижении площади ядер клеток Лейдига с 23,0±1,01 мкм2 в контрольной группе до 14,2±2,3 мкм2 в группе О-1 (р<0,01). При хроническом воздействии микроволнового излучения малой интенсивности наблюдалось снижение общего количества сперматогенных клеток в сравнении с контролем (3140 ± 655 и 5236 ± 470 млн соответственно). Кроме того, отмечался дисбаланс между разными типами сперматогенных клеток. Наиболее уязвимыми к воздействию микроволн оказались сперматогонии-А, относительный уровень которых был заметно снижен по сравнению с контрольной группой (в контрольной группе 26,2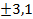 %, а после воздействия микроволнового излучения малой интенсивности – группа О-1 только 19,2
%, а после воздействия микроволнового излучения малой интенсивности – группа О-1 только 19,2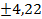 %, р < 0,001). Общее количество зрелых сперматозоидов снизилось в 1,5 раза в сравнении с контролем (P <0,001). В популяции сперматозоидов отмечалось двукратное увеличение процентного содержания патологических форм (микроцефалия, макроцефалия, аномальная форма головки, патология шейки, цитоплазматическая капля и т.п.) (45,2%) в сравнении с контролем (18,2%). Количество мёртвых сперматозоидов возросло в 6,5 раз.
%, р < 0,001). Общее количество зрелых сперматозоидов снизилось в 1,5 раза в сравнении с контролем (P <0,001). В популяции сперматозоидов отмечалось двукратное увеличение процентного содержания патологических форм (микроцефалия, макроцефалия, аномальная форма головки, патология шейки, цитоплазматическая капля и т.п.) (45,2%) в сравнении с контролем (18,2%). Количество мёртвых сперматозоидов возросло в 6,5 раз.
Как показано в таблице 1, активность ЩФ в семенной жидкости значительно различается в зависимости от трех анализируемых значений рН, увеличение активности очевидно с pH 7,0 до 8,0 (почти в 6 раз), а также с pH 8,0 до 9,0 (более чем в 8 раз). В результате воздействия микроволнового излучения малой интенсивности удельная активность ЩФ достоверно снижается и также зависит от кислотности окружающей среды. Однако следует отметить, что оптимум рН щелочной фосфатазы после воздействия микроволнового излучения малой интенсивности резко сужается, и если в контрольной группе активность ЩФ при рН 8,0 и 9,0 отличается более чем в 8 раз, то после воздействия микроволнового излучения малой интенсивности это различие составляет 31 раз, или точнее 3094,1% при рН=9.0 по отношению к активности при рН=8.0
Tаблица 1
Активность щелочной фосфатазы (ЩФ) в семенной плазме при разных значениях рН под воздействием микроволнового излучения малой интенсивности
|
Значения рН |
Контрольная группа (n=21) Удельная активность (нмоль/мин/мг белка) ЩФ в семенной плазме (М ± m) |
Опытная группа (n=21) Удельная активность (нмоль/мин/мг белка) ЩФ в семенной плазме (М ± m) |
р |
|
рН=7,0 |
11,1±2,2 |
4,6±1,2 |
<0,05 |
|
рН=8,0 |
64,2±12.8 |
13.7±3.8 |
<0,05 |
|
рН=9,0 |
531.2±49.7 |
423.9±18.1 |
<0,05 |
Tаблица 2
Активность щелочной фосфатазы (ЩФ) в экстрактах сперматозоидов при разных значениях рН
|
Значения рН |
Контрольная группа (n=21) Удельная активность (нмоль/мин/мг белка) ЩФ в экстрактах сперматозоидов (М ± m) |
Опытная группа (n=21) Удельная активность (нмоль/мин/мг белка) ЩФ в экстрактах сперматозоидов (М ± m) |
р |
|
рН=7,0 |
5.6±2.1 |
4.1±0.6 |
>0,05 |
|
рН=8,0 |
21.9±8.2 |
14.8 ±2.85 |
>0,05 |
|
рН=9,0 |
212.2±19.7 |
97.2± 24.5 |
<0,001 |
Как видно из табл. 2, ЩФ в экстрактах сперматозоидов проявляет свою максимальную активность при рН=9.0, так же как и в семенной плазме, увеличение активности очевидно с pH 7,0 до 8,0 (почти в 4 раза), а также с pH 8,0 до 9,0 (почти в 10 раз). В результате воздействия микроволнового излучения малой интенсивности удельная активность щелочной фосфатазы достоверно снижается, и особенно это проявляется при рН=9.0. В отличие от семенной плазмы, оптимум рН ЩФ после воздействия микроволнового излучения малой интенсивности не подвергается таким резким изменениям, как в семенной плазме, видимо, из-за фиксированного положения на мембране сперматозоидов.
Дальнейшее увеличение рН до 10, 11 и 12 показало заметное снижение активности ЩФ как в семенной плазме, так и в экстрактах сперматозоидов. Эти данные не вошли в таблицы 1 и 2, т.к. очевидным оптимумом рН для ЩФ как в контрольной, так и в опытной группах является рН=9,0. Сравнение активности ЩФ в районе оптимума рН во всех исследованных группах показало, что суммарная удельная активность ЩФ в экстрактах сперматозоидов и семенной плазмы контрольной группы составила в среднем 843,4 нмоль/мин/мг белка, а эта же сумма в опытной группе в среднем 521,1 нмоль/мин/мг белка, что составляет 62% от контрольной группы и является достоверным различием (р<0,01). Достоверное снижение активности ЩФ можно отнести к сперматоксическим эффектам миллиметрового излучения низкой интенсивности. Активность ЩФ семенной плазмы значительно выше, чем в экстрактах сперматозоидов (при всех протестированных значениях рН 7,0, 8,0 и 9,0), с минимальным средним соотношением соответственно 2,5: 1 при рН 9,0 и максимальным 3:1 при рН 8,0. Это неудивительно: другие авторы [10] показали, что вклад сперматозоидов в активность всего эякулята низок по сравнению с семенной плазмой. Однако эти исследователи получили лишь косвенное указание на активность ЩФ в сперматозоидах, поскольку они вычитали активность необработанных образцов спермы из активности семенной плазмы, тогда как в нашем исследовании мы обнаружили эффективную активность ЩФ непосредственно в экстрактах сперматозоидов. Роль ЩФ, прикрепленной к поверхности сперматозоидов, является более интригующей: в экстрактах сперматозоидов мы обнаружили значительное снижение активности ЩФ в опытной группе только при рН=9,0. Это снижение составило 2,9 раза, или 34,4% от контроля. При рН 7,0 и 8,0 эти различия недостоверны. При рассмотрении соотношения активности ЩФ в семенной плазме и в экстрактах сперматозоидов обнаружено, что в контрольной группе это соотношение составляет 1,88:1 в пользу семенной плазмы, в опытной группе это соотношение равно 4,4:1 (сравнивали только средние значения). Этому факту можно дать два объяснения. Во-первых, известно, что повреждающее действие микроволнового излучения обеспечивается резонансными колебаниями молекул биологических мембран [11]. Во-вторых, активность ЩФ в экстрактах сперматозоидов коррелирует с числом сперматозоидов в эякуляте. По нашим данным, при рН=9,0 активность ЩФ в экстрактах сперматозоидов в контрольной группе в расчете на 1 млн сперматозоидов составляет 3,17±0,12 нмоль/мин/мг белка. Активность ЩФ в экстрактах сперматозоидов в опытной группе в расчете на 1 млн сперматозоидов составляет 1,07±0,03 нмоль/мин/мг белка. Таким образом, даже в расчете на единицу концентрации сперматозоидов уровень ЩФ на поверхности сперматозоидов снижается более чем в 3 раза под действием микроволнового излучения слабой интенсивности.
Следует подчеркнуть, что активность ЩФ при физиологическом рН в сперме, равном 7,0, минимальна, и разумно предположить, что основная функция ЩФ реализуется после эякуляции, в процессе оплодотворения [12].
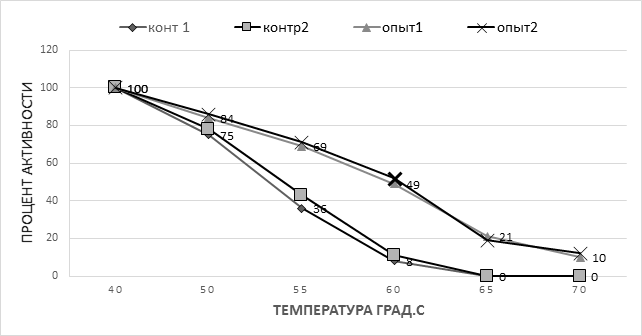
Зависимость активности щелочной фосфатазы от температуры (активность при 40 °С принята за 100%): конт 1 - активность ЩФ в семенной плазме контрольной группы;
контр 2 - активность ЩФ в экстрактах сперматозоидов контрольной группы;
опыт 1 - активность ЩФ в семенной плазме опытной группы; опыт 2 - активность ЩФ в экстрактах сперматозоидов опытной группы
Тест на тепловое ингибирование, проведенный в отношении активности ЩФ в семенной плазме, показал сложный характер снижения активности в зависимости от температуры. Как показано на рисунке, ЩФ в семенной плазме самцов белых крыс легко и быстро ингибируется под воздействием тепла, теряя 64% активности уже при 55 °С. Аналогично себя ведет и ЩФ в экстрактах сперматозоидов. В контрольной группе наблюдается достоверное повышение термостабильности ЩФ как в семенной плазме, так и в экстрактах сперматозоидов. Причем если при температуре 50 °С различия в снижении активности в контрольной и опытных группах составляют не более 10% и могут быть случайными (р>0,05), то при увеличении температуры до 55 °С активность ЩФ в контрольной группе сохраняется на уровне 70% от исходного (71% в семенной плазме и 69% в экстрактах сперматозоидов) и практически более чем на 30% выше, чем в контроле (рис.) (р<0,01). Активность ЩФ снижается в опытной группе ниже 10% от исходного уровня только при прогревании до 70 °С или на 10 градусов выше, чем в контрольной группе.
Микроволновое излучение не только влияет на активность ЩФ семенной плазмы и экстрактов сперматозоидов, но при исследовании термолабильности выясняется, что именно этот техногенный фактор изменяет устойчивость ЩФ к температуре. Возможных механизмов этого процесса несколько, но наиболее часто такие явления объясняют стабилизацией третичной структуры фермента под влиянием микроволнового излучения в случае отсутствия резонансных колебаний в структуре белка [13]. Молекулы фермента в функционально активном состоянии служат регуляторами физических и химических процессов, включенных в общую схему метаболизма, и управляют через белковые рецепторы функциями клеток репродуктивной системы. Акустоэлектрические колебания (волны Фрелиха) способны вызвать изменения третичной структуры белка-фермента. Эти изменения мы регистрируем как повышение термостабильности, но уплотнение трехмерной конфигурации может привести к изменению структуры активного центра и извращению функциональной способности фермента, что неминуемо скажется на нарушении функции органа или ткани [14]. В случае с ЩФ семенной плазмы и экстрактов сперматозоидов это может привести к расстройству репродуктивной функции и бесплодию. Подтверждением этому служит сравнение показателей качества сперматозоидов с активностью ЩФ.
Таблица 3
Коэффициент корреляции Спирмена между активностью ЩФ в экстрактах сперматозоидов и качеством спермы самцов белых крыс после воздействия низкоинтенсивного микроволнового излучения
|
Коэффициент корреляции r |
Достоверность взаимосвязи р |
|
|
ЩФ активность (нмоль/мин/мг белка) |
1,0 |
|
|
Концентрация сперматозоидов, млн |
0,471 |
0,032 |
|
% подвижных |
0,801 |
0,0087 |
|
% живых сперматозоидов |
0,784 |
0,0064 |
Примечание: r - коэффициент ранговой корреляции Спирмена, p – значимость корреляций.
В таблице 3 показана взаимосвязь между активностью ЩФ в экстрактах сперматозоидов и показателями качества сперматозоидов в опытной группе. Хотя в экстрактах сперматозоидов контрольной группы не было обнаружено корреляции между подвижностью и активностью ЩФ из экстрактов сперматозоидов (rs = 0,288), в образцах контрольной группы были зафиксированы положительные корреляции между активностью ЩФ в экстрактах сперматозоидов и процентом подвижных сперматозоидов (rs = 0,801), между активностью ЩФ в экстрактах сперматозоидов и процентом живых сперматозоидов (rs = 0,784).
Заключение
Полученные данные доказывают присутствие ЩФ на поверхности сперматозоидов самцов белых крыс и описывают активность фермента как в семенной плазме, так и в экстрактах сперматозоидов при разных значениях рН. Измерения при pH 7,0 указывают на то, что ЩФ в эякуляте далека от своего оптимума рН, поэтому ее роль заключается скорее в ингибировании капацитации, активация которой сопровождается активным дефосфорилированием. Активность на поверхности сперматозоидов при достижении маточно-трубного перехода может быть повышена за счет более высокого pH в этой части женского полового тракта. Кроме того, мы нашли некоторые интересные корреляции между ЩФ и параметрами качества спермы. Наконец, мы наблюдали снижение активности ЩФ после воздействия микроволнового излучения, которое приводит к повышению термостабильности этого фермента и снижению его функциональных возможностей, которые в совокупности с другими факторами могут лежать в основе идиопатического бесплодия.
Библиографическая ссылка
Николаев А.А., Ушакова М.В., Николаева Н.Н. ХАРАКТЕРИСТИКА АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В СЕМЕННОЙ ПЛАЗМЕ И В СПЕРМАТОЗОИДАХ САМЦОВ БЕЛЫХ КРЫС, ПОДВЕРГНУТЫХ ВОЗДЕЙСТВИЮ МИКРОВОЛНОВОГО ИЗЛУЧЕНИЯ МАЛОЙ ИНТЕНСИВНОСТИ // Современные проблемы науки и образования. – 2019. – № 6. ;URL: https://science-education.ru/ru/article/view?id=29311 (дата обращения: 20.04.2024).



