Среди осложнений гестации на протяжении длительного времени одно из лидирующих мест занимают гипертензивные расстройства, в частности преэклампсия. Данное патологическое состояние является ведущей причиной смертности и заболеваемости новорожденного и матери [1]. По данным литературных источников, частота преэклампсии составляет 7-23% [2].
Несмотря на экономические затраты по ведению пациенток с рассматриваемой патологией, частота преэклампсии не имеет тенденции к снижению. Развитие дисфункции эндотелия, по мнению ряда исследователей, является одним из механизмов развития преэклампсии [3].
Оксид азота относится к маркерам эндотелиального поражения, способствует успешной имплантации эмбриона, росту плода, адекватной перфузии котиледонов плаценты. Оксид азота также является мощным вазодилататором. Механизм развития преэклампсии связан с развитием ишемических изменений плацентарной ткани, что приводит к снижению кровотока в системе «мать-плацента-плод» и активации компенсаторных реакций по возобновлению перфузии плаценты [4]. При этом в условиях окислительного стресса клетки плацентарного ложа выделяют вазопрессорные вещества, которые усиливают эндотелиальную дисфункцию. В результате формируется порочный круг, способствующий прогрессированию артериальной гипертензии, следовательно, преэклампсии [5].
Указанные данные свидетельствуют о важности дальнейших научных исследований для углубленного изучения вопросов о роли изменения концентрации оксида азота, липидного метаболизма, продуктов перекисного окисления липидов, антиоксидантной системы (АОС) [6; 7]. В связи с этим можно предположить, что исследования в данной области дадут возможность разработать методы прогнозирования и рациональной профилактики преэклампсии.
Цель исследования: определить значимость некоторых триггерных агентов эндотелиальной дисфункции в развитии гипоксии плода при умеренной и тяжелой преэклампсии.
Материалы и методы исследования
Методом случайной выборки были отобраны 62 беременных, которые распределены по группам. Группа сравнения составили 16 беременных с физиологическим течением гестации. Величины необходимых показателей, полученные в группе сравнения, были использованы в качестве отправной точки как физиологически нормальные значения.
В состав исследуемой группы вошли 43 беременные с преэклампсией, разделенные на две подгруппы, соответственно степени тяжести, получавшие лечение в отделениях перинатального центра «Мордовской республиканской центральной клинической больницы» г. Саранска. Критериями включения явились срок гестации более 22 недель, возраст беременных от 18 до 45 лет, согласие беременной на участие в исследовании, изолированная преэклампсия. Критерии исключения следующие: тяжелая соматическая патология, ВИЧ-инфекция, туберкулез, психические заболевания.
Согласно классификации ВОЗ, первую подгруппу с симптомами умеренной преэклампсии составили 24 беременных. Во вторую подгруппу вошли 22 пациентки с диагностированной тяжелой преэклампсией.
В работе использованы общеклинические, лабораторно-биохимические методы исследования. Материалом для исследования служили плазма крови беременных, пуповинная кровь. Для определения концентрации малонового диальдегида (МДА) в плазме крови и эритроцитах использовали реакцию с 2-тиобарбитуровой кислотой с образованием окрашенного комплекса при высокой температуре в кислой среде. Измерение оптической плотности опытной пробы против холостой проводили при λ = 535 нм и λ = 570 нм в кювете с толщиной 10 мм.
Определение диеновых конъюгатов (ДК) в сыворотке крови основано на методе Z. Placer (1968), спектрофотометрирование проводили при λ = 233 нм.
Концентрацию каталазы определяли методом, основанным на способности перекиси водорода образовывать окрашенный комплекс с 4%-ным раствором молибдата аммония в присутствии плазмы крови. Интенсивность окраски полученного соединения измеряли при λ = 410 нм.
Активность супероксиддисмутазы (СОД) изучали методом, основанным на реакции супероксидзависимого окисления кварцетина и ингибирования данной реакции СОД, с последующим определением разницы оптической плотности (сразу же при добавлении кварцетина и через 15 минут при длине волны 406 нм).
Определение активности фосфолипазы А2 проводили титрометрическим методом с использованием 1%-ного раствора тритон Х-100. Оценивали активность фосфолипазы А2 в растворе, содержащем 150 ммоль, тритон Х-100, 10 ммоль трис-HCL-буфер (pH 8,0), 10 ммоль CaCl2 и субстрат (1,2 ммоль). В качестве субстрата использовали фосфатидилхолины яичного желтка. Регистрацию каталитической активности фермента оценивали на установке, состоящей из иономера ЭВ-74, электродной системы. Расчет выражали в мкмоль/с/г белка (Трофимов В.А., 1996).
Метод определения продуктов метаболизма NO в плазме основан на реакции с 6%-ным раствором сульфата цинка, с последующим фотометрическим определением нитрит-ионов с помощью реакции Грисса. Липиды из плазмы крови экстрагировали хлороформметаноловой смесью, фракционирование проводили методом тонкослойной хроматографии с использованием силикагелевых пластин. Молекулярный анализ спектра липидов получали на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware).
Полученные цифровые данные обрабатывали с помощью программ Microsoft Excel XP и IBM SPSS Statistics 24 методом вариационной статистики с использованием критерия t Стьюдента, корреляционную зависимость – критерия r. Для проверки выборок на нормальность распределения использовали критерий Лиллиефорса.
Результаты исследования и их обсуждение
Все беременные были рандомизированы по возрасту и соматическому состоянию. Возраст беременных, включенных в исследование, находился в пределах от 18 до 42 лет и составил в среднем 31,5±0,5 года при умеренной преэклампсии, 30,2±0,4 года – для тяжелой преэклампсии, 29,6±0,5 года для беременных с физиологическим течением гестации.
Исследование продуктов липопероксидации показало, что в плазме крови беременных с преэклампсией происходит интенсификация перекисного окисления липидов (ПОЛ) (табл. 1).
Таблица 1
Содержание ПОЛ-АОС, стабильных метаболитов оксида азота, фосфолипазы А2 в плазме беременных (M±m)
|
Показатель |
Здоровые беременные, n=16 |
Умеренная преэклампсия, n=24 |
Тяжелая преэклампсия, n=22 |
|
ДК, усл. ед./мг липидов |
0,25±0,013 |
0,41±0,026* |
0,49±0,023*1 |
|
МДА, нмоль/г белка |
2,56±0,17 |
3,47±0,28* |
4,89±0,43*1 |
|
Каталаза, мг H2O2 в мин/г белка |
0,0032±0,0002 |
0,0058±0,0003* |
0,0047±0,0002*1 |
|
СОД, усл. ед. |
4,59±0,23 |
3,09±0,23* |
2,76±0,24*1 |
|
Активность фосфолипазы А2, мкмоль/с/г белка |
0,081±0,013 |
0,171±0,012* |
0,391±0,014*1 |
|
Нитраты/ нитриты, мкмоль/л |
13,7±1,4 |
12,1±1,2* |
9,8±1,6*1 |
Примечание здесь и далее: * - достоверность данных по отношению к беременным группы сравнения при р<0,05; 1 - достоверность данных по отношению первой группы при р<0,05.
При умеренной преэклампсии (первая подгруппа) отмечено повышение уровня МДА по сравнению с нормальным уровнем на 35,5%, а ДК – на 64% (р<0,05). Интенсивность ПОЛ при тяжелой преэклампсии (вторая подгруппа) характеризуется большим повышением: содержание МДА по сравнению с референтными значениями увеличивалось на 91%, а ДК – на 96% (р<0,05). При сравнении содержания продуктов липопереокисления в плазме крови у беременных указанных подгрупп установлено их достоверное увеличение во второй подгруппе по сравнению с первой: уровень МДА был выше на 40,9%, а ДК – на 19,5%.
Анализ состояния каталазы в плазме крови показал, что при преэклампсии происходит активация данного фермента (табл. 1). При умеренной форме преэклампсии (первая подгруппа) отмечено повышение уровня каталазы по отношению нормы на 81,2%, при тяжелой (вторая подгруппа) – на 46,9% (р<0,05).
При изучении при преэклампсии активности другого антиоксидантного энзима – СОД – отмечено снижение активности фермента: при умеренной форме (первая подгруппа) она по сравнению с нормой падала на 32,7%, при тяжелой (вторая подгруппа) – на 39,9% (р<0,05).
Фосфолипаза А2 является компонентом защитной системы клеток, регулирующим образование окисленных липидов. В нашем исследовании отмечено значительное повышение активности данного фермента: при умеренной преэклампсии (первая подгруппа) – на 111% (р<0,05), при тяжелой (вторая подгруппа) – на 382% (р<0,05).
В развитии гипертензивных расстройств не систематизированы данные о роли нарушений синтеза оксида азота. Оксид азота обладает мощным вазодилатирующим и антитромбогенным эффектом. Некоторые исследователи отмечают уменьшение NO-синтазной активности в плацентарной ткани. Так, в работах Л.И. Дятлова и др. (2015) и О.Н. Сергеевна и др. (2015) выявлено нарастание концентрации метаболитов оксида азота в плазме беременных с преэклампсией, что может свидетельствовать о развитии компенсаторной реакции [8; 9].
В нашем исследовании при умеренной/ тяжелой преэклампсии обнаружено снижение уровня метаболитов оксида азота на 11,7 и 28,5% (р<0,05) соответственно относительно нормы.
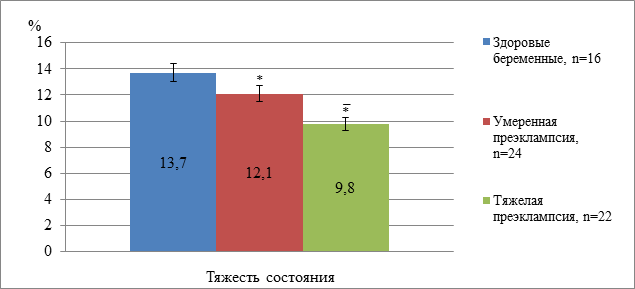
Содержание стабильных метаболитов оксида азота плазмы крови в исследуемых группах. Примечание: * - достоверность данных по отношению здоровых при р<0,05. – - достоверность данных по отношению к данным первой группы при р<0,05
В эритроцитах пуповинной крови отмечалось увеличение содержания диеновых конъюгатов на 38% при умеренной преэклампсии и на 52,4% – при тяжелой (p<0,05). Уровень МДА был увеличен на 21,9% и 28,1% при умеренной/тяжелой преэклампсии соответственно (p<0,05) (табл. 2).
Таблица 2
Содержание ПОЛ-АОС и фосфолипазы А2 в эритроцитах пуповинной крови у плодов (М±m)
|
Показатель |
Здоровые беременные, n=16 |
Умеренная преэклампсия, n=24 |
Тяжелая преэклампсия, n=22 |
|
ДК, усл. ед./мг липидов |
0,21±0,012 |
0,29±0,011* |
0,32±0,016*1 |
|
МДА, нмоль/г белка |
3,2±0,23 |
3,9±0,26* |
4,1±0,27* |
|
Каталаза, мг H2O2 в мин/г белка |
0,006±0,0005 |
0,005±0,0004 |
0,007±0,00031 |
|
СОД, усл. ед./мг белка |
11,12±0,63 |
10,21±0,51 |
10,32±0,63 |
|
Активность фосфолипазы А2, мкмоль/с/г белка |
0,36±0,014 |
0,76±0,04* |
0,91±0,03*1 |
Потенциал каталазы достоверно не отличался от контрольных показателей (табл. 2). Активность фосфолипазы А2 в эритроцитах плодов была повышена. Таким образом, в эритроцитах пуповинной крови у плодов беременных с преэклампсией возникает существенная интенсификация ПОЛ и фосфолипазной активности. Эти изменения были более выражены в группе беременных с тяжелой преэклампсией, в которой уровни ДК и фосфолипазы А2 превышали таковые в группе с легкой формой осложнения на 10,3 и 19,7% (p<0,05) соответственно, а активность каталазы была ниже на 40,1% (p<0,05) (табл. 2).
При интенсификации процессов липопероксидации происходит нарушение липидного метаболизма на тканевом и организменном уровнях. Результаты исследования количественного содержания липидов представлены в таблице 3.
Таблица 3
Количественное содержание липидов в плазме беременных при преэклампсии (M±m)
|
Показатель |
Здоровые беременные, n=16 |
Умеренная преэклампсия, n=24 |
Тяжелая преэклампсия, n=22 |
|
Суммарные фосфолипиды |
38,23±1,18 |
31,41±1,33* |
29,24±1,23* |
|
Холестерол |
36,83±1,17 |
32,12±1,18* |
31,16±1,19* |
|
Свободные жирные кислоты |
2,33±0,15 |
3,41±0,23* |
4,15±0,21*1 |
|
Эфиры холестерола |
7,23±0,41 |
10,24±0,23* |
12,23±0,42*1 |
|
Триацилглицеролы |
9,21±0,47 |
15,23±0,78* |
18,24±0,71*1 |
Полученные данные свидетельствуют, что при преэклампсии отмечается снижение уровня холестерола: при умеренной степени – на 12,8%, при тяжелой – на 15,4% (р<0,05) от нормального значения. Уровень свободных жирных кислот также изменился: при умеренной преэклампсии отмечено повышение на 46,4%, при тяжелой – на 78,1% (р<0,05).
При умеренной преэклампсии концентрация эфиров холестерола и триацилглицеролов была выше нормальных значений на 41,6 и 65,4% (р<0,05) соответственно. При тяжелой преэклампсии уровень рассматриваемых липидов был повышен в большей степени на 69,2% и 98% соответственно для эфиров холестерола и триацилглицеролов. Уровень суммарных фосфолипидов у пациенток с преэклампсией снижался (на 17,8 и 23,5% соответственно) (табл. 3).
Степень нарушения липидного компонента плазмы крови согласовалась со степенью тяжести заболевания. Этому свидетельствует повышение количества свободных жирных кислот, холестерола и триацилглицеролов в группе беременных с тяжелой преэклампсией по сравнению с легкой тяжестью на 21,7, 19,9 и 20,0% (р<0,05) соответственно.
Фракционный состав липидов при преэклампсии представлен в таблице 4. В нашем исследовании отмечены значительные изменения фосфолипидного состава плазмы крови беременных.
Таблица 4
Фракционный состав фосфолипидов в плазме крови беременных при преэклампсии, % (M±m)
|
Показатель |
Здоровые беременные, n=16 |
Умеренная преэклампсия, n=24 |
Тяжелая преэклампсия, n=22 |
|
Лизофосфолипиды |
1,53±0,09 |
3,63±0,36* |
4,48±0,26*1 |
|
Сфингомиелин |
12,63±1,71 |
17,61±1,73* |
18,23±1,81* |
|
Фосфатидилхолин |
37,45±1,52 |
33,41±1,58* |
31,23±1,36* |
|
Фосфатидилсерин |
6,54±0,23 |
6,43±0,21 |
7,56±0,411 |
У женщин при умеренной и тяжелой преэклампсии выявлены повышение концентрации лизофосфолипидов относительно нормы на 137,3 и 192,8% (р<0,05), сфингомиелина на 39,4 и 44,3% (р<0,05) соответственно. Данные изменения свидетельствуют о качественном изменении липидного спектра при исследуемой патологии. Также у обследуемых беременных отмечено снижение уровня фосфатидилхолина на 10,8 и 16,7% (р<0,05) при умеренной и тяжелой преэклампсии соответственно. Уровень фосфатидилсерина в исследуемых группах достоверно не отличался от нормы (табл. 4).
Таким образом, проведенный спектр исследований показывает, что при преэклампсии любой степени тяжести активизируются процессы, лежащие в основе мембрандестабилизирующих явлений в организме беременных. Кроме того, отмечено снижение концентрации оксида азота в плазме крови беременных в зависимости от степени тяжести рассматриваемого синдрома, что в целом свидетельствует о развитии эндотелиальной дисфункции, которая, безусловно, способствует прогрессированию преэклампсии. Установлена корреляционная зависимость между показателями мембранодестабилизирующих агентов (уровень молекулярных продуктов перекисного окисления мембранных липидов, фосфолипазной активностью) и концентрацией оксида азота в зависимости от тяжести преэклампсии (r=0,634-0,856, р<0,05). Во многом однонаправленные явления обнаружены и в пуповинной крови плодов. Полученный фактический материал дает основание утверждать, что указанный спектр патогенетических явлений – важнейший компонент развития гипоксии плода при преэклампсии.
Выводы
Развитие гипоксии плода при преэклампсии сопряжено с развитием эндотелиальной дисфункции, что во многом обусловлено мембранодестабилизирующими явлениями в виде существенных модификаций фосфолипидного состава в крови женщин с осложнённой беременностью.
Одними из триггерных агентов мембранодестабилизирующих процессов в крови беременных и плодов при преэклампсии являются чрезмерная активность фосфолипаз (на примере активности фосфолипазы А2) и оксидативный стресс.
Интенсивность перекисного окисления мембранных липидов и активность фосфолипаз сопряжены с тяжестью преэклампсии. При тяжелой преэклампсии указанные триггерные агенты мембранодестабилизирующих явлений существенно более выражены (на 15-23%) по сравнению с их активностью при легкой форме.
Библиографическая ссылка
Зобова Д.А., Власова Т.И., Тюрина Е.П., Маркина А.Е., Щекина С.А., Кортякова Л.Ю., Мохаммед Д.С. ЭНДОТЕЛИАЛЬНОЕ ПОРАЖЕНИЕ В РАЗВИТИИ ГИПОКСИИ ПЛОДА ПРИ ПРЕЭКЛАМПСИИ // Современные проблемы науки и образования. – 2019. – № 6. ;URL: https://science-education.ru/ru/article/view?id=29402 (дата обращения: 19.04.2024).



