Метаболический синдром (МС) представляет собой совокупность факторов, которые способствуют развитию сердечно-сосудистых заболеваний, в основе которых лежит атеросклероз сосудов, а также сахарного диабета 2-го типа. Не вызывает сомнений в настоящее время, что так называемый метаболический сердечно-сосудистый синдром, впервые описанный L. Opie (1992), имеет не только высокую распространенность во всем мире, но и является самостоятельным фактором риска в развитии заболеваний сердечно-сосудистой системы. Ранняя диагностика и предупреждение развития МС в настоящее время являются актуальной медико-социальной проблемой [1].
Начиная с середины XX в. в кардиологии уделяли достаточно много внимания участию почечной дисфункции в генезе гипертрофии левого желудочка (ГЛЖ) и артериальной гипертензии (АГ). Однако только на рубеже XX–XXI вв. стало очевидно, что даже незначительное почечное повреждение может ассоциироваться с высокой кардиоваскулярной летальностью. На современном этапе кардиология и нефрология очень тесно интегрированы между собой в связи с общими факторами риска патологии почек и заболеваний сердечно-сосудистой системы (ССС), универсальными механизмами патогенеза, взаимоотягощающим прогнозом, а также тесной взаимосвязью стратегии нефро- и кардиопротекции. В настоящее время в мире мы наблюдаем устойчивую тенденцию роста количества пациентов, имеющих коморбидные сердечно-сосудистые и ренальные поражения, что обусловлено увеличением средней продолжительности жизни и совершенствованием диагностики [2].
Известно, что заболевания ССС могут непосредственно приводить к прогрессированию почечной патологии и выступают одной из ведущих причин, способствующих развитию хронической болезни почек (ХБП) [3, 4]. Данные аспекты определяют актуальность поиска новых биологических маркеров, которые могли бы использоваться в практике с целью диагностики и составления прогноза в отношении риска развития осложнений со стороны ССС во взаимосвязи с почечной дисфункцией.
В последние годы рассматривается возможность использования некоторых почечных биомаркеров в оценке сердечно-сосудистых исходов у больных с ХБП, одним из которых является цистатин С. Он относится к семейству ингибиторов цистеиновых протеиназ. Известно, что цистатин С в стабильной концентрации экспрессируется во всех клетках организма, имеющих ядро [5–7]. Цистатин С принимает участие в таком процессе, как вне- и внутриклеточный протеолиз, способствуя предупреждению избыточной активации данного процесса под действием протеаз. Уровень цистатина С не имеет зависимости от пола, возраста, а также мышечной массы и в настоящее время рассматривается в качестве более раннего и чувствительного маркера почечной дисфункции по сравнению с уровнем креатинина [8–10].
Из литературных источников известно о корреляционной взаимосвязи уровня цистатина С с показателями, отражающими гипертрофию миокарда левого желудочка при АГ [11]. Однако по данным литературы практически не имеется информации о цистатине С в качестве маркера ГЛЖ у пациентов с метаболическим синдромом.
Целью исследования явилась оценка диагностической значимости цистатина С сыворотки крови в развитии гипертрофии миокарда левого желудочка у больных МС.
Материалы и методы исследования. Проведено обследование 127 пациентов, разделенных на две группы (группа сравнения и основная группа). Основная группа включала 65 больных с наличием МС, группа сравнения – 62 пациента с АГ, не имеющих признаков метаболических нарушений. В обследование были включены пациенты терапевтического отделения ГБУЗ Республики Мордовия «РКБ № 5» г. Саранска за период наблюдения 2017–2019 гг. В исследование не были включены пациенты, имеющие в анамнезе ишемическую болезнь сердца в варианте стенокардии напряжения III–IV функционального класса (ФК) и инфаркта миокарда, оперативные вмешательства при заболеваниях сердца в анамнезе, поражение клапанов сердца (гемодинамически значимые); искусственные водители ритма, хроническую сердечную недостаточность II–IV ФК. Проводилось анкетирование пациентов, в ходе которого уточняли возраст, рост, вес, длительность АГ и МС. В основной группе пациентов средний возраст составил 60,3±2,3 года, в группе сравнения – 56,5±2,4 года. Гипертонический анамнез основной группы составил 18,07±1,80 года, в группе сравнения – 14,70±0,51 года. Анализировались истории болезни, данные лабораторно-инструментальных методов исследования: креатинин сыворотки крови, цистатин С, липидный спектр, данные эхокардиоскопии (ЭХО-КС). Методом иммунотурбидиметрии определяли уровень концентрации цистатина С в крови. За норму были взяты предлагаемые производителем реагентов референтные значения цистатина С – 0,5–1,2 мг/л. Скорость клубочковой фильтрации рассчитывали по формуле CKD-EPI, 2009 г., в модификации от 2011 г.
Каждому больному проводилась ЭХО-КС (аппарат Esaote My Lab Сlass C (Италия)) с оценкой толщины задней стенки левого желудочка (ТЗС ЛЖ), толщины межжелудочковой перегородки (ТМЖП), конечного диастолического размера ЛЖ (КДР ЛЖ), конечного систолического размера ЛЖ, размера левого предсердия, фракции выброса.
Для определения типа ремоделирования ЛЖ рассчитывали следующие показатели: индекс относительной толщины стенок ЛЖ (ИОТС), массу миокарда ЛЖ (ММЛЖ), индекс ММЛЖ. Типы ремоделирования ЛЖ выделяли в соответствии с рекомендациями по количественной оценке структуры и функции камер сердца [12].
Обработка полученных данных проводилась с использованием программ Microsoft Office XP и Microsoft Office Excel. Производился расчет средних арифметических (М), ошибки средних арифметических (m). Достоверность различий между группами определялась с использованием t-критерия Стьюдента (достоверными считались различия при р<0,05). Используя коэффициент корреляции r, определяли корреляционную зависимость между анализируемыми показателями. Непараметрический корреляционный анализ Спирмена использовали для выявления и оценки связей между исследуемыми показателями.
Результаты исследования и их обсуждение
Анализ компонентов МС показал, что у пациентов основной группы преобладал 4-компонентный МС, который выявлялся в 61,50% случаев; 3-компонентный МС имели 26,9% больных. При этом в структуре 3-компонентного МС преобладало сочетание абдоминального ожирения (АО), артериальной гипертензии и нарушения толерантности к глюкозе (НТГ) – в 26,9% случаев.
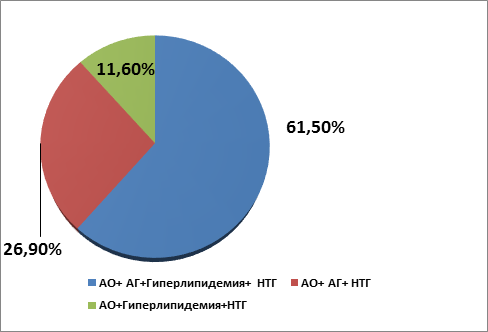
Рис. 1. Компоненты метаболического синдрома в основной группе больных
Пациенты основной группы имели достоверно более высокие показатели креатинина крови (уровень креатинина в основной группе составил 98,3±3,2 мкмоль/л, в группе сравнения – 85,2±0,1 мкмоль/л (p<0,05)).
Также выявлено достоверно более выраженное снижение СКФ у пациентов основной группы (показатель СКФ составил в основной группе 86,7±2,45 мл/мин/1,73 м², в группе сравнения – 71,7 ± 3,5 мл/мин/1,73 м² (p<0,05)).
При определении уровня цистатина С выявлены достоверно более высокие показатели у пациентов с МС (уровень цистатина С в основной группе составил 1,38±0,03 мг/л, в группе сравнения – 1,19±0,03 мкмоль/л). Разница между анализируемыми группами составила 16% (p<0,05).
При анализе эхокардиографических показателей выявлено, что пациенты с МС имели достоверно большие показатели ТЗС ЛЖ и ТМЖП (1,38±0,02 см и 1,4±0,03 см) по сравнению с пациентами с АГ без метаболических нарушений (в основной группе показатель составил 1,01±0,03 см, в группе сравнения – 1,2±0,02 см) (р<0,001). Также были выявлены достоверно более высокие показатели ИОТС в группе больных с МС, которые на 20,5% превышали данные группы сравнения (р<0,001). Показатели ММЛЖ (в основной группе – 369,1±19,7 г и 308,0±21,1 г в группе сравнения; разница – 19,8% (р<0,05)) и ИММЛЖ (в основной группе – 191,0±3,25 г и 167,9±4,45 г – в группе сравнения; разница – 13,8% (р<0,05)) были достоверно выше в основной группе пациентов (р<0,05) (табл. 1).
Таблица 1
Показатели ЭХО-КС в основной группе и в группе сравнения
|
Показатель |
Группа сравнения, n=62 |
Основная группа, n=65 |
|
ТЗС ЛЖ, см |
1,01±0,03 |
1,38±0,02 (р<0,001) |
|
ТМЖП, см |
1,2±0,02 |
1,4±0,03 (р<0,001) |
|
КДР ЛЖ, см |
5,44±0,09 |
6,23±0,2 (р>0,05) |
|
ИОТС |
0,44±0,01 |
0,53±0,02 (р<0,001) |
|
ММЛЖ, г |
308,0±21,1 |
369,1±19,7 (р<0,05) |
|
ИММЛЖ, г/м2 |
167,9±4,45 |
191,0±3,25 (р<0,05) |
Примечание: достоверность различий p между данными основной группы и группы сравнения; различия достоверны при р<0,05.
При анализе эхокардиографических показателей были выявлены различия в типах ремоделирования ЛЖ. У пациентов группы сравнения в 50% случаев имела место концентрическая ГЛЖ. Эксцентрическая ГЛЖ наблюдалась также у 50% больных. В группе пациентов с метаболическими нарушениями в 74% случаев выявлялась концентрическая ГЛЖ, у 21,4% больных была обнаружена эксцентрическая ГЛЖ, с нормальным типом геометрии ЛЖ было выявлено 4,6% пациентов (рис. 2).
На следующем этапе был проведен корреляционный анализ между уровнем цистатина С и эхокардиографическими показателями (табл. 2). Выявлена прямая корреляционная зависимость показателя цистатина С от ИОТС (р<0,05), ММЛЖ (р<0,05) и ИММЛЖ (р<0,05), достоверно более выраженная у пациентов с МС (табл. 2).
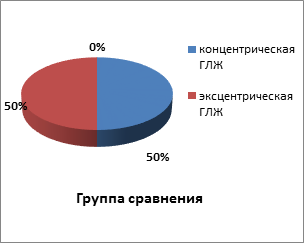
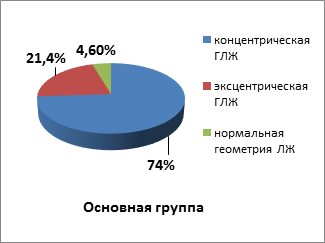
Рис. 2. Типы ремоделирования левого желудочка в исследуемых группах больных
Таблица 2
Корреляционная зависимость показателя цистатина С от эхокардиографических показателей
|
Цистатин С |
||
|
Показатели |
Основная группа (n=65) |
Группа сравнения (n=62) |
|
ТМЖП |
0,76 |
0,53 |
|
ИОТС |
0,68 |
0,46 |
|
ММЛЖ |
0,84 |
0,64 |
|
ИММЛЖ |
0,75 |
0,58 |
Примечание: жирным шрифтом показана достоверность корреляционной связи, оцененная по коэффициенту корреляции r.
Была проанализирована связь между показателем цистатина С и типом ремоделирования ЛЖ в обеих группах. Выявлено, что уровень цистатина С коррелирует с концентрической ГЛЖ ((р<0,05) в обеих группах. Полученные результаты не противоречат результатам исследования Dallas Heart Study [11], в котором оценивали связь показателя цистатина С со структурными и функциональными изменениями миокарда ЛЖ в общей популяции. В результате были получены данные, что уровень цистатина С имел корреляционную связь с ИММЛЖ, толщиной стенки ЛЖ (р<0,001), а также с концентрическим типом ремоделирования миокарда ЛЖ (р=0,027) [11].
В настоящее время по данным литературы существуют три основные гипотезы, объясняющие связь цистатина С с концентрическим типом ремоделирования сердца:
1) цистатин С может быть надежным прогностическим фактором доклинических структурных изменений со стороны сердечно-сосудистой системы, так как он более точно оценивает функцию почек по сравнению с креатинином и СКФ;
2) уровень цистатина С коррелирует с гипертрофией левого желудочка, которая определяет его ремоделирование;
3) цистатин С не только непосредственно служит маркером почечной дисфункции, но также связан с развитием изменений структуры сердца.
В заключение следует отметить, что наличие выраженной и тесной взаимосвязи, формирующейся между патологией ССС и почек, общеизвестно. Важно констатировать, что взаимоотношения изменений ССС и дисфункции почек имеют многогранный характер. Они, как правило, выстраиваются по принципу обратной связи. При этом почка, с одной стороны, может выступать в качестве органа-мишени для действия многих известных факторов, связанных с изменениями в ССС; с другой – активно вмешиваться в формирование системных метаболических и сосудистых патологических процессов, являясь в свою очередь генератором традиционных и нетрадиционных факторов риска. Таким образом, в итоге формируется замкнутый и сложный патогенетический круг, который определяет дальнейшую судьбу пациентов. Подобный взгляд на взаимообусловленность патологических процессов в ССС и почках, двунаправленность действия факторов риска, предсказуемость в клиническом аспекте конечных результатов такого сочетания дают основание рассматривать это взаимодействие как непрерывную цепь событий, составляющих основу кардиоренального континуума [13]. Цистатин С при этом может выступать в роли предиктора риска сердечно-сосудистых заболеваний.
Выводы
1. Проведенное исследование выявило у пациентов с МС достоверно более высокую распространенность прогностически неблагоприятных вариантов ремоделирования ЛЖ (ЭГ и КГ) по сравнению с больными АГ, не имеющими метаболических нарушений.
2. Уровень цистатина С достоверно выше у больных АГ с МС в сравнении с больными АГ, не имеющими метаболических нарушений.
3. Показатель цистатина С имеет прямую корреляционную зависимость от ИММЛЖ, толщины стенки ЛЖ, ИОТС (р<0,05) и концентрической ГЛЖ (р<0,05).
4. Цистатин С сыворотки крови можно использовать в качестве раннего маркера ГЛЖ у пациентов с метаболическим синдромом.
Библиографическая ссылка
Полозова Э.И., Сорокина Н.Н., Пузанова Е.В., Сеськина А.А. ЦИСТАТИН С КАК МАРКЕР ГИПЕРТРОФИИ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. – 2020. – № 1. ;URL: https://science-education.ru/ru/article/view?id=29538 (дата обращения: 20.04.2024).



