До сегодняшнего дня по оценкам Всемирной организации здравоохранения (ВОЗ) считалось, что 1/3 населения земного шара инфицирована микобактериями туберкулеза, без клинических проявлений, что характерно для ЛТБИ [1; 2] Такие данные основались на результатах кожной пробы Манту с 2 ТЕ [3]. В 1998 году был расшифрован геном микобактерии туберкулеза. При сравнении геномов М. bovis и M. bovis BCG была определена генетическая зона RDI, которая присутствует во всех штаммах М. tuberculosis и патогенных штаммах М. bovis, но отсутствует во всех штаммах вакцины М. bovis BCG и в большинстве нетуберкулезных микобактерий [4]. Это стало толчком для дальнейшего исследования идеального белка, подходящего для дифференциальной диагностики. Особый интерес вызвали белки CFP (culture filtrate protein) 10 и ESAT (early secreted antigenic target) 6, которые закодированы в зоне RDI генома микобактерии туберкулеза, экспрессирующегося при размножении бактерий, и не содержатся в нетуберкулезных микобактериях и микобактерии Bovis BCG [5-7]. Были разработаны в мире IGRA-тесты, такие как QuantiFERON-TB (QFT), введенный в 2001 году, в 2002 году компанией Oxford Immunotec ELISPOT - T-SPOT.TB, и тест QFT Gold (QFT-G), введенный в 2005 году. Проведен метаанализ между IGRA-тестами и кожной пробой Манту с 2 ТЕ. По результатам данного метаанализа было выявлено, что только четвертая часть земного шара инфицирована микобактериями туберкулеза [8].
Недостатками новых тестов являются их высокая стоимость, необходимость в лабораторном оснащении, требования к обработке забранного на исследование материала (кровь) для поддержания жизнеспособности лимфоцитов, а также необходимость проведения теста in vitro (что затрудняет применение данного теста для скринингового метода у детского населения).
В качестве альтернативы 2008 году НИИ молекулярной медицины ММА им. И.М. Сеченова разработан новый препарат для аллергодиагностики туберкулёза – аллерген туберкулёзный рекомбинантный, выпускается под торговым наименованием «ДИАСКИНТЕСТ®», который представляет собой рекомбинантный белок CFP-10-ESAT-6, продуцируемый генетически модифицированной культурой Escherichia coli BL 21 (DE3) /CFP-ESAT. Содержит два связанных между собой антигена - CFP-10 и ESAT-6, присутствующих в вирулентных штаммах микобактерий туберкулёза, в том числе M. tuberculosis и М. bovis [9; 10]. Основным механизмом действия теста также является формирование реакции гиперчувствительности замедленного типа. При этом белок CFP-10-ESAT-6 не обладает сенсибилизирующей активностью и не токсичен. Методика проведения теста схожа с постановкой пробы Манту с 2 ТЕ. Результат также оценивается через 72 часа. В основе данного теста, как и при пробе Манту с 2 ТЕ, лежит реакция гиперчувствительности замедленного типа. Однако если на чувствительность к туберкулину влияет иммунный ответ на смесь более 200 антигенов M. tuberculosis, в том числе и на нетуберкулезные микобактерии, то при проведении пробы с АТР реакция развивается преимущественно на наличие именно M. tuberculosis complex [11-13].
В Кыргызской Республике (КР) сохраняется неблагоприятная эпидемиологическая ситуация по туберкулезу среди населения, включая детей и подростков. Средние многолетние показатели заболеваемости туберкулезом у детей за 2015-2018 годы составили 21,4 на 100 000 детей (рис.). Как видно на рисунке, за последние годы в республике отмечается стабильная динамика снижения показателя заболеваемости туберкулезом среди указанного контингента.
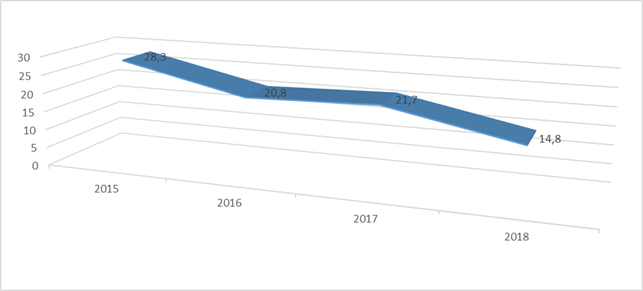
Заболеваемость детей в возрасте до 14 лет в КР, на 100 000 детского населения
Данный препарат был зарегистрирован на территории КР в 2014 году. В начале 2015 года в городе Бишкек и в Чуйской области применен препарат ДСТ, для раннего выявления инфицированных лиц микобактериями туберкулеза.
Цель исследования: изучение эффективности двух методов выявления туберкулезной инфекции у детей школьного возраста с применением традиционной пробы Манту и ДСТ в условиях г. Бишкека и в Чуйской области.
Материалы и методы исследования. Перед проведением обследования детей школьного возраста было получено информированное согласие одного из родителей ребенка. Всего детей, родители которых дали согласие на исследование, было 3581 в возрасте от 7 до 14 лет. Девочек было 1821 (51,7%), мальчиков 1760 (48,3%). Дети входили в категорию здоровых и были учащимися средних школ. Дети были распределены на две возрастные группы: 1873 детей в возрасте 7-10 лет (ученики младших школьных классов) и 1708 детей в возрасте 11–14 лет (ученики старших школьных классов).
Всем детям одновременно проведена постановка кожной пробы с аллергеном туберкулезным рекомбинантным и пробы Манту с 2 ТЕ ППД-Л. Техника постановки внутрикожной пробы с аллергеном туберкулезным рекомбинантным идентична постановке пробы Манту. Оценка результатов пробы ДСТ соответствовала инструкции по применению препарата, утвержденной 19.06.2008 года, регистрационный номер ЛСР – 006435/08 от 11.08.2008 г.
Интерпретация пробы Манту с 2 ТЕ проведена согласно клиническому протоколу КР по туберкулезу у детей [14].
Статистическая обработка результатов исследования сводилась к расчету долей и 95% доверительного интервала (ДИ) для долей, а также сравнению долей с помощью Z-критерия в среде программы SPSS – 16.0. Представленные результаты статистически обработаны, достоверность подтверждена.
Результаты исследования и их обсуждение
Результаты нашего исследования показали следующее. Среди всех детей в возрасте 7-14 лет (3581) отрицательная реакция при постановке пробы Манту констатирована у 2371 (66,6%) обследованного, положительные пробы у 1210 (33,8%) детей, гиперергическая реакция (из числа лиц с положительными реакциями) – у 558 (46,1%) обследованных. Характер кожных реакций у указанных детей на аллерген туберкулезный рекомбинантный был представлен следующим образом: 83,9%, 16,1% и 62,1% соответственно. Частота положительных реакций при постановке пробы с туберкулином ППД-Л выявлена по сравнению с пробой ДСТ в 2 раза выше, а частота гиперергических проб отмечена в 1,3 раза ниже (табл. 1).
Таблица 1
Результаты проб Манту с 2 ТЕ ППД-Л и ДСТ у детей школьного возраста (7-14 лет)
|
Возрастные группы |
Результаты иммунологических тестов (размеры реакции) |
||||||
|
Проба Манту с 2 ТЕ ППД-Л |
Проба с ДСТ |
||||||
|
Отрица тельный |
Положи тельный |
Гиперер. (из числа полож.) |
Отрица тельный |
Положи тельный |
Гиперер. (из числа полож.) |
||
|
7-10 лет, n =1873 (%) |
1281 (68,4) |
592 (31,6) |
282 (47,6) |
1592 (85,0) |
281 (15,0) |
168 (59,7) |
|
|
11-14 лет, n =1708 (%) |
1090 (63,8) |
618 36,2) |
276 (44,7) |
1411 (82,6) |
297 (17,4) |
191 (64,3) |
|
|
Всего, n= 3581 (%) |
2371 (66,2) |
618 (33,8) |
558 (46,1) |
3003 (83,9) |
578 (16,1) |
359 (62,1) |
|
Анализ результатов пробы Манту с 2 ТЕ ППД-Л в двух возрастных группах свидетельствует о том, что с увеличением возраста динамика показателей реакций имеет тенденцию к нарастанию. Однако указанное явление не относится к гиперергическим реакциям. При анализе данных, касающихся результатов пробы с применением ДСТ, нами было установлено статистически достоверное увеличение числа детей с гиперергической реакцией в возрасте 11–14 лет (63,3% против 59,7%). Положительно реагирующие на внутрикожную пробу ДСТ отмечены у 578 (16,1%), что составило 16,6% из всех лиц, положительно реагирующих на кожную пробу Манту с 2 ТЕ.
Среди детей в возрасте 7-10 лет удельный вес положительной пробы Манту с 2 ТЕ ППД-Л составил 36,6%, а гиперергические пробы (из числа положительных реакций) – 47,6% соответственно. Наиболее часто гиперергические реакции были выявлены у детей 7-летнего возраста (20,9%). Частота положительных реакций при постановке пробы с ДСТ в сравнении с пробой Манту оказалась значительно ниже и составила 15,0%, т.е. в 2,1 раза меньше. Результаты гиперергических реакций при постановке ДСТ заметно преобладали над показателями подобных реакций при постановке пробы Манту (59,7% против 47,6% соответственно, P<0,001). У 10-летних детей частота гиперергических реакций оказалось самой высокой (10,0%).
При оценке результатов двух иммунологических тестов у школьников в возрасте от 11 до 14 лет были показаны такие же статистические данные и тенденции в динамике показателей, сходные у детей в возрасте 7-10 лет, но с незначительным увеличением частоты положительных и гиперергических реакций. Частота положительных реакций при постановке внутрикожной пробы Манту с 2 ТЕ ППД-Л у детей от 11-14 возрастных групп составила 36,2%, гиперергические реакции – 44,7%, а показатели указанных реакций при постановке с ДСТ 17,4% и 64,3% соответственно.
При анализе полученных результатов нами было отмечено, что при постановке внутрикожной пробы Манту 2 ТЕ ППД-Л положительные результаты выявляются чаще по сравнению с внутрикожной пробой ДСТ, а отрицательные результаты проб, исключающие ложноположительные данные, чаще получены при ДСТ.
Полученные данные двух сравниваемых проб оказались высоко статистически значимы и приведены в таблицах 2 и 3. P = 0,000.
Таблица 2
Сравнение долей по результатам положительных проб: Манту с 2 ТЕ и аллерген туберкулезный рекомбинантный (ДСТ)
|
Возраст, лет |
Манту С 2 ТЕ ППД-Л (95% ДИ) |
ДСТ (95% ДИ) |
Z Р |
|
7-10 |
0,316 (0,295 – 0,338) |
0,150 (0,134 - 0,167) |
12,02 0,000 |
|
11-14 |
0,362 (0,339 – 0,385) |
0,174 (0,157 - 0,193) |
12,4 0,000 |
|
Всего |
0,334 (0,323 - 0,354) |
0,161 (0,150 - 0,174) |
17,25 0,000 |
Таблица 3
Сравнение долей по результатам гиперергических из числа положительных проб: Манту с 2 ТЕ и аллерген туберкулезный рекомбинантный (ДСТ)
|
Возраст, лет |
Проба Манту с 2 ТЕ ППД-Л (95% ДИ) |
ДСТ (95% ДИ) |
Z Р |
|
7-10 |
0,476 (0,436 – 0,517) |
0,598 (0,540 - 0,653) |
3,36 0,001 |
|
11-14 |
0,447 (0,408– 0,486) |
0,643 (0,587 - 0,695) |
5,57 0,000 |
|
Всего |
0,461 (0,433 - 0,489) |
0,621 (0,581 - 0,660) |
6,33 0,000 |
По результатам пробы аллергена туберкулезного рекомбинантного были сгруппированы дети для диспансерного учета по III группе, то есть группе риска по заболеванию туберкулезом. Согласно клиническому протоколу по туберкулезу у детей [14] в III (а) группе находятся под наблюдением дети с ЛТБИ, а в III (б) группу будут включены дети из контакта с активным туберкулезным процессом.
Таблица 4
Результаты скрининга детей на туберкулезную инфекцию (n = 3581)
|
Результаты |
Методы скрининга |
|||
|
Проба Манту, абс. (%) |
Проба с АРТ, абс. (%) |
|||
|
Направлены на консультацию к фтизиатру |
1210 |
33,8 |
578 |
16,1 |
|
Из них взято на диспансерный учет всего |
576 |
47,7 |
188 |
32,5 |
|
В I группу |
26 |
2,1 |
33 |
6,1 |
|
В III A группу |
389 |
32,1 |
141 |
11,6 |
Дети с положительными пробами на Манту и ДСТ были обследованы у фтизиатров, и по результатам были сформированы группы диспансерного учета (табл. 4). Согласно данным результата пробы Манту под диспансерное наблюдение взято 389 (10,8%) инфицированных детей (размер инфильтрата у которых 10 мм и более), у 26 (0,7%) заподозрен активный туберкулез. Всего наблюдению с применением пробы Манту подлежало 576 (16,1%) детей.
Таким образом, использование аллергена туберкулезного рекомбинантного дало возможность исключить у 248 (7,0%) детей ЛТБИ и включить в 3 А группу диспансерного учета 141 (3,9%) ребенка. Дети после положительного результата ДСТ подлежали дополнительному рентгено-томографическому обследованию, где у 33 (1,0%) детей подтвердилось локальное поражение туберкулезом органов дыхания. Дети по месту жительства зарегистрированы, подключено превентивное лечение. По результатам кожной пробы Манту с 2 ТЕ под наблюдение и подключение превентивной терапии попадало 576 (16,1%) детей, что превышает в 2 раза по сравнению с показателями результатов ДСТ, и было снижено до 141 (3,9%) случая. Нами было установлено, что у лиц с положительной реакцией на пробы Манту частота выявления туберкулеза составляла 2,1%, а среди детей с положительной реакцией на пробы с ДСТ – 4,7%, т.е. в 2 раза чаще (р <001), и у 4 обследованных установлены в органах дыхания посттуберкулезные изменения. Группы риска по кожной пробе Манту с 2 ТЕ показывают, что при гиперергических реакциях на внутрикожную пробу Манту с 2 ТЕ частота положительных реакций на пробу ДСТ значительно высокая и достигает 51,9% детей.
Заключение. По результатам данного исследования пришли к выводу, что число положительных реакций у детей в возрасте 7-14 лет при проведении внутрикожной пробы Манту с 2 ТЕ значительно больше, чем при постановке пробы с аллергеном туберкулезным рекомбинантным (ДСТ) (33,8% против 16,1%). А дополнительное рентгено–томографическое обследование положительно реагирующих на ДСТ детей дает целенаправленное и своевременное выявление локальных форм активного туберкулеза, что говорит о необходимости включения данного теста для массового скрининга детей в КР. Применение современных диагностических методов также позволило сократить число детей, подлежащих превентивной химиотерапии (P=0,000), что имеет также экономическую ценность.
Вышеизложенные данные обосновывают необходимость пересмотра общепринятых противотуберкулезных мероприятий в работе врача-фтизиопедиатра. Исследование статистически и научно обосновано для внесения изменений в противотуберкулезные мероприятия в Кыргызской Республике для исключения гипердиагностики тубинфицирования и локального туберкулеза у детей школьного возраста.
Конфликт интересов: авторы заявляют об отсутствии конфликта.
Библиографическая ссылка
Байтелиева А.К., Сооронбаев Т.М., Чубаков Т.Ч., Мойдунова М.М., Естебесова Б.М., Молдобекова Э.М. СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ АЛЛЕРГЕНА ТУБЕРКУЛЕЗНОГО РЕКОМБИНАНТНОГО И ТУБЕРКУЛИНА ППД-Л ДЛЯ СКРИНИНГА ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ У ДЕТЕЙ ШКОЛЬНОГО ВОЗРАСТА В КЫРГЫЗСКОЙ РЕСПУБЛИКЕ // Современные проблемы науки и образования. – 2020. – № 2. ;URL: https://science-education.ru/ru/article/view?id=29610 (дата обращения: 19.04.2024).



