Бронхиолярные нереснитчатые клетки впервые были описаны швейцарским врачом, анатомом и физиологом Рудольфом Альбертом фон Колликером в 1881 году, но его открытие было забыто на многие десятилетия. В 1937 году австрийский патолог Макс Клар вновь описал в эпителии бронхиол специфичный тип клеток, и эти клетки были названы «клетками Клара» (КК), они также известны как CCs-клетки или бронхиолярные экзокринные клетки [1]. КК развиваются из прехордальной пластинки, и их относят к бронхоальвеолярным стволовым клеткам, они служат источником популяции реснитчатых клеток [2].
По данным Boers J.E. и соавт. (1999) [3], число КК в терминальных и респираторных бронхиолах легких человека составляет 11% и 22% соответственно. КК фактически отсутствуют в проксимальных воздушных путях. В дистальных дыхательных путях индекс пролиферации КК составляет 15% в терминальных бронхиолах и 44% в респираторных бронхиолах.
КК являются полифункциональными клетками. Их функции заключаются в секреции компонентов сурфактанта: гликопротеинов, липопротеинов, ферментов, принимающих участие в инактивации токсинов, которые поступают с воздухом, а также белка клеток Клара (CC16) [4]. Данный белок имеет защитное значение, он ингибирует фосфолипазу А2, участвует в регуляции деятельности лимфоцитов, снижает активность хемотаксиса фибробластов, и таким образом снижает вероятность развитие фиброза, играет важную роль в секвестрации и клиренсе вредных веществ, которые депонируются в респираторном тракте [5].
Количество и морфологические параметры КК в терминальных бронхиолах резко снижается у шахтеров, курильщиков [6; 7], при бактериальной пневмонии [8], у глубоко недоношенных детей [9].
В настоящее время активно изучается морфология внутренних органов при воздействии гипотермии [10-12], и в частности легких [13-15], в то же время морфология КК терминальных бронхиол при воздействии холодового фактора изучена недостаточно.
Целью исследования являлось исследование динамики морфологических изменений клеток Клара терминальных бронхиол легких крыс Вистар при воздействии однократной глубокой иммерсионной гипотермии и в постгипотермическом периоде.
Материалы и методы исследования
Исследование проведено на самцах крыс линии Вистар, массой 200-240 г (n = 25). Животных (n = 20) подвергали однократной глубокой иммерсионной (водной) гипотермии. Гипотермию моделировали следующим образом: животных, которые находились в индивидуальных клетках, помещали в воду температурой 5 °С при температуре окружающей среды 7 °С. Воздействие холодового фактора прекращали, когда животные достигали глубокую степень гипотермии, критерием которой служила ректальная температура 20-25 °С. Время воздействия холодового фактора в среднем составляло 40±5 мин. Непосредственно сразу после прекращения охлаждения, через 2, 7 и 14 дней животных выводили из эксперимента декапитацией, в каждой группе было по 5 крыс. Такие сроки забора материала были избраны с учетом данных литературы. Контрольную группу составляли 5 крыс, которых в индивидуальных клетках помещали в воду температурой 30 °С, при температуре окружающей среды 22–25 °С.
До проведения эксперимента на протяжении недели в целях адаптации к условиям вивария все крысы находились в стандартных условиях содержания. Использование животных в экспериментах осуществляли в соответствии с Европейской конвенцией по охране позвоночных животных, используемых в эксперименте, и директивами – 86/609/ЕЕС. Обезболивание и умерщвление животных проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
Для гистологического исследования кусочки ткани легких в течение 24 часов фиксировали в 10%-ном растворе нейтрального формалина, после чего проводили обработку препаратов в автомате TISSUE-TEK VIPTM6 (Sakkura, Китай) с последующей заливкой в парафин в станции парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Китай). На роторном микротоме Accu-Cut SRM (Sakkura, Китай) изготавливали срезы толщиной 5-7 мкм. В автостейнере TISSUE-TEK Prisma (Sakkura, Китай) препараты окрашивали гематоксилином и эозином.
Препараты исследовали при помощи микроскопа Leica DM 750 E200 (Германия) и фотографировали цифровой видеокамерой Leica EC3 (Германия) при увеличении х 1000. Морфометрические измерения КК проводили с помощью морфометрической программы «ВидеоТест-Морфология 5.2». Измеряли высоту, ширину, площадь цитоплазмы и площадь ядра КК. В каждой группе исследования изучали не менее 25-30 клеток.
Статистическая обработка полученных данных проводилась с помощью пакета статистических программ Statistica 10.0. и пакета статистического анализа программы MS Exсel 2010. Для каждой из величин высчитывали среднее (M) и ошибку среднего (m). Гипотеза о нормальности распределения вероятности данных проверялась с помощью критерия Шапиро-Уилка. Достоверность данных оценивалась с помощью параметрического критерия t-теста Стьюдента. Критическое значение уровня статистической значимости было равным 0,05.
Результаты исследования и их обсуждение
Контроль. Результаты проведенного исследования показали, что в контрольной группе исследования в стенках терминальных бронхиол реснитчатые клетки располагались непосредственно на базальной мембране в виде одного ряда. КК имели характерное морфологическое строение, на основании чего их можно было идентифицировать. Они располагались над реснитчатыми клетками, имели вытянутую форму и длинные куполообразные выросты в апикальных отделах цитоплазмы, в которых были видны светлые вакуоли различного размера (рис. 1). Площадь КК составила 43,9±1,5 мкм2, высота – 14,9±0,6 мкм, ширина – 4,7±0,1 мкм, площадь ядра – 10,8±0,8 мкм2 (табл.).
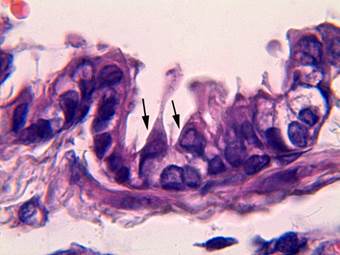
Рис. 1. Терминальная бронхиола легкого крысы контрольной группы исследования: слизистая оболочка представлена реснитчатыми клетками и КК (показаны стрелками), которые имеют длинные апикальные выросты. Окраска гематоксилином-эозином. Ув. × 1000
Морфометрическая характеристика КК терминальных бронхиол легких крыс в зависимости от сроков проведения глубокой иммерсионной однократной гипотермии
|
Параметры КК |
Контроль (1) |
Сразу после гипотермии (2) |
На 2-е сутки (3) |
На 7-е сутки (4) |
На 14-е сутки (5) |
|
Площадь цитоплазмы КК (мкм2) |
43,9±1,5 |
26,9±2,2 |
30±1,6 |
35,2±2,6 |
38,2±1,8 |
|
Площадь ядра КК (мкм2) |
10,8±0,8 |
4,3±0,2 |
10,5±0,5 |
10,7±0,6 |
11,7±0,6 |
|
Высота КК (мкм) |
14,9±0,6 |
4,8±0,2 |
7,9±0,5 |
13,2±1,1 |
15,0±0,4 |
|
Ширина КК (мкм) |
4,7±0,1 |
7,5±0,4 |
5,0±0,2 |
4,3±0,2 |
4,8±0,1 |
Примечание: для площади цитоплазмы КК P1-2, P2-3, P3-4 < 0,01. Для площади ядра КК P1-2, P2-3, < 0,001. Для высоты КК P1-2, P2-3, P3-4 < 0,001, P4-5 < 0,04. Для ширины КК P1-2, P2-3, P3-4 < 0,01.
Сразу после гипотермии. Сразу после воздействия гипотермии толщина слизистой оболочки терминальной бронхиолы резко уменьшалась. Реснитчатые клетки и КК приобретали уплощенный вид, округлую форму, апикальные выросты цитоплазмы КК пропадали (рис. 2). Морфометрические параметры КК по сравнению с контролем значительно изменялись: площадь цитоплазмы уменьшалась в 1,6 раза; высота уменьшалась в 3,1 раза; площадь ядра была меньше в 2,5 раза, а ширина возрастала в 1,6 раза (табл.).
Через 2 дня. На 2-е сутки постгипотермического периода наблюдали утолщение слизистой оболочки терминальной бронхиолы. В КК отмечали процессы гиперплазии, были видны единичные митозы. Параметры КК при этом возрастали: высота клеток возрастала в 1,6 раза; площадь ядра увеличивалась в 2,4 раза, и площадь цитоплазмы была больше на 10%. Ширина клеток при этом уменьшалась в 1,5 раза (рис. 3) (табл.).
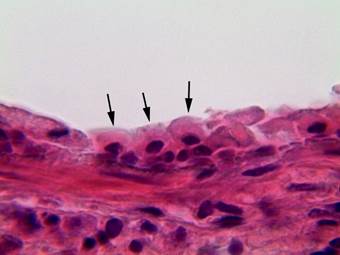
Рис. 2. Терминальная бронхиола легкого крысы сразу после проведения гипотермии: толщина слизистой оболочки уменьшена, КК атрофичны, имеют округлую форму (показаны стрелками), апикальные выросты цитоплазмы отсутствуют. Окраска гематоксилином-эозином. Ув. × 1000
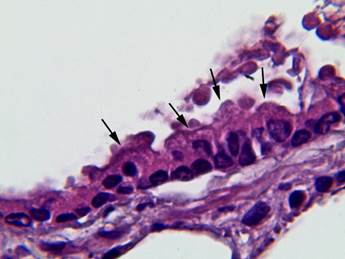
Рис. 3. Терминальная бронхиола легкого крысы на 2-е сутки эксперимента: толщина слизистой оболочки увеличивается, площади цитоплазмы и ядра КК увеличены в размерах (показаны стрелками). Окраска гематоксилином-эозином. Ув. × 1000
Через 7 дней. На 7-е сутки эксперимента отмечали дальнейшее утолщение слизистой оболочки. КК начинали вытягиваться и образовывать длинные апикальные выросты цитоплазмы, богатые различного размера светлыми вакуолями (рис. 4). При этом высота КК увеличивалась в 1,7 раза; площадь цитоплазмы возрастала на 14,8%. Ширина клеток уменьшалась на 14% (табл.).
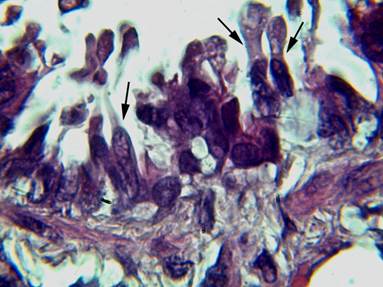
Рис. 4. Терминальная бронхиола легкого крысы на 7-е сутки эксперимента: толщина слизистой оболочки продолжает увеличиваться, КК начинают вытягиваться и образовывать апикальные выросты (показаны стрелками). Окраска гематоксилином-эозином. Ув. × 1000
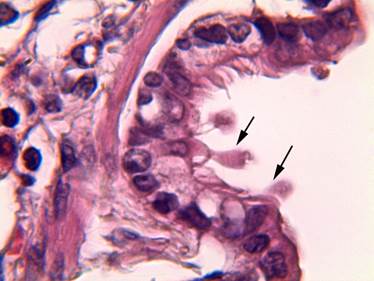
Рис. 5. Терминальная бронхиола легкого крысы на 14-е сутки эксперимента: строение слизистой оболочки терминальных бронхиол сопоставимо с контрольной группой. КК образуют апикальные куполообразные верхушки (показаны стрелками). Окраска гематоксилином-эозином. Ув. × 1000
Через 14 дней. На 14-е сутки эксперимента морфологическое строение слизистой оболочки терминальных бронхиол было сопоставимо с контрольной группой исследования. КК имели вытянутую форму, с длинными куполообразными верхушки на апикальном крае (рис. 5). В таких куполообразных образованиях цитоплазмы КК были видны преимущественно крупные вакуоли. Площадь цитоплазмы и площадь ядра КК составили 38,2±1,8 и 11,7±0,6 мкм2 соответственно. Высота и ширина клеток КК составили 15,0±0,4 и 4,8±0,1 мкм (табл.).
Таким образом, полученные данные свидетельствуют о том, что однократная глубокая иммерсионная гипотермия оказывает значительное неблагоприятное влияние на морфологическое строение КК терминальных бронхиол дистальных отделов легких крыс. Непосредственно сразу после воздействия гипотермии морфометрические параметры КК резко снижались. На 2-й день постгипотермического периода морфометрические показатели клеток начинали возрастать и достигали максимума к 7-му дню эксперимента. Данные изменения можно объяснить компенсаторно-приспособительными процессами и явлениями краткосрочной адаптации легких на воздействие неблагоприятного экзогенного фактора и повышением функциональной активности КК. Через 14 дней отмечали возвращение морфологических параметров КК к норме.
Таким образом, воздействие непродолжительной острой однократной глубокой иммерсионной гипотермии в итоге приводит к повышению функциональной активности, пролиферации и адаптивной перестройке КК терминальных бронхиол.
Выводы
1. Однократная глубокая иммерсионная гипотермия оказывает значительное неблагоприятное воздействие на КК терминальных бронхиол. Непосредственно после воздействия гипотермии происходит резкое снижение морфометрических параметров КК.
2. В постгипотермическом периоде функциональная активность и морфометрические параметры КК возрастают, что обусловлено компенсаторно-приспособительными адаптивными процессами, направленными на восстановление поврежденной слизистой оболочки терминальных бронхиол после воздействии холодового фактора.
Библиографическая ссылка
Бобров И.П., Лепилов А.В., Гулдаева З.Н., Долгатов А.Ю., Крючкова Н.Г., Шепелева Н.В., Орлова О.В., Кирей Е.Д., Лушникова Е.Л., Бакарев М.А., Молодых О.П. МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА КЛЕТОК КЛАРА ТЕРМИНАЛЬНЫХ БРОНХИОЛ КРЫС ВИСТАР ПРИ ГЛУБОКОЙ ОДНОКРАТНОЙ ИММЕРСИОННОЙ ГИПОТЕРМИИ // Современные проблемы науки и образования. – 2020. – № 2. ;URL: https://science-education.ru/ru/article/view?id=29655 (дата обращения: 18.04.2024).



