Несмотря на все современные технические возможности в нейрохирургической практике и лучевой диагностике, существуют сложности в дифференцировке образований головного мозга со схожими сигнальными характеристиками [1]. Также зачастую сложно достоверно визуально оценить границы распространения опухоли на дооперационном этапе, чтобы спланировать объем резекции, и в дальнейшем улучшить отдаленные результаты лечения, уменьшить риски рецидива.
Перспективным подходом в визуализации опухолевой инфильтрации является методика диффузионно-взвешенной магниторезонансной томографии (ДВ МРТ) [2]. Данная методика может дифференцировать области быстрого и замедленного движения протонов. Области, где протоны свободно и быстро двигаются, имеют более высокое значение измеряемого коэффициента диффузии (ИКД) [2]. В клиническом применении интересны зоны структурных изменений, в которых диффузия уменьшена по отношению к окружающей области, что может быть связано с пролиферацией клеток и их высокой плотностью, характерной для неопластического процесса [3-5]. Вычисление ИКД в ряде случаев позволяет определить характер опухоли, зоны ее активного роста, границы со здоровой мозговой тканью и областью перитуморального отека. Так, зоны опухолевого узла с высокой пролиферативной активностью отличаются высокой клеточной плотностью при морфологическом обследовании и соответственно ограничением диффузии, что объясняется малым количеством ядерного компонента клетки и большим количеством цитоплазмы. Это является фактором прогноза появления пролиферирующих сосудов и опухолевой прогрессии [6; 7]. Степень злокачественности опухолевой ткани определяется иммуногистохимическим исследованием на основании индекса пролиферативной активности Ki-67, и эти данные имеют большое значение в прогнозе и тактике ведения таких больных [8; 9]. Значения индекса пролиферативной активности Ki-67 менее 5% характерны для доброкачественных опухолей. Значения выше 5%, как правило, сопровождаются наличием анаплазии клеток. Сопоставление полученных ИКД опухолевой ткани со степенью их злокачественности, клеточной плотностью и индексом пролиферативной активности является актуальным и перспективным направлением нейрорадиологии [10; 11]. Комплексная оценка опухолей центральной нервной системы позволит врачу-рентгенологу предположить характер образования, а врачу-нейрохирургу выбрать рациональную тактику ведения пациента, не дожидаясь заключения патоморфолога. Также изменения на ИКД после химио- и лучевой терапии смогут служить предикторами ответа на лечение.
Цель исследования: изучение возможностей методики ДВ МРТ с построением ИКД-карт в диагностике опухолей головного мозга для определения их пролиферативного потенциала и степени злокачественности.
Материалы и методы исследования
В исследование включены данные 76 пациентов, которым проводилось оперативное лечение в центре нейрохирургии на базе ЧУЗ «КБ "РЖД-Медицина" г. Иркутск».
В диагностическом комплексе на дооперационном этапе всем пациентам проводили МРТ головного мозга. Стандартные Т1, Т2 взвешенные изображения в трех проекциях и ДВИ в аксиальной проекции выполнены на 1.5 Т томографе Siemens Magnetom Essenza (Германия) при b-факторе 800 с/мм2 с последующим аппаратным построением ИКД-карт, на которых вычислялись значения ИКД в опухоли с использованием инструмента ROI. В зону измерения не входили кисты и некрозы в структуре опухоли. ИКД рассчитывали в приложении RadiAnt DICOM Viewer.
Гистологическое и иммуногистохимическое исследование проводилось в послеоперационном периоде опытным патоморфологом. Клеточную плотность в опухоли считали в виде клеток/мм3 в приложении Image J на увеличении микроскопа х 400. Для измерения индекса пролиферативной активности (Ki-67) использовались моноклональные антитела MIB-1 (Dako Cytomation, Дания).
Ретроспективно пациенты были подразделены на подгруппы согласно гистологическим характеристикам опухолей по критериям классификации ВОЗ от 2016 года. В исследование включены безрецидивные случаи опухолей головного мозга – глиомы (39 пациентов), менингиомы (37 пациентов). Глиомы подразделены на соответствующие степени градации: GI - в структуре опухоли нет ядерного атипизма, митозов, пролиферации эндотелия сосудов, некрозов; GII - наличие атипии ядер или единичных митозов; GIII наличие большого количества митотических фигур; GIV - выраженная пролиферация эндотелия сосудов, наличие некрозов. Менингиомы подразделялись по степеням градации: GI – доброкачественные, с равномерным расположением клеток и умеренным полиморфизмом ядер, без наличия очагов некроза и митотической активности; GII – атипичные, с определяющимися очагами некроза и фигурами митоза, с полиморфизмом клеток и ядер; GIII – анапластические, с плотным расположением клеток, множественными фигурами митозов и очагов некроза.
Сформированы две группы для каждой опухоли (низкий ИКД и высокий ИКД) с проверкой их однородности по ряду критериев (локализация, степень резекции, возраст).
Анализ полученных значений оценивали c помощью программного обеспечения Microsoft Excel 2010 с использованием методов описательной статистики (абсолютных и относительных величин). Корреляция значений ИКД, клеточной плотности, Ki-67 оценивалась с порогом значимости коэффициента Спирмена р = 0,05.
Результаты
Для глиом низкой степени злокачественности средние значения ИКД составили 1260 мм2/с. Глиомы высокой степени злокачественности отличались низкими средними значениями ИКД - 864 мм2/с.
Сравнение средних значений индекса пролиферативной активности Ki-67 между глиомами низкой и высокой степени злокачественности показало наличие статистически значимых различий. У глиом низкой степени злокачественности Ki-67 варьировал от 2 до 12% (среднее значение 5%), у глиом высокой степени злокачественности – от 12 до 97% (среднее значение 58%).
Для доброкачественных менингиом были характерны высокие показатели ИКД (сред. 1375 мм2/с). Атипичные менингиомы показали промежуточные значения ИКД (сред. 1113 мм2/с). Анапластические менингиомы характеризовались низкими показатели ИКД (сред. 689 мм2/с). Анализ данных значений ИКД не показал существенной разницы в интенсивности сигнала в структуре доброкачественных и анапластических менингиом. Тогда как интенсивность сигнала на ИКД-картах доброкачественных менингиом существенно отличалась от таковой у анапластических менингиом.
Значения индекса пролиферативной активности Ki-67 у менингеальных опухолей составили от 1 до 17% (средн. 4%). Анализ данных показал статистически значимые различия между всеми группами менингеальных опухолей.
Нами были получены данные об обратной корреляции ИКД со значениями индекса пролиферативной активности Ki-67 как у глиальных опухолей, так и у менингиом (рис. 1).
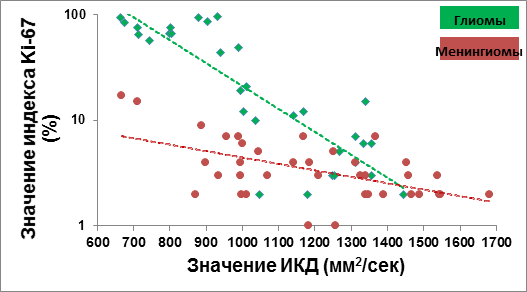
Рис. 1. Корреляция ИКД и Ki-67 у глиальных и менингеальных опухолей различной степени злокачественности
Подсчет клеточной плотности в глиальных опухолях показал вариабельные значения без признаков достоверных различий (низкая степень злокачественности от 594 до 1785 клеток/мм3, высокая степень злокачественности – от 657 до 1783 кл./мм3).
Плотность клеток в опухолевой ткани менингиом (от 457 до 1785 кл./мм3) также варьировала для каждой группы в широких пределах и не показала достоверной корреляции со степенью их злокачественности.
Полученные данные ИКД и клеточной плотности у глиальных и менингеальных опухолей представлены на рисунке 2.
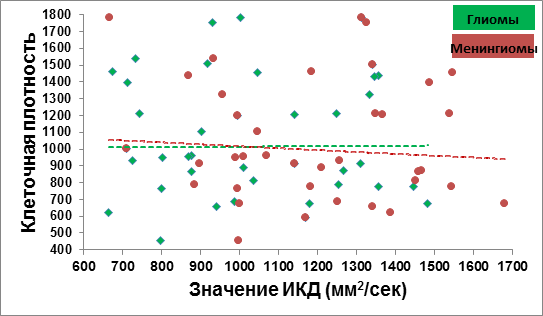
Рис. 2. ИКД и клеточная плотность у глиальных и менингеальных опухолей
По результатам проведенного исследования ИКД у глиом высокой степени злокачественности достоверно ниже, чем у глиом низкой степени злокачественности. Таким образом, значения ИКД и индекса пролиферативной активности Ki-67 нейроэпителиальных опухолей имеют корреляционную зависимость статистически достоверно. Это свидетельствует о том, что ИКД отражает патоморфологическую картину глиальной опухоли.
Полученные данные согласуются с публикациями других авторов. Так, в работе Chen и соавт. показаны результаты разных значений ИКД для глиом низкой и высокой степени злокачественности с признаками обратной зависимости [3]. Эти данные согласуются с исследованием Hu и соавт. [4]. В исследовании Серкова и соавт. [7] средние значения ИКД для астроцитом низкой степени злокачественности составляют 1520 мм2/c, что авторы связывают с низкой клеточной плотностью. Средние значения ИКД для анапластических астроцитом составляют 1180-1230 мм2/с [7]. Однако в этих исследованиях отмечается зависимость значений ИКД от клеточной плотности, что не подтверждается результатами наших данных. В нашем исследовании глиомы высокой степени злокачественности обладали значениями ИКД менее 1340 мм2/с. Консолидация известных ранее и полученных нами данных позволяет предположить, что низкие значения ИКД характерны для глиом злокачественной природы с высоким пролиферативным потенциалом.
Наше исследование продемонстрировало, что значения ИКД и индекс пролиферативной активности Ki-67 менингиом имеют статистически значимую обратную корреляционную зависимость, соответственно, можно сделать вывод, что ИКД отражает патоморфологическую картину менингеальной опухоли.
Полученные данные согласуются с результатами других исследователей, где также показана корреляция значений ИКД и пролиферативного потенциала менингиом [10-13]. В исследовании Tang с соавт. [11], как пороговое значение ИКД в дифференциальной диагностике менингиом GI и GII от GIII, получили число равное 850 мм2/с. В нашем исследовании анапластические менингиомы обладали значениями ИКД менее 711 мм2/с. Соответственно этот диапазон значений позволяет предположить анапластическую природу менингиомы. Но не все исследователи получают похожие данные, в некоторых публикациях достоверных различий между ИКД менингиом различных типов отмечено не было [14].
Разница в полученных данных может быть объяснена отличающимися методиками проводимых исследований. Несмотря на некоторые различия в полученных данных, результаты нашего исследования во многом согласуются с другими авторами. Данное исследование, учитывая ретроспективный анализ данных и низкую репрезентативность выборки, не лишено недостатков и требует проведения исследований на большем количестве пациентов, с комплексным анализом данных для опухолей головного мозга всех гистологических типов.
Заключение
Проведенное исследование наглядно показало, что интенсивность сигнала на ИКД-картах и показатели пролиферативного потенциала опухоли (Ki-67) как для нейроэпителиальных опухолей низкой и высокой степени злокачественности, так и для менингеальных опухолей имеют достоверные различия. Опухоль с высоким пролиферативным потенциалом характеризуется низкой интенсивностью сигнала на ИКД-карте, опухоль с низкой пролиферацией - высоким сигналом на ИКД-карте.
Соответственно, использование МРТ с ДВИ и построением ИКД-карт в комплексной диагностике опухолей головного мозга позволяет на диагностическом этапе спрогнозировать характер выявленного образования, предположить степень его злокачественности, пролиферативный потенциал, а также предположить возможность рецидива опухоли. Заблаговременное использование всех возможностей современной нейроонкологии позволяет достигнуть максимально возможной степени резекции опухоли и, как следствие, добиться увеличения длительности безрецидивного периода, увеличить общую выживаемость у данной группы пациентов.
Библиографическая ссылка
Бывальцев В.А., Дергилев А.П., Кичигин А.И., Каныгин В.В. ДИФФУЗИОННО-ВЗВЕШЕННАЯ МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ В ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА // Современные проблемы науки и образования. – 2020. – № 3. ;URL: https://science-education.ru/ru/article/view?id=29867 (дата обращения: 18.04.2024).



