За последнее десятилетие в России отмечен значительный рост уровня заболеваемости колоректальным раком (КРР) и раком предстательной железы (РПЖ). Обе нозологии вносят существенный вклад в структуру онкологической заболеваемости в Российской Федерации у мужчин разных возрастных групп [1, 2].
Основными лечебными подходами при КРР и РПЖ являются хирургические методы и лучевая терапия (ЛТ) в интеграции с химиотерапией [3]. Биологический эффект от ЛТ в большой степени зависит от исходной радиорезистентности клеток опухоли, которая связана с их особыми генетическими характеристиками [2], к которым относится и показатель копийности генов (Copy Number Variation (CNV)). CNV является особым типом генетических полиморфизмов, приводящих к изменению количества копий определенного гена и, следовательно, к изменению уровня экспрессии продукта этого гена – протеина или некодирующей РНК [4, 5]. Использование изменения показателя копийности в качестве молекулярного маркера радиорезистентности опухолевых клеток может быть перспективным направлением, которое позволит корректировать стратегию терапии [5]. Молекулярные механизмы устойчивости к ЛТ исследуются достаточно давно. Показано, что одним из них может быть гиперактивация репарации ДНК в опухолевых клетках. Известно, что баланс между повреждением и репарацией ДНК определяет выживаемость клеток после воздействия излучения. При этом не менее важным фактором, влияющим на радиорезистентность, является гипоксия, так как кислород необходим в реакции ЛТ-индуцированного образования АФК (активных форм кислорода) [5].
Метаанализ данных, полученных с 2000 по 2020 гг., опыт проведения ЛТ у больных РПЖ и КРР, а также данные по резистентности к ЛТ, ассоциированной с изменением копийности генов, позволили сформировать перечень потенциальных кандидатов на молекулярные маркеры устойчивости/чувствительности к ЛТ. Перечень включил в себя 32 генетических локуса (XRCC4, BRCA1, BRCA2, EXO1, H2AX, KU70, RAD50, RAP80, CDK1, CDKN1B, CCND1, CCND3, FGFR2, HIST1, PTEN, AKT, RIF1, RNF168, ATM, BRIP, TP53, TOP-B1, BAX, CASP-8, CASP-3, CASP-9, MDM2, BCL-2, LIG4, RBBP8, EP-300, CFLIP), ответственных за регуляцию клеточного цикла, апоптоза и репарацию ДНК.
Целью исследования стала валидация перечня потенциальных предикторов радиорезистентности опухолевых клеток предстательной железы и толстой кишки в условиях модельного эксперимента на основании определения вариаций количества копий генов.
Материалы и методы исследования
В модельном эксперименте использовались две клеточные линии – HT-29 (клетки аденокарциномы толстой кишки) и PC-3 (опухолевые клетки предстательной железы). Культивирование опухолевых клеток проходило в стерильных плоскодонных флаконах в питательной среде RPMI-1640 c добавлением 10% фетальной телячьей сыворотки и 50 мкг/мл гентамицина. Условия культивирования клеток были следующими: 5% CO2, 95% влажность и температура 370C [6].
Облучение опухолевых клеток проводилось на линейном ускорителе Novalis TX (Varian, США) в следующем режиме: разовая очаговая доза (РОД) 7 Гр последовательно 5 раз с интервалом в 24 ч (до СОД=35 Гр или изо-СОД=49 Гр). Количество клеток и соотношение живые/мертвые клетки определялось в камере Горяева с использованием 0,4%-ного раствора трипанового синего. После пятого дня облучения клетки PC-3 и HT-29 снимались с подложки раствором трипсина (Версена) [5]. Из суспензии клеток фенол-хлороформным методом проводилась экстракция ДНК по протоколу, описанному Д.С. Кутилиным и соавторами [4]. Для оценки уровня относительной копийности генов методом количественной ПЦР в режиме реального времени (Real-Time qPCR) использовались последовательности 32 пар синтетических олигонуклеотидов (XRCC4, BRCA1, BRCA2, EXO1, H2AX, KU70, RAD50, RAP80, CDK1, CDKN1B, CCND1, CCND3, FGFR2, HIST1, PTEN, AKT, RIF1, RNF168, ATM, BRIP, TP53, TOP-B1, BAX, CASP-8, CASP-3, CASP-9, MDM2, BCL-2, LIG4, RBBP8, EP-300, CFLIP) и 3 пар синтетических олигонуклеотидов для референсных генов (ACTB, B2M, GAPDH), разработанные Д.С. Кутилиным и соавторами [5] (табл. 1).
Таблица 1
Последовательности олигонуклеотидов для анализа копийности генов [5]
|
Праймер |
Олигонуклеотидная последовательность |
Праймер |
Олигонуклеотидная последовательность |
|
|
1 |
AKT1(F) |
ATGGACAGGGAGAGCAAACGC |
AKT1(R) |
CTGATGCACCAGCTGACAGG |
|
2 |
ATM(F) |
GCAAAACCAAATGTATCAGCCTCAT |
ATM(R) |
GGACCAAACTACTGATTTCCTGCAT |
|
3 |
BRIP1(F) |
GAAGAACTTGTCAGCCTGGGGC |
BRIP1(R) |
GTCTTGTATTAGTTCTCGGGCTGTG |
|
4 |
BRCA1(F) |
GTAGCCCCTTGGTTTCCGTGT |
BRCA1(R) |
CCCCTTTCCCGGGACTCTACT |
|
5 |
BRCA2(F) |
TGCATCCCTGTGTAAGTGCATA |
BRCA2(R) |
CACGTACTGGGTTTTTAGCAAGC |
|
6 |
CDK1(F) |
CAGGGGATTGTGTTTTGTCACTC |
CDK1(R) |
TACCACTATTCCACTTGCCTCAT |
|
7 |
CDKN1B(F) |
TCGGGGTCTGTGTCTTTTGGT |
CDKN1B(R) |
ACTCCCGTTAGACACTCGCAC |
|
8 |
CCND1(F) |
GGTGAACAAGCTCAAGTGGAACC |
CCND1(R) |
ACCGGCCAGGGTCACCTAA |
|
9 |
CCND3(F) |
TTCCACGGTTGCTACATCGTG |
CCND3(R) |
TACACAGCAGCTCCATACTCG |
|
10 |
EXO1(F) |
GTTACCCGTGTTCTGCGTTGC |
EXO1(R) |
CGAACCCACCCATTAGCCTCC |
|
11 |
FGFR2(F) |
CAAGGACCACTCTTCTGCGTA |
FGFR2(R) |
GCTTGAATGGCAACGCTCCTC |
|
12 |
HIST1H2(F) |
CGTGCTACTGCCCAAGAAGAC |
HIST1H2(R) |
GAGCCTTTGGTTCCTTTGGGAT |
|
13 |
H2AX(F) |
AGGCCTCCCAGGAGTACTAAT |
H2AX(R) |
ACTGAAGCGGCTCAGCTCTTT |
|
14 |
KU70(F) |
AAGATCATAAGCAGTGATCGAGAT |
KU70(R) |
GTCCAGCTCCTGTAAGACGTA |
|
15 |
PTEN (F) |
GTCCAGAGCCATTTCCATCCTG |
PTEN (R) |
CTGTCATGTCTGGGAGCCTGT |
|
16 |
RAD50 (F) |
TGGCTGGCAGGATCTTTTGGG |
RAD50 (R) |
AGCTTAACTGAGGCCGAAGCA |
|
17 |
RAP80(F) |
CAGATGTACTGGCCACTCGGC |
RAP80(R) |
ACAGTGCCTAGATGTGTCCCC |
|
18 |
RB1(F) |
TCCGGTTTTTCTCAGGGGACA |
RB1(R) |
TCAGCGAGCTGTGGAGGAG |
|
19 |
Rif1(F) |
GGCTGTTTCCATCGGTCACTA |
Rif1(R) |
CTCCAAAGTCTCCAACAGCGG |
|
20 |
RNF168(F) |
TGAGGGGAGGAGAGGACTTGA |
RNF168(R) |
TAGGCAAACAGGAATACCCCG |
|
21 |
TGFB1 (F) |
TTGAGACTTTTCCGTTGCCGT |
TGFB1(R) |
TGAGGGCTGGTCCGGAATG |
|
22 |
TopBP1 (F) |
TGGGCGGACGAGTATACAGAC |
TopBP1 (R) |
AAGGTTTCTTCAGGTTTGCAGC |
|
23 |
TP53 (F) |
GGTCGGTGGGTTGGTAGTTTG |
TP53 (R) |
AGTGTGGGATGGGGTGAGATT |
|
24 |
XRCC4 (F) |
CAGACTTGGTTCCTTCAACCTC |
XRCC4 (R) |
CTCTGCAGGTGCTCATTTTTGG |
|
25 |
BAX(F) |
GCCTCCTCTCCTACTTTGGGG |
BAX(R) |
GAAACACAGTCCAAGGCAGC |
|
26 |
CASP8(F) |
TCTTTATGATATTGGGGAACAACTGC |
CASP8(R) |
CGTTCTTGCTTCCTTTGCGGA |
|
27 |
CASP3(F) |
ATGCAGCAAACCTCAGGGAT |
CASP3(R) |
CTTCACCATGGCTCAGAAGCA |
|
28 |
CASP9(F) |
CTCCACTTCCCCTGAAGACGG |
CASP9(R) |
GCTGGGTGTGGGCAAACTAGA |
|
29 |
MDM2(F) |
TCTTTGGGACCCATCTACCCTC |
MDM2(R) |
AAGAATGCTTTAGTCCACCTAACCTT |
|
30 |
BCL2(F) |
GAGTGGGATGCGGGAGATGC |
BCL2(R) |
TGGTGAAGGGCGTCAGGTG |
|
31 |
RBBP8 (F) |
ACCGAGGATTTGGCACTCTGA |
RBBP8 (R) |
ATCCGAGATTGCCTCGGGATT |
|
32 |
EP300(F) |
TCGGCGAATTTGTGCTCTTGT |
EP300(R) |
GCCTTTTTCTCTTCGCCGGGT |
|
33 |
LIG4 (F) |
GGGTAAAGGATCACGGGGTGT |
LIG4 (R) |
TCCAGACCCAACACGAGAGAG |
|
34 |
C-FLIP(F) |
GGCTCCCAGAGTGTGTATGGT |
C-FLIP(R) |
AGGCCCTCTGACACCACATAG |
|
35 |
GAPDH(F) |
GCTGAACGGGAAGCTCACTT |
GAPDH(R) |
CGCAGGTTTTTCTAGACGGCAG |
|
36 |
ACTB(F) |
CACCCTGAAGTACCCCATCGC |
ACTB(R) |
GTGTAGAAGGTGTGGTGCCAG |
|
37 |
B2M(F) |
TGAGTGCTGTCTCCATGTTTGAC |
B2M(R) |
TATTCTCTGCTCCCCACCTCT |
Примечание: (F) – прямой праймер, (R) – обратный праймер
RT-PCR проводилась с использованием термоциклера CFX96 (Bio-Rad, США) и реакционной смеси, содержащей 1х PCR-буфер, смесь 0,2 мМ dNTP, 1,5 мМ MgCl2, по 450 нМ праймеров, 0,1 ед.ак./мкл Taq-полимераза и 10 нг ДНК-матрицы. В качестве интеркалирующего красителя использовался EvaGreen Dye. Относительная копийность (RQ) рассчитывалась по формуле 2-ΔCt. Конечные результаты представлялись как соотношение копийности генов в облученных образцах по отношению к контрольным для каждого гена: сRQоб/сRQк, где сRQоб – среднее RQоблученных клеток , а сRQк – среднее RQинтактных клеток (контроль), а. Статистическая обработка данных осуществлялась с использованием One-Way ANOVA.
Результаты исследования и их обсуждение
После пятидневного эксперимента по облучению опухолевых клеток предстательной железы на линейном ускорителе Novalis TX в дозе 7 Гр 15% от изначального количества клеток сохранило жизнеспособность. В этих клетках статистически значимо (р<0,05–0,005) было больше копий генов CDK-1 – в 1,8 раза, CDKN-1B – в 2,6 раза, PTEN – в 1,7 раза, XRCC-4 – в 1,7 раза, EP-300 – в 2,0 раза и RBBP-8 – в 1,7 раза относительно интактных клеток, при этом статистически значимо (р<0,05) количество копий генов CCND-3, TP53 и BCL-2 было ниже в 2,6 раза, 1,8 раза и 2,4 раза соответственно относительно клеток интактной группы (рис. 1). Можно отметить, что на выживаемость клеточных субпопуляций линии PC-3 в условиях облучения уровень копийности генов BRCA1/2, H2AX, RAD-50, RAP-80, AKT, ATM, BRIP, RIF-1, RNF-168, TOP-B1, CFLIP, CASP-8, CASP-3, CASP-9, MDM-2 и LIG-4 влияния не оказывал (копийность этих генов не отличалась в группах интактных клеток и клеток, подвергнутых облучению в дозе 7 Гр).
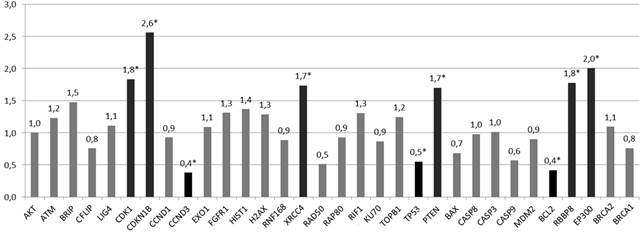
Рис. 1. Относительная копийность генов в радиорезистентных клетках PC-3
*– статистически значимые отличия относительно интактных клеток (р<0,05)
Так же, как и в случае с опухолевыми клетками предстательной железы после пяти дней облучения в дозе 7 Гр культуры клеток аденокарциномы толстой кишки только 20% от изначального количества клеток НТ-29, взятых в эксперимент, сохранило жизнеспособность. Повышенная устойчивость этого пула клеток относительно других клеток линии HT-29 может быть связана с аномальными показателями копийности некоторых генов в этих клетках. Это подтверждается полученными нами данными: у этих клеток статистически значимо (р<0,05) была повышена копийность генов BRCA2 – в 2,5 раза, H2AX – в 3,2 раза, CASP-9 и RBBP8 – в 1,6 раза и снижена копийность гена BCL-2 в 3,6 раза относительно клеток, не подвергнутых облучению (рис. 2).
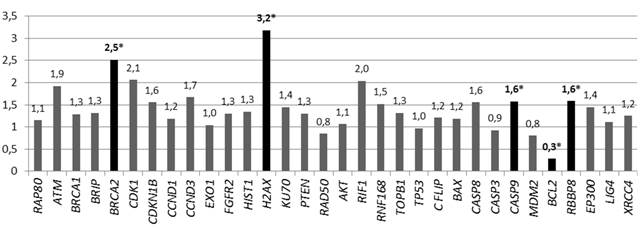
Рис. 2. Относительная копийность генов в радиорезистентных клетках НТ-29
*– статистически значимые отличия относительно интактных клеток (р<0,05)
Из представленных данных видно, что радиорезистентные клоны опухолевых клеток разных нозологий отличаются по молекулярному профилю. В случае PC-3 радиорезистентность ассоциируется с увеличением числа копий генов CDKN-1B, CDK-1, PTEN, XRCC4, EP-300 и RBBP-8 и с уменьшением числа копий генов TP53, CCND-3 и BCL-2, а в случае клеток НТ-29 – с повышенной копийностью генов RBBP-8, BRCA2, H2AX, CASP-9 и сниженной копийностью гена BCL-2. При этом для обеих клеточных линий повышенная копийность гена RBBP8 и сниженная копийность гена BCL2 ассоциировались с устойчивостью к лучевой терапии. Белок RBBP8 регулирует пролиферацию клеток, образуя молекулярные комплексы с ко-репрессором транскрипции CTBP, а также регулирует функционирование белка BRCA1 при репарации поврежденной ДНК [7]. Продукт гена BCL2 участвует в негативной регуляции апоптоза. BCL2 изменяет проницаемость митохондриальной мембраны и предотвращает выход из митоходрий цитохрома C, что в итоге ингибирует активность каспаз. А также BCL2 связывает белок APAF1 – фактор, активирующий апоптоз [8]. Соответственно, повышенная копийность RBBP8 и сниженная копийность BCL2 дают клеткам более эффективную систему репарации ДНК и регуляции апоптоза и являются общей основой устойчивости опухолевых клеток разных нозологий к лучевой терапии.
Интересно обнаруженное увеличение копийности двух генов – CDK1 и CDKN1B – в клетках PC-3. Циклинзависимая киназа 1 (CDK1) представляет собой высококонсервативный белок, который является ключевым в регуляции клеточного цикла [9]. При его связывании с циклином происходит прогрессирование клеточного цикла. Связывание с циклином изменяет доступ к активному центру CDK1, обеспечивая его активность; кроме того, циклины могут нацеливать CDK1 на определенные субклеточные локации [9]. Продукт гена CDKN1B (cyclin-dependent kinase inhibitor 1B) белок p27 является ингибитором циклинзависимой киназы 1, регулирует клеточный цикл, отвечая за его остановку в фазе G1. p27 подавляет активность комплексов циклин (A, E или D) / циклинзависимая киназа, при этом положительная или отрицательная регуляция активности зависит от статуса фосфорилирования соответствующего комплекса [10]. Следовательно, одновременно повышается копийность гена, запускающего клеточный цикл, и гена, его останавливающего. Биологический эффект этого явления и его роль в формировании радиорезистентности опухолевых клеток еще предстоит уточнить.
Еще одно парадоксальное молекулярное изменение касается повышенной копийности генетического локуса PTEN (phosphatase and tensin homolog deleted on chromosome 10), кодирующего фермент фосфатазу, субстратами которой могут быть белки и фосфатидилинозитол-3-фосфаты. Отщепление фосфатной группы от фосфатидилинозитол-3-фосфатов, катализируемое PTEN, лишает эти соединения функций вторичных мессенджеров в клеточных сигнальных каскадах. При этом PTEN является антионкобелком, негативно регулирующим сигнальный путь PI3K/AKT/mTOR [11]. Следовательно, выжившие после облучения опухолевые клетки предстательной железы исходя из полученных данных могут иметь повышенный уровень антионкобелка PTEN.
Еще два гена, копийность которых повышена в радиорезистентных клетках предстательной железы, – это XRCC4 и EP300. Белок, кодируемый геном XRCC4, участвует вместе с ДНК-лигазой IV и ДНК-зависимой протеинкиназой в восстановлении двухцепочечных разрывов ДНК (негомологичная рекомбинация) [12]. Гистонацетилтрансфераза р300 (р300 HAT) представляет собой фермент, который в организме человека кодируется геном EP300. Данный фермент регулирует транскрипцию генов посредством ремоделирования хроматина и играет важную роль в регуляции роста и деления клеток, заставляя клетки выполнять специализированные функции (дифференцироваться). EP300 также является ко-активатором HIF1A и играет роль в стимуляции индуцированных гипоксией генов, таких как VEGF. Мутации в гене EP300 были выявлены при некоторых типах рака. Соматические мутации в гене EP300 были обнаружены в небольшом количестве солидных опухолей, включая рак толстой и прямой кишки, желудка, молочной и предстательной железы. В опухолевых клетках мутации в EP300 не позволяют продуцировать функциональный белок, без этого клетки не могут эффективно сдерживать рост и деление [13]. Вероятно, повышенная копийность XRCC4, так же как и RBBP8, обеспечивает эффективную репарацию ДНК после облучения. Роль в радиорезистентности гена EP300 определить на данный момент трудно, возможно, его копийность просто отражает молекулярно-генетические особенности выживших клонов PC-3 и не связана с чувствительностью к облучению.
Важно отметить, что в радиорезистентных клетках НТ-29 также увеличено количество копий двух генов – H2AX и BRCA2, играющих ключевую роль в репарации ДНК. В ответ на повреждение ДНК (под воздействием ЛТ) гистоновый белок H2AX фосфорилируется и переходит в форму γH2AX. Эта модификация уменьшает степень конденсированности ДНК, что позволяет присоединиться ферментным комплексам, обеспечивающим восстановление двухцепочечных разрывов. Так, γH2AX, взаимодействуя с MDC1, формирует комплекс γH2AX/MDC1, с которым соединяются убиквитинлигазы (RNF8, RNF168), что приводит к особой модификации участков хроматина, позволяющей присоединиться к нему BRCA1. В свою очередь BRCA1 образует комплекс BRCA1-PALB2-BRCA2, который необходим для важного этапа гомологичной рекомбинации – транслокации белка RAD51 к двухцепочечному разрыву ДНК [14].
Заключение
Таким образом, после пятидневной лучевой терапии при разовой очаговой дозе, равной 7 Гр, жизнеспособность сохраняют только клетки линий PC-3 и НТ-29, которые обладают особыми молекулярно-генетическими характеристиками: повышенным количеством копий генов H2AX, XRCC4, RBBP-8, CDK-1, CDKN-1B, PTEN, EP-300 и пониженным количеством копий BAX, TP53, CCND-3, BCL2 (для PC-3) либо повышенным количеством копий генов RBBP8, BRCA2, H2AX, CASP-9 и пониженным количеством копий гена BCL-2 (для НТ-29). Эти изменения копийности генов в определенных субпопуляциях опухолевых клеток PC-3 и НТ-29 приводят к повышению эффективности функционирования ключевых сигнальных путей, регулирующих репарацию ДНК, апоптоз и клеточный цикл, что в условиях лучевой терапии, вероятно, обеспечивает им эволюционное превосходство над другими клонами и в конечном итоге – их выживание. Выявленные при модельном эксперименте изменения в копийности генов раскрывают молекулярно-генетические особенности формирования радиорезистентности опухолевых клеток разных нозологий и имеют большой потенциал в качестве молекулярных маркеров чувствительности этих опухолей к лучевой терапии, что позволяет рекомендовать их для тестирования (апробации) на биоматериале, полученном от пациентов.
Исследование выполнено в рамках гос. заданий «Поиск молекулярно-генетических предикторов радиорезистентного рака предстательной железы и разработка персонифицированных терапевтических подходов» и «Поиск предикторов радиорезистентности рака прямой кишки и разработка персонифицированных неоадъювантных терапевтических подходов».
Библиографическая ссылка
Гусарева М.А., Зинькович М.С., Кошелева Н.Г., Солнцева А.А., Карнаухова Е.А., Розенко Л.Я., Фатькина Н.Б., Потемкин Д.С., Омельчук Е.П., Удаленкова И.А. ПОКАЗАТЕЛЬ КОПИЙНОСТИ ГЕНОВ И УСТОЙЧИВОСТЬ ОПУХОЛЕВЫХ КЛЕТОК РАЗНЫХ НОЗОЛОГИЙ К ОБЛУЧЕНИЮ // Современные проблемы науки и образования. – 2020. – № 5. ;URL: https://science-education.ru/ru/article/view?id=30111 (дата обращения: 18.04.2024).



