Типичные процессы взросления выраженно влияют на состояние здоровья субъекта. Недостаточная активность иммунитета в юном возрасте обуславливает рост заболеваемости, при этом эффективность применения вакцин у молодых людей часто снижена, что способствует росту инфекционных процессов, даже независимо от все более совершенных мероприятий по иммунизации [1; 2].
Состояние лимфатических узлов (ЛУ), которые играют ключевую роль в защите организма от неблагоприятных факторов внешней среды, является маркером состояния иммунной системы. ЛУ детей и молодых животных содержат больше стромальных, бластных и находящихся в митозе клеточных элементов. Постепенно, по мере взросления, появление все более значительного содержания плазматических клеток в ЛУ свидетельствует об их возрастающей роли в системе защиты организма. Не исключено, что онтогенетические различия в состоянии иммунных и лимфоидных органов связаны с нарастающей в течение взросления антигенной стимуляцией [3-5].
В эксперименте сравнивали дренаж лимфы и изменения структуры паховых ЛУ крыс породы Вистар возрастом от 3 до 5 и от 12 до 15 месяцев. Было найдено, что в процессе взросления меняется расположение этих ЛУ. Вследствие формирования соединительной ткани становится медленнее ток лимфы через ЛУ. По мере увеличения возраста постепенно снижается численная плотность клеточных элементов в паракортексе, уменьшается митотическая активность в центрах размножения лимфоидных фолликулов [6].
В научной литературе практически нет сравнительных данных по исследованию ЛУ после повреждения тканей в регионе лимфосбора у разного возраста пациентов и экспериментальных животных [7]. В результате изучения литературы была выделена только 1 работа, описывающая реакции ЛУ на фоне травматических повреждений костей голеней и стоп у разных по возрасту пациентов. При этом в начале статьи G. Szczesny с соавт. [8] сообщают о выраженной реакции ЛУ на переломы, а затем делают заключение об отсутствии клинических проявлений таких изменений.
Цель исследования: определить особенности патогистологических изменений поднижнечелюстных ЛУ (ПЛУ) на травмирование тканей мандибулярного региона у молодых крыс.
Материал и методы исследования. Патогистологическими методами сравнивали изменения ПЛУ молодых и взрослых крыс-самцов инбредной линии Wag на моделирование мандибулярного перелома костной ткани нижней челюсти.
Крысы были выращены и содержались в соответствующем требованиям SPF виварии Федерального исследовательского центра «Институт цитологии и генетики» СО РАН. Хирургическое вмешательство и выведение животных из эксперимента были проведены в условиях чистой операционной под тотальной ингаляционной эфирной анестезией и, в соответствии с ГОСТ 33215-2014, не были связаны с причинением болевых ощущений.
Периодизация постнатальной жизни крыс сделана на основе рекомендаций В.В. Махинько и В.Н. Никитина [9]. Приняв, что крысы доживают до 3 лет, а человек – до 90 лет, H.H. Donaldson [10] рассчитал, что на протяжении всего постнатального развития 1 год жизни крысы эквивалентен 30 годам жизни человека, или 1 месяц жизни крысы соответствует 2,5 годам человеческой жизни.
До начала эксперимента крысы были разделены по возрастному принципу. Группу «Молодые» составили 72 животных от 1 до 2 месяцев жизни и массой 100-150 г, что по указанной выше периодизации [9] соответствует периоду четвертого удвоения веса или, у человека, предпубертатному возрасту. Крысы возрастом от 9,5 до 15 месяцев жизни и массой 300-350 г, что соответствует у человека периоду первой зрелости, были объединены в группу «Взрослые», также состоящую из 72 голов.
Для моделирования мандибулярной травмы по краю нижней челюсти кожу разрезали скальпелем. Тупым способом отслаивали мышечный массив и выделяли поверхность мандибулы. В условиях применения охлаждения стерильным физиологическим раствором высверливали отверстие диаметром 2 мм в углу мандибулы без прохождения в ротовую полость. Животных подвергали эвтаназии через 1; 2; 3; 4 и 5 нед. после мандибулярной травмы [11]. В качестве контроля для каждой группы использовали интактных крыс соответствующего возраста.
После 24-часовой фиксации 4%-ным забуференным раствором параформа, ПЛУ обезвоживали в градиенте этилового спирта, просветляли в орто-толуоле и заливали в гистопласт. Гистологические срезы красили гематоксилином и эозином, просматривали в просвечивающем режиме светового микроскопа Axioimager M1 (Carl Zeiss, Germany).
Для получения данных о строении ПЛУ и составе клеточных элементов в их отделах, на экране компьютера измеряли изображения, которые были сделаны с использованием цифровой видеокамеры. В процессе морфометрии применяли оригинальные программы Axiovision (Zeiss, Германия). При установке объектива Х 5 на экране площадь изображения составляла 5 600 000 мкм2 (грани прямоугольника 2800х2000 мкм), для изучения клеточного состава (объектив Х 40) – 87 500 мкм2 (350х250 мкм). Статистические данные получали, обрабатывая численные результаты посредством программы MS Excel (Microsoft, USA), для сравнения использовали среднее арифметическое с его стандартным отклонением. Отличия сравниваемых средних величин считали статистически значимыми при p≤0,05.
Результаты исследования и их обсуждение. Корковое плато в структуре ПЛУ у молодых крыс через 1 нед. после мандибулярной травмы было больше, чем в контроле (13,7±0,997% от площади среза ПЛУ), на 82,4%, на 2-й нед. – на 82,4%, к 3-й нед. - на 35,3%, спустя 4 нед. – на 25% и через 5 нед. - на 29,4%. Процент паракортикальной зоны на срезе ПЛУ через 1 нед. стал, наоборот, меньше, по сравнению с контролем (46,1±1,9%), на 66,7%, на 2-й нед. – на 71%, к 3-й нед. - на 32,6%, спустя 4 нед. – на 28,9% и через 5 нед. - на 29,2%. Площадь, занимаемая лимфоидными узелками без центров размножения, через 1 нед. превосходила контрольные данные (4,84±0,719%) на 51,8%, а на 2-й нед. – на 43,3%. Процент мантия в узелках со светлыми центрами через 1 нед. был больше, чем в контроле (3,66±0,65%), на 70,3% и на 2-й нед. – на 63,5%. Процент мозговых синусов от среза ПЛУ возрос только на 1-й нед. на 25,3% относительно органов контрольных крыс (9,57±0,67%).
У молодых крыс объем коркового плато статистически значимо превосходил контрольный уровень в течение всего времени наблюдения, а у взрослых – только 2 нед. Площадь паракортекса у молодых животных была меньше исходной в течение всего эксперимента, а у взрослых – спустя 4 и 5 нед. уже не отличалась от контроля. Процент на срезе лимфоидных узелков без герминативных центров, а также мантия в фолликулах со светлым центром у молодых крыс превосходил контроль в течение 1 и 2 нед., а у взрослых – до 3 нед. включительно.
При моделировании повреждения нижней челюсти происходит деструкция тканей, образуются геморрагии, фибриновые сгустки, а также клеточный и тканевой детрит, обладающий антигенными свойствами, запускается асептическая воспалительная реакция. При попадании в регионарные ПЛУ антигенные вещества инактивируются и стимулируют начало иммунологических реакций. Необходимость обезвреживания и элиминации большого объема детрита способствует задержке лимфотока через ПЛУ, и даже блокаде его. Все это, видимо, является одной из главных причин расширения просвета мозговых синусов в те сроки после операции, когда объем детрита относительно велик.
После взаимодействия антигена с иммунокомпетентными клетками начинается пролиферация В-лимфоцитов коркового плато. Активно делящиеся клетки формируют лимфоидные узелки без центров размножения, далее в центре этих структур В-лимфоциты дифференцируются до иммуно- и плазмобластов, а по периферии продолжают делиться. Иммуно- и плазмобласты, в отличие от лимфоцитов, имеют более широкую светлую цитоплазму, в связи с этим центр узелка постепенно светлеет и расширяется, а на периферии, где В-лимфоциты продолжают делиться и содержится множество клеток практически без цитоплазмы и с ядром с конденсированным хроматином, образуется мантийная зона. Из-за запуска пролиферации и дифференцировки клеток коркового плато происходит расширение этой зоны, а вследствие формирования новых узелков без центров размножения возрастает процент их площади на срезе всего ПЛУ. Высокая митотическая активность на периферии лимфоидных узелков со светлыми центрами обусловливает гипертрофию мантия.
Иммунная система до взросления еще не полностью сформирована, после стимуляции антигеном начинается очень выраженная пролиферация клеток и их дифференцирование [5], видимо, в связи с этим произошла более длительная гипертрофия коркового плато в данной группе.
При попадании детрита в ПЛУ взрослых животных можно ожидать уже подготовленность иммунокомпетентных клеток именно к этим антигенам. С ними вступают во взаимодействие, главным образом, уже сформированные В-клетки памяти [2]. Необходимо обратить внимание, что в течение постнатального развития постепенно развивается способность В-лимфоцитов не реагировать на отдельные антигены [12], что предотвращает аутоаллергические и аутоиммунные ответы. Кроме того, по мере взросления снижается активность функционирования не только иммунной, но и лимфатической системы [2]. Со временем становится все меньше бластных форм иммунокомпетентных клеток [1; 2], с этим связаны изменения объема лимфоидных фолликулов без и с центрами размножения.
Реакции паракортекса в молодом возрасте были отмечены в течение более длительного возраста. Возможно, что вследствие еще не сформированной антительной защиты до наступления взросления [3-5] происходит компенсация защитных процессов за счет усиления активности клеточного компонента. Т-лимфоциты более активно выходят из паракортекса и направляются к воспаленным тканям [13], и вследствие этого паракортикальная зона более выраженно сокращается у молодых особей, и это уменьшение объема сохраняется более длительное время.
Процент лимфоцитов в паракортикальной зоне у молодых крыс через 1 нед. стал ниже, чем в контроле (72,8±3,07% от общего числа клеток), на 13,9%, а на 2-й нед. – на 16,5%. Количество макрофагов через 2 нед. было, наоборот, больше, по сравнению с контролем (1,87±0,717%), в 2,6 раза, на 3-й нед. – также в 2,6 раза, к 4-й нед. - в 2,5 раза и спустя 5 нед. - в 2,7 раза. Численность фигур митозов через 1 нед. была выше, чем в контроле (1,41±0,516%), в 2,6 раза и на 2-й нед. – в 2,8 раза. Число клеток с явлениями некробиоза через 1 нед. было больше, чем в контроле (1,32±0,491%), в 2,9 раза и на 2-й нед. – в 2,5 раза.
Макрофагальная инфильтрация паракортикальной зоны у молодых особей на все сроки наблюдения была выше контрольной, тогда как у взрослых – только в течение первых 3 нед. после хирургического вмешательства. Количество клеток на стадиях митоза и с некробиотическими изменениями у молодых крыс было больше, чем в контроле, на протяжении 2 нед., а у взрослых – только в течение 7 сут. после моделирования мандибулярной травмы.
У молодых крыс лимфоцитов в герминативных центрах узелков через 1 нед. стало меньше, чем в контроле (56,4±2,36% от общего числа клеток), на 42%, на 2-й нед. – на 57,8%, а спустя 3 нед. – на 36,8%. Иммуно- и плазмобластов было больше, чем в контроле (20,5±3,27), на 51%, на 2-й нед. – на 66,5%, а спустя 3 нед. – на 51,9%. Макрофагов через 1 нед. было больше, чем в контроле (3,68±0,777%), на 95,4%, на 2-й нед. – в 2,3 раза, к 3-й нед. - в 2,1 раза, спустя 4 нед. – на 63,5% и через 5 нед. – также на 63,5%. Клеток на стадиях деления через 1 нед. стало больше, чем в контроле (12,68±0,779%), на 87,3% и на 2-й нед. – на 93,6%. Нежизнеспособных клеток через 1 нед. было больше, чем в контроле (1,32±0,49%), в 2,9 раза и на 2-й нед. – в 3,1 раза.
Иммуно- и плазмобластов в светлых центрах у животных из группы «Молодые» было больше, чем в контроле, на протяжении 3 нед., а в группе «Взрослые» рост этого показателя зарегистрирован только в течение первых 2 нед. после мандибулярной травмы. Макрофагов в группе «Молодые» было больше, чем контроле, на протяжении всех 5 нед. эксперимента, тогда как в группе «Взрослые» этот показатель вернулся к исходным значениям к 3-й нед.
В просвете мозговых синусов ПЛУ крыс группы «Молодые» клеточных элементов с явлениями деструкции было больше исходного в течение 2 нед., а у взрослых – только 1 нед. Количество плазмоцитов через 4 и 5 нед. после операции у молодых животных превосходило контрольный уровень, а в группе взрослых данный показатель не менялся все время наблюдения. Число макрофагов у молодых крыс было очень значительным (рис. а), но превышало исходный уровень в течение первых 2 нед., тогда как у взрослых – 3 нед., несмотря на то что через 1 нед. после операции содержание фагоцитов было меньше (рис. а,б).
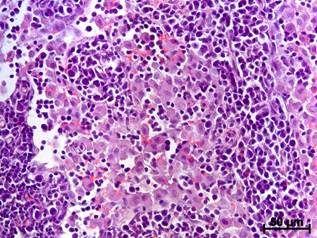 а
а 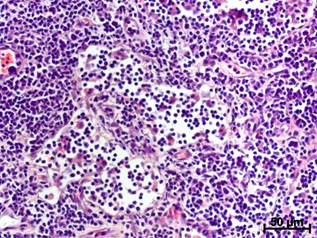 б
б
Макрофаги в мозговых синусах ПЛУ крыс разных возрастных групп через 1 нед. после моделирования мандибулярной травмы (окраска гематоксилином и эозином): а - у молодого животного просвет синусной системы блокирован макрофагами и детритом; б – у взрослой крысы количество макрофагов в синусах значительно меньше, на некоторых участках просвет синусов остается свободным
Общим в динамике клеточного состава различных структур СЛУ после хирургического вмешательства для животных всех возрастов являлось той или иной длительности и выраженности уменьшение числа лимфоцитов, на фоне этого возросло содержание макрофагов, иммуно- и плазмобластов, фигур митозов и клеточных элементов с явлениями деструкции. Кроме того, в просвете мозговых синусов увеличилась численность нейтрофилов, моноцитов, эритроцитов и плазмоцитов.
С попаданием антигена в СЛУ там начинается пролиферация лимфоцитов и параллельная дифференцировка их до иммуно- и плазмобластов и, далее, до плазматических клеток. Наиболее вероятно, что в связи с этим во всех структурах СЛУ уменьшается содержание лимфоцитов, увеличивается число иммуно- и плазмобластов и фигур митозов. По мере дифференцировки иммуно- и плазмобластов до незрелых и зрелых плазматических клеток данные клеточные элементы мигрируют из герминативных центров в мозговое вещество, где эти клетки секретируют иммуноглобулины в лимфу, содержащуюся в синусной системе для инактивации антигенов. По-видимому, это служит основной причиной возрастания содержания плазмоцитов в просвете мозговых синусов.
При анализе отличий состояния цитоархитектоники различных структур ПЛУ между сравниваемыми группами, был зарегистрирован менее интенсивный и не такой продолжительный рост численности нежизнеспособных клеточных элементов, макрофагов, иммуно- и плазмобластов.
В детском возрасте строение ПЛУ зависит от антигенной стимуляции, что продолжается до молодого зрелого возраста [3]. У молодых крыс, вследствие незрелости иммунной системы [4] и недостаточных контактов с антигеном, в ПЛУ после мандибулярной травмы мигрирует большое количество макрофагов, которые, адсорбируя антигены и дебрис, замещают недостаточное образование антител.
Из-за несовершенства иммунного ответа на попадание в ПЛУ молодых животных антигенов, там после активации В-лимфоцитов сразу начинается их быстрая пролиферация и дифференцирование, в результате резко увеличивается содержание молодых созревающих клеточных форм: иммуно- и плазмобластов. А так как при активном делении клеток появляется много клеточных элементов с различными дефектами [14], в различных структурах возрастает содержание клеток с явлениями деструкции.
Таким образом, можно заключить, что основные возрастные отличия реакций ПЛУ после мандибулярной травмы у крыс связаны с еще только формирующейся иммунной защитой, ее несовершенством до периода взросления.
Выводы
1. Направление изменений ПЛУ крыс, вызванных мандибулярной травмой, не связано с возрастом, однако интенсивность и продолжительность по времени реорганизации строения и клеточного состава обусловлены возрастом.
2. Выраженность преобразований коркового плато ПЛУ, продолжительность трансформирования поверхностной и глубокой коры в группе «Взрослые» были меньше, а мантия вокруг светлых центров, а также узелков без центров герминации – наоборот, больше, относительно группы «Молодые». Вместе с этим у животных до взросления зарегистрировано более интенсивное и более продолжительное наращивание численности макрофагов, клеток с признаками необратимых повреждений, иммуно- и плазмобластов.
Библиографическая ссылка
Майбородин И.В., Агзаев М.К., Майбородина В.И., Клинникова М.Г. РАЗЛИЧИЯ МОРФОЛОГИЧЕСКИХ РЕАКЦИЙ РЕГИОНАРНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ МОЛОДЫХ И ВЗРОСЛЫХ КРЫС НА ТРАВМУ ТКАНЕЙ В РЕГИОНЕ ЛИМФОСБОРА // Современные проблемы науки и образования. – 2020. – № 5. ;URL: https://science-education.ru/ru/article/view?id=30166 (дата обращения: 25.04.2024).



