Проблема терапии рецидивирующего бронхита является в последние годы особенно значимой в связи с возрастающей ролью вирусной инфекции в этиологии заболевания и большой вероятности перехода патологии в хроническую патологию, в том числе в бронхиальную астму [1, 2]. Ведущими факторами, способствующими формированию данной патологии, являются: генетическая предрасположенность к респираторным заболеваниям, неблагоприятные экологические факторы и социальные условия, инфицирование ассоциацией возбудителей и их персистенция с развитием дисбаланса иммунной защиты [3].
Представляет интерес возможность коррекции патогенетических компонентов данной патологии. Воздействие инфекционного компонента при рецидивирующем бронхите приводит к изменениям реактивности бронхиального дерева в виде бронхиального спазма, повышенной секреции слизи и отечности в стенке бронхов [4]. В активации данного патогенеза принимают участие не только факторы иммунной системы, но также активно обсуждается участие систем антиоксидантов и оксида азота в организме [5, 6]. В последние годы фармацевтические компании представляют большое количество лекарственных препаратов, относящихся к иммуномодуляторам [7]. Однако представляет интерес возможность данных препаратов не только корригировать дисбаланс в иммунной системе, но и влиять на систему антиоксидантов, оксид азота, показатели интоксикации в организме [8, 9].
Цель исследования. Целью работы явилось изучение влияния иммунокорректоров (дерината и полиоксидония) на показатели иммунной защиты организма (фагоцитоз, интерлейкины), антиоксидантной системы (каталазу, малоновый диальдегид, церулоплазмин) и оксида азота при рецидивирующем бронхите.
Материал и методы исследования. Исследованы пациенты с диагнозом «рецидивирующий бронхит», находившиеся на стационарном лечении в течение 14 дней. Возраст детей составил от 5 до 18 лет. Все пациенты имели в анамнезе частые респираторные заболевания, что и явилось провоцирующим фактором заболевания.
Дети, включенные в исследование, разделены на группы. I группа (n=15) получала стандартную терапию и полиоксидоний, II группа (n=15) получала стандартную терапию и деринат (n=15), III группа (n=15) пациентов получала только стандартную (симптоматическую) терапию. Пациенты были отобраны методом случайной выборки. Контрольную группу (n=15) составили здоровые дети того же возраста. Лечение полиоксидонием (ООО «НПО Петровакс Фарм», г. Москва, флаконы) проводили в дозе 0,15 мг/кг внутривенно через день, 5 инъекций на курс. Терапию деринатом (ЗАО «ФП «Техномедсервис», г. Москва) проводили в дозе 0,5 мл/на год жизни, но не более 5 мл препарата, через день, 5 инъекций на курс. Для выбора доз у детей использовалась инструкция по медицинскому применению лекарственного препарата. Определены биохимические показатели крови: церулоплазмин определялся по методу Равина, малоновый диальдегид – по методу С.Г. Конюховой и соавторов, для определения активности каталазы проводили реакцию перекиси водорода с солями молибдата аммония, оксид азота определяли по нитратам сыворотки крови с реактивом Грисса. Фагоцитарная активность нейтрофилов и фагоцитарное число исследовали с частицами латекса и использованием микроскопа Nikon Eclipes Ni-U с фотонасадкой Nikon DS-Fi1 (Япония) при увеличении (10х90). Исследование интерлейкинов (интерлейкина-18, интерлейкина-4 и γ-интерферона) проводили иммуноферментным методом с тест-системами «Вектор БЕСТ» (Россия).
Сравнительное исследование показателей крови осуществлялось по программе «Statistica 6.0». Использовались расчеты показателей парного (до и после терапии в одной группе) и непарного (до и после терапии между группами) критерия t-Стьюдента для оценки числовых показателей крови пациентов и χ-квадрата для оценки процента фагоцитарной активности нейтрофилов крови.
Результаты исследования и их обсуждение
Исследование антиоксидантного статуса пациентов показало, что до начала лечения во всех трех группах имело место существенное снижение активности каталазы и содержания церулоплазмина в плазме крови при высоком уровне малонового диальдегида. Полученные данные свидетельствуют о важной патогенетической роли угнетения активности компонентов антиоксидантной системы в развитии рецидивирующего бронхита (рис. 1). С этой точки зрения является не менее важным тот факт, что терапия с привлечением полиоксидония и дерината сопровождалась статически достоверной нормализацией как уровня малонового диальдегида, так и значений церулоплазмина и активности каталазы. У больных III группы, получавших стандартную терапию, не отмечалось нормализации исследуемых показателей
Полученные нами результаты коррелируют с данными, представленными в нашей публикации ранее [10], где было показано, что включение полиоксидония в комплексную терапию больных с рецидивирующим бронхитом позволяет достичь более полной редукции клинических симптомов и нормализации показателя функции внешнего дыхания (ОФВ1), позволяющего подтвердить наличие бронхиальной обструкции у пациентов.
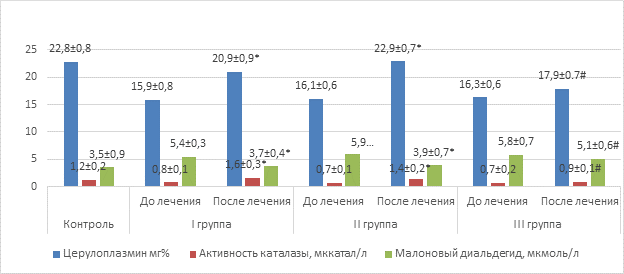
Рис. 1. Показатели церулоплазмина, каталазы и малонового диальдегида крови
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p <0,05) от значений I и II групп после лечения.
На следующем этапе исследования была проведена оценка уровня оксида азота в крови больных, получавших различные виды терапии (рис. 2). Было показано, что на момент госпитализации у больных отмечалось повышение уровня NO в сравнении с его содержанием в группе контроля. Сегодня известно, что источником оксида азота является синтаза оксида азота (NOS), причем существуют три изоформы этого фермента. Наибольшее количество NO образует индуцибельная изоформа синтазы оксида азота (iNOS), которая является кальций-независимой. Учитывая существенный прирост NO в крови больных с рецидивирующим бронхитом, мы можем предположить, что патогенез заболевания включает активацию именно индуцибельной изоформы синтазы оксида азота, поскольку две другие конститутивные изоформы не могут обеспечить такого значительного прироста газотрансмиттера. В конце периода терапии мы отмечали снижение уровня NO во всех трех группах пациентов, однако максимальное падение содержания NO наблюдалось у больных, получавших полиоксидоний. Оценить значение выявленного эффекта достаточно сложно. С одной стороны, повышение уровня NO может способствовать снижению сократительной активности гладкомышечных клеток сосудов резистивного типа и, вероятно, мелких бронхов. С другой стороны, высокий уровень NO может быть следствием повышения функциональной активности макрофагов, и, теоретически, это может иметь вредные последствия, поскольку грозит чрезмерной вазодилатацией, интоксикацией и нарушением кровотока в органах. Исходя из последнего предположения становится понятным стремление уровня NO к снижению на фоне использованной терапии, особенно при включении в терапевтический комплекс полиоксидония и дерината.
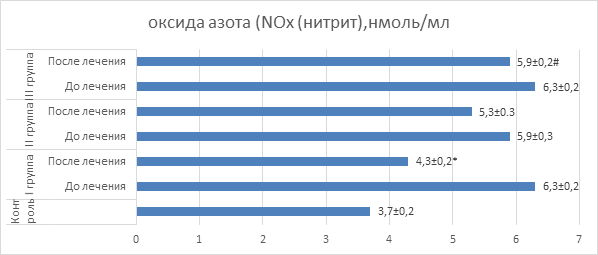
Рис. 2. Показатели оксида азота крови у детей
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p<0,05) от значений I группы после лечения.
Данные, представленные на рисунке 3, свидетельствуют о снижении функциональной активности нейтрофилов у больных с рецидивирующим бронхитом, на фоне нейтрофильного лейкоцитоза.
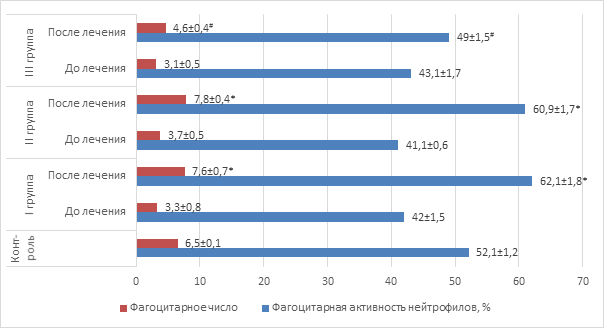
Рис. 3. Активность фагоцитоза у детей
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p<0,05) от значений I и II групп после лечения.
Отражением этой закономерности является уменьшение как фагоцитарной активности, так и фагоцитарного числа во всех трех группах пациентов до начала лечения в сравнении с соответствующими показателями контрольной группы. Терапия с применением полиоксидония или дерината сопровождается нормализацией фагоцитарной функции нейтрофилов, что свидетельствует о существенном влиянии данных лекарственных препаратов на важнейший показатель неспецифической резистентности организма.
Аналогичная закономерность была выявлена и при изучении содержания γ-интерферона в крови исследуемых групп лиц (рис. 4). У больных рецидивирующим бронхитом во всех трех группах наблюдалось снижение этого цитокина, что, видимо, объясняется угнетением клеточного звена иммунитета. Благоприятным фактом является способность полиоксидония и дерината стимулировать выработку γ-интерферона, что отражает способность данных лекарственных средств нормализовать работу Т-клеточного звена иммунной системы.
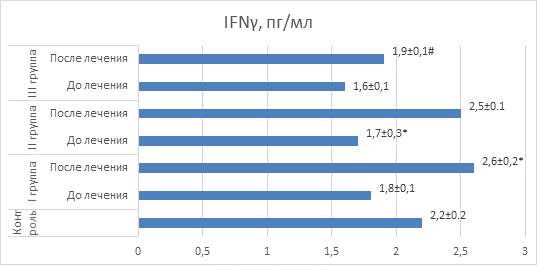
Рис. 4. Значения IFNγ крови у детей в сравнительном аспекте
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p<0,05) от значений I и II групп после лечения.
IL-18 является важнейшим показателем интенсивности воспалительного процесса. У больных всех трех групп до получения терапии отмечался более высокий, чем у доноров, уровень IL-18. Это является свидетельством значительного повреждения легких. Уменьшение антигенной нагрузки на бронхиальное дерево в ходе терапии сопровождается снижением уровня данного цитокина, что косвенно свидетельствует о снижении нагрузки на Т-клеточное звено иммунитета (рис. 5).
IL-4 имеет важное прогностическое значение для такой хронической патологии дыхательной системы, как бронхиальная астма. В связи с этим важно отметить, что у пациентов всех трех групп уровень IL-4 был существенно более высоким, чем в контрольной группе детей, что отражает высокий риск перехода рецидивирующего бронхита в бронхиальную астму. В связи с этим способность полиоксидония и дерината существенно снижать уровень данного цитокина рассматривается нами как важнейшее положительное свойство данных препаратов (рис. 6).
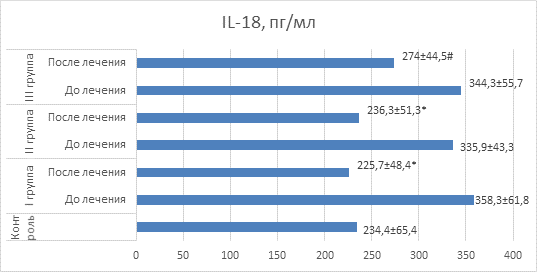
Рис. 5. Значения IL-18 у детей в сравнительном аспекте
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p<0,05) от значений I и II групп после лечения.
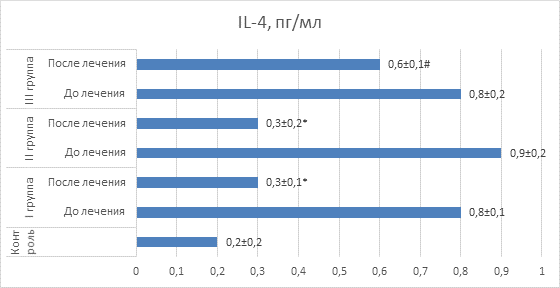
Рис. 6. Значения IL-4 у детей в сравнительном аспекте
Примечание: * – значения достоверно отличаются (p<0,05) от значений до лечения; # – значения достоверно отличаются (p<0,05) от значений I и II групп после лечения.
Таким образом, применение иммунокорректоров в комплексной терапии рецидивирующего бронхита не только оказывает благоприятное влияние на коррекцию основных симптомов патологического процесса, но и во многом нормализует показатели специфического и неспецифического иммунитета, повышает активность компонентов антиоксидантной системы, а также оптимизирует интенсивность выработки оксида азота. Сочетание обнаруженных свойств позволяет сделать вывод о более комплексном влиянии полиоксидония на патогенетические компоненты данной патологии. Полученные нами данные позволяют рекомендовать включение изученных нами препаратов в состав схем терапии рецидивирующего бронхита.
Библиографическая ссылка
Бурнайкина К.С., Герасимова Н.Г., Шепелева О.И., Балашов В.П., Коваленко Е.Н., Зотова Л.В., Грабова Т.В. ВОЗМОЖНОСТИ КОРРЕКЦИИ ПАТОГЕНЕТИЧЕСКИХ МЕХАНИЗМОВ РЕЦИДИВИРУЮЩЕГО БРОНХИТА ИММУНОМОДУЛИРУЮЩИМИ ПРЕПАРАТАМИ // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30292 (дата обращения: 19.04.2024).



