Фибрилляция предсердий (ФП) – распространенная и актуальная патология в структуре кардиологических заболеваний. Данное нарушение ритма, по данным разных авторов, выявляется у 13% населения Земли в возрасте старше 60 лет [1, 2, 3]. Частота встречаемости ФП растет в более старших возрастных группах [4, 5]. В многочисленных зарубежных и российских исследованиях было установлено, что ФП – один из главных факторов риска развития кардиоцеребральных осложнений, в первую очередь, острых нарушений мозгового кровообращения [6]. Эти осложнения на сегодняшний день во многом определяют смертность в мире, особенно в развитых странах [7].
Для любого кардиолога на практике важнейшими задачами ведения пациентов с ФП являются не только ее диагностика, но и решение вопроса о рациональности восстановления и поддержания у больного синусового ритма, а также обеспечение эффективной первичной и вторичной профилактики кардиоцеребральных осложнений.
Общепринятые на сегодняшний день европейские и российские рекомендации по риску и прогнозированию тромбоэмболических осложнений (например, одна из самых часто применяемых шкал CHADS2Vasc2) способны дать оценку вероятности риска кардиоцеребральных осложнений в каждом конкретном случае с учетом выявленных факторов [4, 8, 9]. Однако ни в одной из таких шкал нет указания на конкретный функциональный класс ФП. Нет деления ФП на функциональные классы, в основе которых лежит продолжительность максимальной измеренной паузы между сокращением желудочков. Таким образом, до сегодняшнего момента не было изучено влияние максимально измеренной продолжительности пауз между сокращением желудочков при ФП на вероятность развития кардиоцеребральных осложнений [10, 11, 12].
Цель исследования. Разработать математическую модель, позволяющую осуществлять прогнозирование риска кардиоцеребральных осложнений с учетом деления ФП на функциональные классы, основанную на длительности максимальной паузы между сокращением желудочков.
Материал и методы исследования
В исследование мы включили когорту из 88 больных с ФП постоянной формы, проходивших лечение в 2019–2020 гг. в клинике пропедевтической терапии Самарского государственного медицинского университета (СамГМУ). Средний возраст пациентов составил 72,8±5,8 года, из них 40 женщин и 48 мужчин.
Критерии включения пациентов: ФП постоянной формы, подписанное информированное согласие на участие в исследовании.
Критерии исключения: гематологические заболевания, сопровождающиеся гиперкоагуляцией, аневризма верхушки левого желудочка, признаки внутрисердечного тромбоза по данным чреспищеводной эхокардиографии (ЭхоКГ).
Исследование состояло из двух этапов: ретроспективного и проспективного. На ретроспективном этапе выполнялись трансторакальная и чреспищеводная ЭхоКГ, суточное мониторирование электрокардиограммы (ЭКГ), определение показателей липидного спектра крови (таких как общий холестерин, липопротеиды высокой плотности, липопротеиды низкой плотности, индекс атерогенности, триглицериды), показателей гемостаза (международное нормализованное отношение (МНО), активизированное частичное тромбопластиновое время (АЧТВ), длительность кровотечения по Сухареву, протромбиновый индекс (ПТИ), антитромбин III, подсчет количества тромбоцитов). При трансторакальной или чреспищеводной ЭхоКГ особое значение придавалось диагностике наличия тромбов в ушке левого предсердия или в области верхушки левого желудочка, которые могли бы потенциально стать источниками тромбоэмболических осложнений. При ультразвуковой допплерографии брахиоцефальных сосудов (УЗДГ БЦС), ветвей аорты и артерий нижних конечностей верифицировали степень выраженности атеросклероза магистральных артерий, в том числе обращали внимание на тип выявленных атеросклеротических бляшек (неровная поверхность, наличие кровоизлияний, экранирующих участков и другие признаки нестабильности бляшки). При учете анамнеза отмечали наличие инфаркта миокарда, транзиторных нарушений мозгового кровообращения, ишемических инсультов, обязательно верифицированных с помощью метода компьютерной томографии (КТ), а также артериальных эмболических осложнений артерий нижних конечностей.
Активно выявлялись традиционные факторы риска (возраст, пол, выраженность хронической сердечной недостаточности (ХСН), наличие острого нарушения мозгового кровообращения (ОНМК), ТИА, тромбоэмболические осложнения в анамнезе, сахарный диабет, артериальная гипертензия), которые в принципе могут оказать влияние на развитие кардиоцеребральных осложнений.
Анализируемой когорте больных выполнялись сфигмография артерий эластического типа – общей сонной артерии и мышечно-эластического типа – задней артерии голени, а также апекскардиография. Расчеты параметров кинетики магистральных артерий и биомеханики сердца (а именно: скорости, ускорения, работы, мощности) были произведены с помощью компьютерной программы, разработанной на базе СамГМУ, в автоматизированном режиме для каждого больного. Валидность (93%), чувствительность (85%) и специфичность (94%) данной методики были высокими. Ранее данная методика подробно описана в наших работах [10, 11].
Разделение на классы фибрилляции предсердий по данным результатов исследования суточного мониторирования ЭКГ было основано на принципе продолжительности максимальной паузы между желудочковыми сокращениями. Мы выделяли:
1) ФП с паузой между сокращением желудочков до 1 секунды (28 человек);
2) ФП с паузой между сокращением желудочков от 1, но менее 2 секунд (29 человек);
3) ФП с паузой между сокращением желудочков 2 и более секунд (31 человек).
Формирование сердечного выброса и суммарная гемодинамика стали основой для вышеизложенного функционального разделения ФП.
Проспективный этап заключался в наблюдении за пациентами в течение 1 года. Контрольные визиты были назначены от времени начала наблюдения через 3, 6 и 12 месяцев. При этом на контрольных визитах анализировали развитие кардиоцеребральных осложнений, которые выяснялись путем расспроса, изучения данных историй болезни (КТ верифицированное ОНМК) в случае повторной госпитализации, а также данных амбулаторных методов исследования.
Все пациенты с ФП получали сходную стандартную терапию согласно современным рекомендациям европейского и российского общества кардиологов по лечению ФП и профилактике кардиоцеребральных осложнений при ФП, включающую антикоагулянты, антиагреганты, бета-адреноблокаторы [4]. Коррекция терапии в случае необходимости проводилась амбулаторно врачом-кардиологом поликлиники. Показатели липидного профиля и гемостаза находились в пределах целевых значений у всех пациентов. Все группы были статистически незначимо различимы по полу, возрасту, наличию сопутствующей патологии, назначенной терапии (табл. 1).
Таблица 1
Клиническая характеристика групп пациентов с ФП
|
Параметр (p>0,05) |
I группа (n=28) |
II группа (n=29) |
III группа (n=31) |
|
Инфаркт миокарда (ИМ) в анамнезе |
2 |
2 |
3 |
|
ОНМК в анамнезе |
1 |
1 |
2 |
|
Стеноз каротидной бифуркации, выявленный по УЗДГ БЦС, гемодинамически не значимый |
16 |
15 |
17 |
|
Бляшка III Б |
7 |
5 |
7 |
|
Стеноз артерий нижних конечностей, выявленный по УЗДГ, гемодинамически не значимый |
5 |
7 |
7 |
Методы статистического анализа включали анализ четырехпольной таблицы (критерий хи-квадрат с определением его уровня значимости), оценку связи между фактором риска и исходом производили с использованием критериев φ, Крамера, Чупрова, коэффициента сопряженности Пирсона. Мы использовали программы Microsoft Excel, Statistica 6.0, а также сайт с онлайн-расчетами статистических данных www.medstatistics.ru. При анализе данных параметров биомеханики сердца и кинетики магистральных артерий применялся метод построения вариационных рядов. При этом использовались графоаналитический метод и расчет относительных величин. При построении модели прогнозирования тромбоэмболических осложнений применялся многофакторный анализ. Для создания компьютерной программы использовались расчеты с применением нейросетей.
Результаты исследования и их обсуждение
При каждом из вариантов ФП с помощью методов апекскардиографии и сфигмографии магистральных артерий эластического типа – общей сонной и мышечно-эластического типа – задней артерии голени мы в автоматизированном режиме вычисляли параметры кинетики магистральных артерий и биомеханики сердца, а именно: скорость, ускорение, работу, мощность.
При сравнении данных мы смогли определить значение всех вычисленных параметров кинетики магистральных артерий и биомеханики сердца, измеренные во время прохождения пульсовой волны в первом сокращении, следующем после продолжительной паузы между сокращением желудочков, у больных с различными функциональными классами ФП. При этом прослеживалась четкая закономерность: чем дольше была пауза между сокращением желудочков, тем больше возрастали анализируемые параметры. На рисунках 1, 2, 3 представлен расчет показателей вариационных рядов с расчетом относительных величин – соотношения показателей данных совокупностей интегрального параметра (работы) в процентах по данным апекскардиографии, сфигмографии магистральных артерий (общей сонной артерии и задней артерии голени) при каждом выделенном нами варианте ФП (по сравнению с показателями при правильном ритме). Параметр работы был выбран для демонстрации тенденции изменения параметров биомеханики сердца и кинетики магистральных артерий как наиболее интегральный, т.е. наиболее общий. Мы показали изменение относительных величин данного параметра в каждой из анализируемых групп. При расчете пользовались методом оценки вариационных рядов с последующим сравнительным анализом.
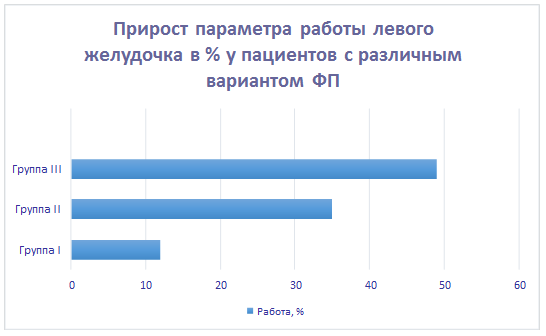
Рис. 1. Интегральный параметр – работа, вычисленная с помощью апекскардиографии, при различных функциональных классах ФП (различие достоверно, p<0,05). Показатели вариационного ряда для I группы: Число единиц наблюдения (n): 28. Средняя арифметическая (М): 11,28. Медиана (Ме): 11. Стандартное квадратичное отклонение (σ): 1,56. Коэффициент вариации (Cv): 13,80%. Средняя ошибка средней арифметической (m): 0,29. Для II группы: Число единиц наблюдения (n): 29. Средняя арифметическая (М): 34,46. Медиана (Ме): 34. Стандартное квадратичное отклонение (σ): 1,86. Коэффициент вариации (Cv): 15,50%. Средняя ошибка средней арифметической (m): 0,24. Для III группы: Число единиц наблюдения (n): 31. Средняя арифметическая (М): 49,32. Медиана (Ме): 49. Стандартное квадратичное отклонение (σ): 1,76. Коэффициент вариации (Cv): 12,70%. Средняя ошибка средней арифметической (m): 0,21.
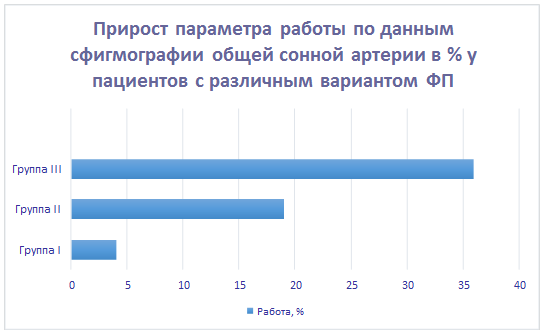
Рис. 2. Интегральный параметр – работа, вычисленная с помощью сфигмографии общей сонной артерии, при различных функциональных классах ФП (различие достоверно, p<0,05). Показатели вариационного ряда для I группы: Число единиц наблюдения (n): 28. Средняя арифметическая (М): 4,32. Медиана (Ме): 4. Стандартное квадратичное отклонение (σ): 0,66. Коэффициент вариации (Cv): 12,80%. Средняя ошибка средней арифметической (m): 0,19. Для II группы: Число единиц наблюдения (n): 29. Средняя арифметическая (М): 18,86. Медиана (Ме): 19. Стандартное квадратичное отклонение (σ): 1,12. Коэффициент вариации (Cv): 11,90%. Средняя ошибка средней арифметической (m): 0,26. Для III группы: Число единиц наблюдения (n): 31. Средняя арифметическая (М): 36,26. Медиана (Ме): 36. Стандартное квадратичное отклонение (σ): 1,36. Коэффициент вариации (Cv): 13,20%. Средняя ошибка средней арифметической (m): 0,25.
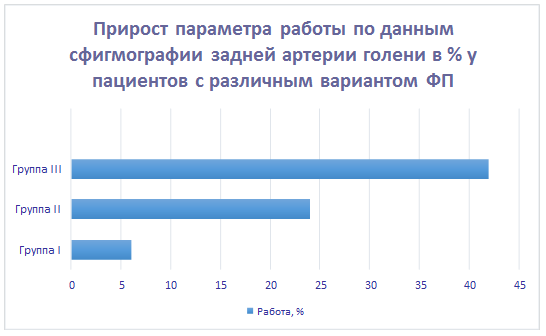
Рис. 3. Интегральный параметр – работа, вычисленная с помощью сфигмографии задней артерии голени, при различных функциональных классах ФП (различие достоверно, p<0,05). Показатели вариационного ряда для I группы: Число единиц наблюдения (n): 28. Средняя арифметическая (М): 6,18. Медиана (Ме): 6. Стандартное квадратичное отклонение (σ): 0,29. Коэффициент вариации (Cv): 12,10%. Средняя ошибка средней арифметической (m): 0,27. Для II группы: Число единиц наблюдения (n): 29. Средняя арифметическая (М): 24,23. Медиана (Ме): 24. Стандартное квадратичное отклонение (σ): 1,03. Коэффициент вариации (Cv): 11,50%. Средняя ошибка средней арифметической (m): 0,22. Для III группы: Число единиц наблюдения (n): 31. Средняя арифметическая (М): 42,44. Медиана (Ме): 42. Стандартное квадратичное отклонение (σ): 1,31. Коэффициент вариации (Cv): 13,42%. Средняя ошибка средней арифметической (m): 0,26.
Таким образом, максимальный показатель параметра работы мы наблюдали в III группе, минимальный прирост – в I группе.
Во время контрольных визитов нами были проанализированы осложнения в каждой из выделенных групп (табл. 2).
Таблица 2
Кардиоцеребральные осложнения в течение 1 года
|
Параметр (p<0,05) |
I группа (n=28) |
II группа (n=29) |
III группа (n=31) |
|
КТ верифицированное ОНМК |
3 |
4 |
8 |
|
ИМ |
1 |
1 |
3 |
|
Дистальные эмболии АНК |
0 |
0 |
1 |
Мы провели многофакторный анализ оценки риска развития кардиоцеребральных осложнений у изучаемой когорты пациентов в течение одного года и на основании этого создали математическую модель. За основу анализируемых факторов риска мы взяли ранее доказанные в многочисленных когортных и рандомизированных исследованиях факторы риска, которые применяются во всем мире для оценки вероятности кардиоцеребральных осложнений у больных с ФП (CHADS2Vasc2). Единственным отличием от данной классификации стало применение градации ФП по продолжительности максимальных пауз между сокращением желудочков. Основные выделенные параметры анализа были следующими: инсульт, ТИА, системная тромбоэмболия в анамнезе; возраст до 65 лет; возраст старше 65 лет; наличие гетерогенных атером любой локализации; наличие фибрилляции предсердий с максимальной паузой между сокращением желудочков до 1 секунды; от 1, но менее 2 секунд; с паузой 2 секунды и более; наличие сахарного диабета; устойчивая артериальная гипертензия; наличие хронической сердечной недостаточности выше II функционального класса по NYHА; наличие гемодинамически значимых стенозов каротидной бифуркации. Каждому из параметров в зависимости от вклада в развитие кардиоцеребральных осложнений было присвоено определенное значение баллов (от 1 до 2).
С учетом всех учтенных нами факторов риска выявляли суммарный риск развития кардиоцеребральных осложнений (табл. 3). Расчет данных и построение модели проводили с применением нейросетей. На основании расчетов мы создали и запатентовали программу ЭВМ «Программа для оценки риска развития тромбоэмболических осложнений», свидетельство о государственной регистрации № 2020617246 от 2 июля 2020 г.
Таблица 3
Стратификация риска кардиоцеребральных осложнений.
|
Параметр |
Количество баллов |
|
Возраст до 65 лет |
1 |
|
Возраст старше 65 лет |
2 |
|
Сердечная недостаточность NYHA II и выше |
1 |
|
Фибрилляция предсердий с максимальной паузой между желудочковыми сокращениями до 1 секунды |
1 |
|
Фибрилляция предсердий с максимальной паузой между желудочковыми сокращениями от 1, но менее 2 секунд |
1 |
|
Фибрилляция предсердий с максимальной паузой между желудочковыми сокращениями 2 секунды и более |
2 |
|
Артериальная гипертензия |
1 |
|
Сахарный диабет |
1 |
|
Инсульт, ТИА или системная тромбоэмболия в анамнезе |
2 |
|
Гемодинамически значимый стеноз каротидной бифуркации |
2 |
|
Наличие гетерогенных атером любой локализации |
1 |
Результирующий риск по комплексной оценке вероятности развития кардиоцеребральных осложнений в зависимости от суммарного количества баллов по данным многофакторного анализа: 13 – 24,1%, 12 – 22,8%, 11 – 20,2%, 10 – 17,6%, 9 – 14,2%, 8 – 12,9%, 7 – 9,8%, 6 – 8,5%, 5 – 6,7%, 4 – 4,1%, 3 – 3,3%, 2 – 2,7%, 1 – 0,9%.
В существующих на сегодняшний момент шкалах по прогнозированию тромбоэмболических осложнений до сих пор нет ФП, разделенной в зависимости от продолжительности максимальной паузы между сокращением желудочков в кардиоцикле [1, 2, 4]. В нашей работе мы показали различный вклад каждого варианта ФП в кинетику магистральных артерий.
На этапе отбора пациентов мы исключили наличие у них внутрисердечного тромбоза, показатели гемостаза и липидного спектра были в пределах целевых значений. Однако в III группе количество кардиоцеребральных осложнений было достоверно выше при наблюдении в течение 1 года. При этом на начальном этапе обследования группы отличались лишь по функциональному варианту ФП, а именно разной продолжительности максимальной паузы между сокращением желудочков. Мы считаем, что именно этот фактор у пациентов с ФП стал решающим в развитии кардиоцеребральных осложнений.
Таким образом, для возможности развития кардиоцеребральных осложнений наибольшее значение имели следующие факторы: возраст больных старше 65 лет; гемодинамически значимый стеноз каротидной бифуркации [10]; ФП с вычисленной максимальной паузой между желудочковыми сокращениями от 2 секунд и более; инсульт, ТИА или системная тромбоэмболия в анамнезе (табл. 3) [10]. Выявленные нами результаты позволили дополнить существующие шкалы по оценке риска тромбоэмболических осложнений, разделив ФП на функциональные классы, что дало возможность более точно провести стратификацию риска.
Первое сокращение желудочков после продолжительной паузы при ФП приводит к развитию своеобразного «гидравлического удара» во всей артериальной системе в той ее части, где кровоток носит дискретный характер. Чем длиннее пауза между сокращением желудочков при ФП, тем сильнее гидравлический удар первого сокращения желудочков после паузы. При этом происходит возрастание линейной скорости кровотока и, соответственно, объемного кровотока по данным ультразвуковой допплерографии до 2,3 раза по сравнению с правильным ритмом [10, 12].
Мы полагаем, что целесообразно применение дополнительных ЭКГ-признаков при ФП для определения риска развития кардиоцеребральных осложнений у каждого больного. При этом использование дополнительных ЭКГ-признаков при ФП в зависимости от длины максимальной вычисленной паузы между сокращением желудочков может быть оправдано и удобно в клинической практике врача-кардиолога, терапевта, кардиохирурга.
При оценке данных суточного мониторирования ЭКГ мы рекомендуем обращать внимание на выявленный функциональный класс ФП и указывать его в протоколе. В качестве дополнительных методов исследования к общему перечню таким больным необходимо выполнять сфигмографию магистральных артерий, апекскардиографию с целью оценки параметров кинетики магистральных артерий и биомеханики сердца.
Использование дополнительных ЭКГ-признаков при ФП может помочь определиться с дальнейшей тактикой ведения каждого больного, влиять на прогноз развития кардиоцеребральных осложнений, а также обосновать целесообразность купирования нарушения ритма.
Риск кардиоцеребральных осложнений возрастает, если у пациентов имеется функциональный класс ФП с максимальной вычисленной паузой между сокращением желудочков от 2 секунд и более. Мы считаем рациональным применение предложенной шкалы оценки риска развития кардиоцеребральных осложнений при ФП в клинической практике.
Мы предлагаем дополнить существующую классификацию ФП с делением ее на функциональные классы. Мы выделяем:
1) ФП с паузой между сокращением желудочков до 1 секунды;
2) ФП с паузой между сокращением желудочков от 1, но менее 2 секунд;
3) ФП с паузой между сокращением желудочков 2 и более секунды.
При этом наиболее опасной с точки зрения развития тромбоэмболических осложнений является ФП с паузами 2 и более секунды.
Выводы. Созданная математическая модель прогнозирования кардиоцеребральных осложнений оптимальна для применения в клинической практике, позволяет наиболее полно провести стратификацию риска у больных с ФП.
Библиографическая ссылка
Германова О.А., Германов А.В., Степанов М.Ю., Германов В.А. КАРДИОЦЕРЕБРАЛЬНЫЕ ОСЛОЖНЕНИЯ: ПРОГНОЗИРОВАНИЕ НА ОСНОВЕ ДОПОЛНИТЕЛЬНЫХ ЭКГ-ПРИЗНАКОВ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30344 (дата обращения: 19.04.2024).



