Ревматоидный артрит является часто встречающимся заболеванием, распространенность которого все время растет [1]. Данное заболевание сопровождается сильными болевыми ощущениями, связанными с воспалением тканей сустава, что может приводить к частичной, а в ряде случаев – и к полной утрате его работоспособности. При этом происходит повреждение синовиальной оболочки, в которой сосредоточены лимфатические и кровеносные сосуды. Соответственно, это влияет и на питание сустава, и на выработку синовиальной жидкости, питающей хрящевую ткань. В качестве одной из причин заболевания рассматривают вирусные инфекции, которые влияют на лимфатическую и иммунную системы человека. При этом организм вырабатывает антитела, которые из-за аутоиммунных нарушений начинают атаковать различные компоненты межклеточного матрикса, такие как протеогликаны и коллагеновые белки. Кроме того, считается, что еще одной причиной заболевания является генетическая предрасположенность к ревматоидному артриту [2].
В связи с этим особый интерес представляет изучение обмена основных компонентов межклеточного матрикса хрящевой ткани, обеспечивающей нормальную работу суставов. Главными белковыми компонентами соединительной ткани любого органа являются коллагеновые белки, центральную роль в обмене которых выполняют внеклеточные протеиназы, относящиеся к семейству матриксных металлопротеиназ (ММП) [3, 4]. Повышенная концентрация ММП считается одной из главных причин, вызывающих развитие воспаления и образование структурных деформаций [5]. На сегодняшний день известно около 30 ММП человека, на основании субстратной специфичности и гомологии которых они подразделяются на шесть групп: коллагеназы, желатиназы, стромелизины, матрилизины, ММП мембранного типа и другие ММП [3, 6]. Последняя группа объединяет ММП, о химической природе и свойствах которых на данный момент известно мало. В развитии патологических изменений при ревматоидном артрите важную роль играют три типа ММП: коллагеназы (ММП-1, -8 и -13), стромелизины (ММП-3) и желатиназы (ММП-2 и -9) [7]. Имеющиеся в литературе данные демонстрируют все возрастающий интерес исследователей к этим ферментам в патогенезе целого ряда заболеваний. Однако эти литературные данные по-прежнему недостаточны, а подчас и противоречивы, что не позволяет четко сформировать представление о роли ММП в дегенеративных изменениях, протекающих в суставах при ревматоидном артрите. В связи с этим изучение характера поведения этих ферментов при данном заболевании является актуальной задачей, призванной расширить представления о причинах воспалительных процессов, протекающих в суставах, что даст возможность в дальнейшем разработать новые подходы к оценке степени активности заболевания и создать более эффективные лекарственные препараты и способы лечения.
Цель исследования: методом зимографии определить молекулярные массы белков, обладающих желатиназной активностью, в сыворотке крови больных ревматоидным артритом и провести сравнительный анализ со здоровыми людьми.
Материал и методы исследования
Для проведения исследований была взята сыворотка крови 13 здоровых и 17 больных ревматоидным артритом женщин в возрасте 44–65 лет. Кровь собирали и, после того как она свернулась, центрифугировали 10 мин при 300 g, отбирали сыворотку и хранили в холодильнике при температуре -15оС до момента использования в экспериментах. Все обследуемые были информированы о проводимой работе. Исследование проведено с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации.
Зимография. Электрофоретическое разделение сывороточных белков проводили в полиакриламидном геле с сополимеризованным желатином (1 мг/мл). 5 мкл сыворотки крови здоровых и больных ревматоидным артритом людей разбавляли в 10 раз физиологическим раствором, после чего смешивали с эквивалентным объемом буфера, содержащего 20 мМ Трис-HCl, додецилсульфат натрия (4%), рН 7,5, и оставляли при комнатной температуре на 1 ч. Затем в образцы вносили глицерин (10%) и бромфеноловый синий (0,01%). Как правило, в одном эксперименте использовали 6 образцов сыворотки крови по 2–3 образца здоровых и по 2–3 образца больных ревматоидным артритом людей. Диск-электрофорез белков проводили в системе Лэммли в присутствии додецилсульфата натрия, но без редуцирующего агента [8]. Образцы в объеме 5 мкл наносили в карманы верхнего полиакриламидного геля (4%) и проводили электрофорез при 50 В. После того как образцы вошли в гель, напряжение увеличивали до 150 В (20–25 мА) и разделяли белки в нижнем полиакриламидном геле (7,5%), содержащем желатин (1 мг/мл), при температуре 4°С в течение 70 мин. Для замены додецилсульфата натрия гель после электрофореза инкубировали с неионным детергентом Тритоном Х–100 (2,5%) при комнатной температуре в течение 80 мин. Затем гель промывали в буфере, содержащем 20 мМ Трис-НCl, 5 мМ CаCl2, рН 7,5, и инкубировали в этом же буфере в течение 18 ч при температуре 37°С. Для выявления областей, свободных от желатина, гель сначала инкубировали 1–2 ч при комнатной температуре в растворе (25% этанол, 10% уксусная кислота), содержащем белковый краситель кумасси бриллиантовый синий R-250 (0,1%). Затем гель открашивали этим же раствором, только без красителя. Молекулярную массу белков, обладающих желатиназной активностью, определяли, сканируя окрашенный гель на денситометре GS-900 с программным обеспечением Image Lab («Bio-Rad», США). В качестве стандартов для определения молекулярной массы белков применялся набор рекомбинантных белков («Bio-Rad», США).
Концентрацию белка определяли по методу М. Брэдфорда [9].
Статистическую обработку полученных данных проводили методом парных сравнений с использованием t-критерия Стьюдента. Данные выражали как средние значения ± ошибка среднего (M±m).
Результаты исследования и их обсуждение
На рисунке 1 показано, что в обеих группах желатиназная активность сыворотки крови была характерна для 5 белков с молекулярной массой 60, 63, 84–93, 120 и 300 кДа. У здоровых людей белок с молекулярной массой 60 кДа обладал наибольшей активностью, которая более чем в 2 раза превышала суммарную желатиназную активность других белков (рис. 2). У больных ревматоидным артритом активность данного белка также была хорошо выражена, однако самая большая желатиназная активность наблюдалась у широкой белковой зоны в районе 84–93 кДа, которая была почти в 2,5 раза больше.

Рис. 1. Зимография сыворотки крови здоровых людей (1) и больных ревматоидным артритом (2). Стрелками указаны молекулярные массы белков, проявляющих желатиназную активность. Желатиназные спектры, показанные на рисунке, являются результатом одного из 5 отдельных экспериментов
У больных ревматоидным артритом по сравнению со здоровыми людьми наблюдалось значительное увеличение желатиназной активности белковых зон с молекулярной массой 84–93, 120 и 300 кДа, в то время как белковые зоны с молекулярной массой 60 и 63 кДа достоверно не отличались друг от друга.
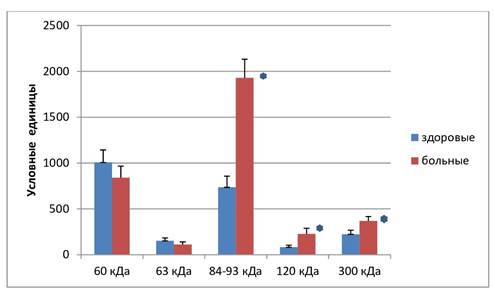
Рис. 2. Анализ желатиназной активности белков сыворотки крови здоровых людей и больных ревматоидным артритом. Результаты, представленные на рисунке, являются средними значениями 5 отдельных экспериментов. Звездочками указана достоверность отличий при р<0,05
Исходя из данных литературы группа желатиназ включает два фермента: ММП-2 (желатиназа-А) и ММП-9 (желатиназа-В), которые синтезируются в основном фибробластами, а также остеобластами, одонтобластами и секретируются в межклеточный матрикс в виде предшественников молекулярной массой в районе 72 кДa и 92 кДа соответственно. В межклеточном матриксе они подвергаются активированию за счет ограниченного протеолиза [3, 10]. MMП-2 и MMП-9 участвуют в деградации главного компонента базальных мембран – коллагена IV типа, а также желатина, почему и получили такое название. ММП-2 и ММП-9, разрушая коллаген IV типа, способствуют клеточной инвазии в базальную мембрану клеток, что играет важную роль в таких процессах, как ангиогенез, а также в патогенезе таких заболеваний, как рак и артрит. ММП-2 и ММП-9 могут оказывать влияние на воспалительные процессы, проявляя как провоспалительные, так и противовоспалительные эффекты [3, 10].
Очевидно, выявленные нами белки с молекулярной массой 60 и 63 кДа относятся к латентной и активированной форме желатиназы А, а широкая зона с молекулярной массой 84–93 кДа соответствует желатиназе В. Уровень экспрессии ММР-2 постоянен и обычно не индуцируется цитокинами или факторами роста [11]. Результаты данного исследования хорошо согласуются с представлением о том, что экспрессия желатиназы А носит конститутивный характер, поскольку белки с молекулярной массой 60 и 63 кДа у здоровых людей и больных ревматоидным артритом практически не отличались друг от друга.
В отличие от желатиназы А, экспрессия желатиназы В может индуцироваться различными цитокинами; кроме того, желатиназа В секретируется воспалительными клетками. Она участвует в воспалительных процессах, оказывая регулирующее влияние на процессинг провоспалительных цитокинов [11]. Корреляция экспрессии желатиназы В продемонстрирована для таких патологий, как бронхиальная астма, хронический панкреатит, онкологические заболевания, хронические воспалительные аутоиммунные заболевания, включая и ревматоидный артрит [3, 6, 11]. Как следует из результатов данного исследования, максимальная желатиназная активность у больных ревматоидным артритом была характерна именно для белковой зоны с молекулярной массой в районе 84–93 кДа, представляющей собой желатиназу В.
Считается, что при ревматоидном артрите одним из ключевых медиаторов патологических изменений суставов является ММП-3, относящаяся к стромелизинам. Этот фермент катализирует деградацию многих компонентов межклеточного матрикса, включая протеогликановые комплексы, коллагены, белки адгезии [7, 12]. Экспрессия ММП-3 является индикатором активности заболевания при ревматоидном артрите, поскольку наблюдается корреляция активности фермента со степенью повреждения сустава. Кроме того, эта ММП может играть роль и в других дегенеративных артритах, таких как ювенильный идиопатический артрит и остеоартрит [13].
Как следует из результатов данного исследования, при ревматоидном артрите активность сывороточной желатиназы В может увеличиваться в 2,5–3 раза, что указывает на непосредственное участие этой ММП в усилении воспалительных процессов и деградации соединительнотканных структур суставов. Учитывая тот факт, что активность желатиназы В была гораздо выше по сравнению с другими белками, проявляющими желатиназную активность, можно утверждать, что она играет одну из главных ролей при ревматоидном артрите наряду с ММП-3. Определение активности желатиназы В может выступать в качестве диагностического теста по оценке степени тяжести протекания заболевания или же по оценке влияния лекарственных веществ, используемых при лечении ревматоидного артрита.
Поскольку желатиназная активность белков с молекулярной массой 120 и 300 кДа также была гораздо выше у больных ревматоидным артритом по сравнению со здоровыми людьми, то здесь можно предположить наличие в сыворотке крови еще каких-то ферментов, способных вносить свой вклад в развитие воспалительного процесса, которые также могут выступать в качестве маркеров степени деструктивных изменений суставов при данной патологии. К какому классу известных на сегодняшний день ММП относятся белки с молекулярной массой 120 и 300 кДа, в рамках данного исследования сказать трудно, поскольку поиск по данным литературы ММП с соответствующими молекулярными размерами ничего не дал. По-видимому, данные белки могут относиться к последней группе неклассифицированных ММП.
Ранее нами было проведено определение гиалуронидазной активности сыворотки крови здоровых и больных ревматоидным артритом людей. У больных ревматоидным артритом наблюдалось увеличение гиалуронидазной активности в 1,5 раза по сравнению со здоровыми людьми [14]. Будучи гигантским полимером, связывающим различные молекулы, а также выполняющим функции смазки суставных поверхностей, гиалуроновая кислота является одним из главных компонентов межклеточного матрикса наряду с коллагеновыми белками, от которых зависит нормальная работа сустава. Как показывают результаты этой работы, увеличение желатиназной активности у больных ревматоидным артритом также было значительным по сравнению со здоровыми людьми. Таким образом, патологические изменения суставов, наблюдающиеся при ревматоидном артрите, происходят на фоне значительного увеличения активности гидролитических ферментов, таких как гиалуронидазы и желатиназы, разрушающих основные органические компоненты межклеточного матрикса суставов.
Заключение
Полученные результаты подтверждают участие ММП в процессах воспалительных изменений суставов при ревматоидном артрите, что сопровождается увеличением желатиназной активности сыворотки крови больных [15]. Однако участие желатиназы А и желатиназы В в патогенезе ревматоидного артрита может быть различным, несмотря на то, что они проявляют сходные эффекты, поскольку активность желатиназы А у больных ревматоидным артритом не отличалась от таковой у здоровых людей, в то время как активность желатиназы В у больных ревматоидным артритом была в несколько раз выше. Кроме того, свой вклад в развитие воспалительного процесса могут вносить и другие ММП, обладающие желатиназной активностью, например белки с молекулярной массой 120 и 300 кДа. К какому семейству ММП они относятся, еще предстоит выяснить.
Библиографическая ссылка
Дзгоев С.Г. ИССЛЕДОВАНИЕ ЖЕЛАТИНАЗНОЙ АКТИВНОСТИ СЫВОРОТКИ КРОВИ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30380 (дата обращения: 19.04.2024).



