Одной из основных причин развития ишемического инсульта (в 30–40% случаев) является атеросклеротическое поражение магистральных артерий головы. Выявленный в этом случае симптомный каротидный более 70–75% стеноз является показанием к хирургическому лечению [1]. Однако четкой тактики ведения пациентов с асимптомными каротидными стенозами в настоящее время нет. Частота встречаемости асимптомных стенозов более 60% возрастает с увеличением возраста от 0,5% у лиц младше 50 лет до 5–10% у лиц старше 65 лет. Более 75% всех инсультов возникают без какой-либо предшествующей неврологической симптоматики, что требует пристального превентивного обследования больных из групп риска, в том числе исследования когнитивных функций и перфузии головного мозга.
Важным фактором риска развития острого сосудистого эпизода является состояние перфузии областей головного мозга, кровоснабжаемых из бассейна стенозированной артерии. При динамической компьютерно-томографической перфузии выявляются неоднородность изменений мозгового кровотока при стенозах внутренних сонных артерий (ВСА) (зона кровоснабжения средней мозговой артерии и задняя зона смежного кровоснабжения подвержены изменениям перфузии уже при стенозе ВСА 50–69%), а также более выраженное снижение мозгового кровотока у пациентов с симптомными стенозами ВСА>70% по сравнению с асимптомными [2].
До 80% пациентов с гемодинамически значимыми, но асимптомными каротидными стенозами имеют в анамнезе когнитивные полиморфные нарушения различной степени выраженности: нарушения памяти, расстройство обобщения понятий, возникновение апатии, которые могут сочетаться с депрессией, а также характеризуются быстрой истощаемостью когнитивных функций [3]. При этом около половины пациентов с умеренными когнитивными расстройствами в течение 5 лет становятся дементными [4].
Когнитивные нарушения являются полиэтилогическим синдромом, который тесно взаимосвязан с деменцией на патогенетическом уровне и носит сосудисто-дегенеративный характер. В патогенезе сосудистого звена основная роль принадлежит локальным морфофункциональным нарушениям: артерио-артериальным микроэмболиям из изъязвляющейся бляшки, тромбоцитарным агрегатам. Нарушения сосудисто-тромбоцитарного и коагуляционного звена в сторону повышения вязкости крови, гиперфибриногенемии и другие состояния гемостаза предрасполагают к возникновению микроэмболов. Развитие хронической ишемии головного мозга является предиктором прогрессирования нейродегенеративных процессов [5].
Генетика сосудистой деменции многофакторна. Есть не только гены, связанные с сосудистой патологией, но и гены, предрасполагающие к когнитивным нарушениям, и гены с комбинацией эффектов [6]. Генетика атеросклероза хорошо описана, и в контексте когнитивных дисфункций важны APOE (OMIM: 107741), ассоциированный с гиперхолестеринемией и в то же время с болезнью Альцгеймера, и VLDLR (OMIM: 192977), ассоциированный c гипоплазией мозжечка и интеллектуальной задержкой с или без передвижения на четырех конечностях 1-го типа. Известны неатеросклеротические сосудистые заболевания мозга, такие как CADASIL и CARASIL [7].
Амилоидоз мозга может поражать как сосуды, так и напрямую нервную ткань. Примером является ITM2B-ассоциированная церебральная амилоидная ангиопатия 1-го типа (британский) и 2-го типа (датский). Болезнь Альцгеймера очень гетерогенна в генетическом плане: на данный момент выделено 19 форм. Разные формы связаны с разными генами, но существует большой список генов восприимчивости с модифицирующим эффектом.
Пересечение деменции и бокового амиотрофического склероза – новый аспект данной проблемы. Мутация в гене TRPM7 (OMIM: 605692), кодирующем белок – представитель семейства транзиторных рецепторов потенциал-ассоциированных катионных каналов, влияет на восприимчивость к комплексу бокового амиотрофического склероза, паркинсонизма и деменции. Группа заболеваний, получившая название лобно-височной деменции и/или бокового амиотрофического склероза, в настоящее время состоит из 4 форм. Эти заболевания с формально аутосомно-доминантным наследованием связаны с разными генами, картированными в разных местах. Важно, что 1-й тип ассоциирован с нарушением экспансии гексануклеотида GGGGCC в некодирующей области гена C9ORF72 (OMIM: 614260). Данный факт иллюстрирует эпигенетические механизмы когнитивных нарушений [8].
При патологии брахиоцефальных артерий клинические симптомы УКР полиморфны и проявляются различными нарушениями памяти, расстройством обобщения понятий, возникновением апатий, которые могут сочетаться с депрессией, а также характеризуются быстрой истощаемостью когнитивных функций. Диагностика УКР основывается на жалобах пациента, таких как нарушение памяти по типу тормозимости следов, значительное снижение работоспособности, а также на данных нейропсихологического исследования. Однако на сегодняшний день не существует общепринятой методики диагностики УКР, поэтому разработка диагностического алгоритма, включающего нейровизуализационную объективизацию сосудистых повреждений с использованием стандартных шкал у пациентов с симптомами УКР, существенно повысит точность ранней диагностики и приведет к снижению потенциального риска развития деменции.
A. Takaiwa и соавт. (2018) указывают на возможность оценки минимальных когнитивных нарушений у пациентов с каротидным стенозом при анализировании расхождений между тестами на кристаллизованный и текучий интеллект [9]. V.L. Gray и соавт. (2019) связывают ухудшение координации, мобильности и другие когнитивные нарушения у пожилых пациентов при гемодинамически незначимом стенозе сонных артерий с перекрытием просвета от 50% и более [4]. Есть публикации, показывающие связь уменьшения объема серого вещества кортикального слоя и возникновения когнитивных нарушений, выявляемых при проведении тестов на внимание, память, языковые функции, исполнительную работу [10, 11]. В нескольких исследованиях отмечены уменьшение толщины моторных отделов коры у пациентов со стенозом сонной артерии ≥80% и асимметрия толщины кортикального слоя на стороне стеноза при одностороннем поражении [12]. Однако, по данным A. Nickel и соавт. (2019), при обследовании 25 пациентов со стенозом сонной артерии без ишемических поражений головного мозга не наблюдалось ни достоверно значимого уменьшения толщины коры, ни связи толщины коры с когнитивными функциями, хотя у пациентов в когнитивных тестах показатели были хуже, чем у здоровых пациентов из контрольной группы. По мнению авторов, полученные данные не подтверждают гипотетическую связь истончения коры и когнитивных нарушений при стенозе сонных артерий; напротив, результаты демонстрировали устойчивость структуры мозга к хроническим изменениям церебральной перфузии при отсутствии очаговых поражений [13].
D.C. Jackson и соавт. (2015) оценили влияние выраженного атеросклеротического поражения на когнитивные функции у пациентов с острым нарушением мозгового кровообращения (ОНМК) или транзиторной ишемической атакой (ТИА) в анамнезе и без них. Как у симптомных, так и у бессимптомных пациентов с бляшками сонных артерий со стенозом более 60% были выявлены когнитивные нарушения по сравнению с пациентами контрольной группы того же возраста, что позволяет предположить, что термин «бессимптомный» в отношении пациентов с крупными бляшками сонных артерий без явных сосудистых событий (ОНМК, ТИА) может быть ошибочным. У симптомных и бессимптомных пациентов были обнаружены задержка речевого вызова, дефицит исполнительной функции и общих знаний. Пациенты с симптомами инсульта в анамнезе также показали худшие результаты на языковых, двигательных и зрительно-моторных тестах. Симптоматические и бессимптомные пациенты различались по рабочей памяти и выполнению языковых заданий. Хотя у всех пациентов отмечался дефицит исполнительной функции и памяти, только у пациентов с симптомами наблюдался дополнительный дефицит языка и двигательной функции [14].
У пациентов с бессимптомным стенозом в большинстве случаев определяется хроническая гипоперфузия головного мозга, достоверно ведущая к когнитивным нарушениям [15]. По данным B.K. Lal и соавт. (2017), от 40% до 50% пожилых людей с асимптомным каротидным стенозом имеют когнитивную дисфункцию, связанную с гипоперфузией головного мозга [3]. T. Wang и соавт. (2016) упоминают о возможности возникновения как ишемических, так и геморрагических немых микроинсультов даже при бессимптомном течении, выявляемых у 15–19% пациентов [16]. Помимо гипоперфузии и немого микроинсульта, некоторые исследования показали связь ухудшения когнитивных функций у пациентов с бессимптомным стенозом и нарушения цереброваскулярной реактивности [17], регионарной функциональной связности [18, 19]. Нарушения когнитивных функций у пациентов, считающихся «бессимптомными», подчеркивают необходимость раннего выявления и лечения.
Цель исследования: изучить ранние перфузионные нарушения головного мозга и их взаимосвязь с когнитивными функциями у пациентов с асимптомным атеросклеротическим поражением внутренних сонных артерий более 60% и без таковых.
Материалы и методы исследования. Проведено открытое одноцентровое контролируемое исследование перфузии головного мозга и состояния когнитивной функции у пациентов, страдающих хронической ишемией мозга (ХИМ) с атеросклеротическими стенозами ВСА, не проявляющимися очаговой неврологической симптоматикой (асимптомные стенозы), и без таковых. Исследование было выполнено в соответствии с принципами надлежащей клинической практики и Хельсинкской декларации. В исследование вошел 31 пациент (12 мужчин и 19 женщин), средний возраст 69±5,4 года; пациенты были разделены на две группы: группа 1 – 19 больных со стенозами ВСА с одной и/или двух сторон (стеноз 60% и более, у 2 пациентов окклюзия); группа 2 (контроль) – 12 пациентов без гемодинамически значимых стенозов ВСА. Учитывались жалобы пациентов, когнитивные функции (по Монреальской шкале оценки когнитивных функций (MOCA) и краткой шкале оценки психического статуса (MMSE)) и состояние перфузии головного мозга по данным позитронно-эмиссионной томографии (ПЭТ) с 13N-аммонием. При оценке данных по Монреальской шкале оценки когнитивных функций максимальное количество баллов составляет 30. В норме количество баллов – 26 и выше. По данным Краткой шкалы оценки психического статуса: 28–30 баллов – нет нарушений когнитивных функций; 24–27 баллов – преддементные когнитивные нарушения; 20–23 балла – деменция легкой степени выраженности; 11–19 баллов – деменция умеренной степени выраженности; 0–10 баллов – тяжелая деменция. Для полноценной оценки мозгового кровотока, изучения гемодинамического резерва, адаптационных механизмов проводились нагрузочные фармакологические пробы с аденозинтрифосфатом (АТФ). АТФ вызывает эндотелиально-зависимую релаксацию гладкой мускулатуры, что приводит к расширению «нормальных» сегментов артерий, в которых эндотелий не отделен от мышечной оболочки атеросклеротическими бляшками, т.е. аденозин вызывает неравномерность мозгового кровотока, что способствует максимальному выявлению зон гипоперфузии.
Для оценки уровня перфузии использовался полуколичественный анализ изображений. Выполнялось определение региональной радиоактивности, нормализованной какой-либо внутренней референтной зоне. При этом референтом выступала контралатеральная область головного мозга. Асимметрия накопления радиофармпрепарата (так называемый индекс асимметрии) в пределах 12–15% (по данным разных авторов) считается физиологической, выше указанных значений — патологической. Индекс асимметрии рассчитывался в покое при пробе с нагрузкой. Степень нарушения перфузии головного мозга оценивали по индексу межполушарной асимметрии и проценту снижения перфузии головного мозга на фоне фармакологической пробы по сравнению с исследованием в покое.
Пространственная нормализация имела функциональный характер, использовались пакеты программного обеспечения SPM (Statisticparametric mapping, статистическое параметрическое картирование).
Результаты исследования и их обсуждение. 28 из 31 пациента предъявляли жалобы на: головокружение – 15 (53%), постепенное снижение памяти – 6 (21%), головную боль – 11 (39%) и шум в ушах – 7 (25%). Значимой разницы между группами пациентов (со стенозами и без таковых) по данному критерию выявлено не было. В неврологическом статусе пациентов с хронической ишемий головного мозга отмечались: рефлекторная асимметрия, кистевые и стопные патологические знаки, элементы динамической и статико-локомоторной атаксии, без значимой разницы в группах больных с асимптомными каротидными стенозами и без таковых.
По данным ПЭТ, снижение перфузии головного мозга наблюдалось уже в покое у 2 (16,7%) пациентов с ХИМ без стенозов и у 6 (31,6%) пациентов с ХИМ и стенозами (рис. 1, 2), т.е. каждый третий пациент со стенозом ВСА в нашем исследовании имел значимое снижение перфузии в определенных зонах головного мозга, что вдвое превышает такой показатель у пациентов с ХИМ без стенозов. В обеих группах (без значимой разницы) чаще всего выявлялось снижение перфузии в теменной доле, чаще в сенсомоторной коре (37,5%), первичной зрительной коре (50%), поясных извилинах (50%).
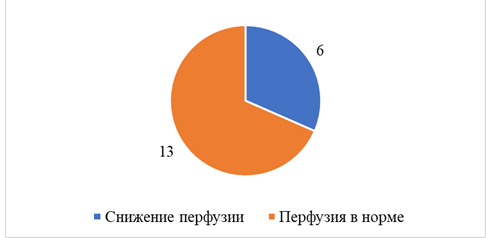
Рис. 1. Состояние перфузии головного мозга у пациентов с ХИМ
и стенозами ВСА более 60%
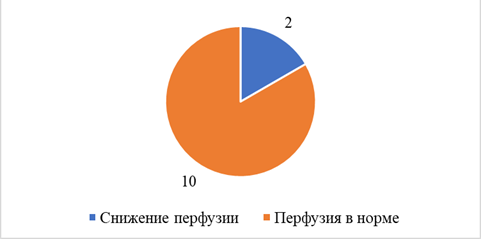
Рис. 2. Состояние перфузии головного мозга у пациентов с ХИМ без стенозов ВСА
При проведении нагрузочной фармакологической пробы с АТФ было выявлено значимое снижение перфузии головного мозга у 14 (74%) пациентов в группе каротидного атеросклероза и у 7 (58,3%) больных без стенозирующего процесса ВСА (рис. 3, 4).
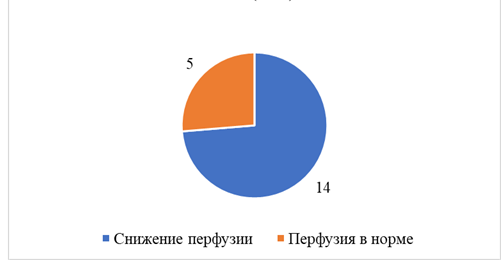
Рис. 3. Состояние перфузии головного мозга у пациентов с ХИМ и стенозами ВСА более 60% при выполнении нагрузочной пробы с АТФ
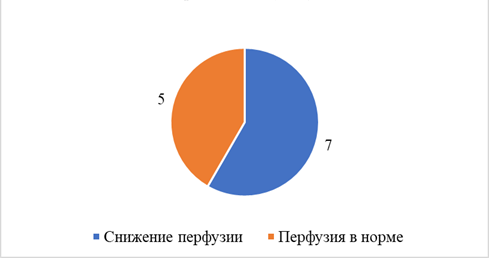
Рис. 4. Состояние перфузии головного мозга у пациентов с ХИМ без стенозов ВСА при выполнении нагрузочной пробы с АТФ
Важным показателем риска развития острого нарушения мозгового кровообращения и/или сосудистой деменции является сохранность гемодинамического резерва, которая обеспечивает функциональную устойчивость системы мозгового кровообращения. При изучении гемодинамического резерва с помощью пробы с АТФ были получены данные о значимом его снижении в группах пациентов с ХИМ, более грубом у пациентов с атеросклеротическим поражением ВСА, что является предиктором неблагополучия церебральной гемодинамики. В целом в группе пациентов с ХИМ (31 больной) только у 9 пациентов показатели перфузии были в переделах нормальных значений в покое и не претерпевали изменений при фармакологической пробе.
По данным шкал MMSE и MOCA у 16 из 31 пациента с хронической ишемией головного мозга при исследовании когнитивных функций были обнаружены преддементные нарушения (средний балл составил 25±1), у 8 пациентов была выявлена деменция легкой степени тяжести (средний балл составил 21±1), у 7 пациентов отмечалась деменция умеренной степени выраженности (средний балл составил 14±2).
При изучении взаимосвязи наличия и выраженности когнитивных нарушений у пациентов с ХИМ со стенозами ВСА более 60% и без таковых не было выявлено отличий по количеству пациентов с легкой степенью деменции, преддементными нарушениями, легкой лобной дисфункции, отмечена тенденция к преобладанию деменции умеренной степени тяжести в группе пациентов без значимых стенозов ВСА (рис. 5, 6).
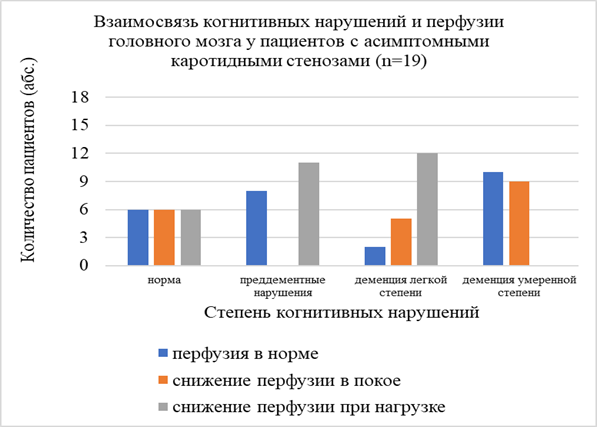
Рис. 5. Взаимосвязь когнитивных нарушений и состояния перфузии головного мозга у пациентов с асимптомными каротидными стенозами
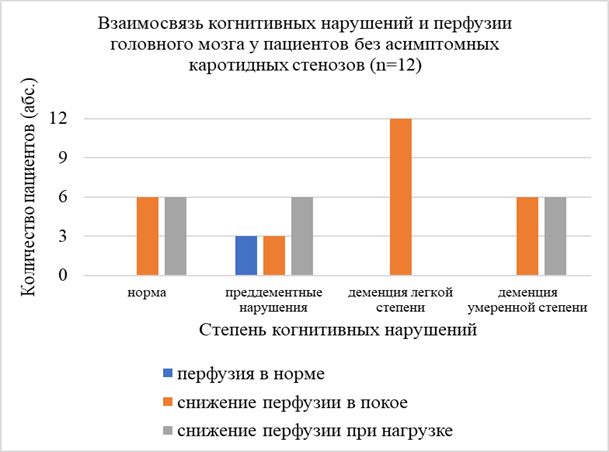
Рис. 6. Взаимосвязь когнитивных нарушений и состояния перфузии головного мозга у пациентов без каротидных стенозов
При анализе выраженности и распространенности когнитивных нарушений в зависимости от состояния церебральной перфузии не было отмечено значимой связи когнитивной дисфункции и показателей перфузии головного мозга (норма, снижение в покое, снижение при проведении нагрузочной пробы с АТФ).
Заключение. У пациентов с хронической ишемией головного мозга в раннюю, доклиническую стадию выявляются когнитивные нарушения разной степени выраженности, снижение перфузии головного мозга. Возможности ПЭТ позволили не только говорить о снижении кровотока в определенных зонах, но и изучать гемодинамический резерв головного мозга, под которым понимается уровень реактивности мозговых сосудов, определяющий их способность к дополнительному увеличению кровотока. Данный показатель свидетельствует о реактивности мозговых сосудов, обеспечивающих функциональную устойчивость системы мозгового кровообращения при диффузном поражении, и значимом нарушении кровотока при стенозе магистральных артерий шеи. Так, пациенты со стенозами ВСА оказались наиболее уязвимой к фармакологической нагрузке группой, здесь у ¾ пациентов выявились обширное снижение перфузии (у всех пациентов были задействованы 2 и более зоны мозга).
У большинства пациентов с бессимптомным течением хронической ишемии мозга выявляются клинические симптомы и когнитивные нарушения (преддементные нарушения, легкая степень деменции, умеренная степень деменции) без четкой взаимосвязи с состоянием перфузии головного мозга и степенью атеросклеротического поражения ВСА. Это, возможно, объясняется тем, что гемодинамически значимый асимптомный каротидный стеноз влияет преимущественно на нижний уровень функциональной иерархии. Когнитивные системы, расположенные иерархически выше, менее подвержены влиянию атеросклероз-опосредованных изменений гемодинамики, однако их нарушение может предшествовать развитию сосудистой деменции.
Расширение представления о взаимосвязи и выраженности перфузионных и когнитивных нарушений у пациентов с асимптомным течением атеросклеротического процесса сонных артерий необходимо для выявления групп риска и своевременной профилактики (например, реконструктивной хирургии на внутренней сонной артерии) острого нарушения мозгового кровообращения и/или сосудистой деменции.
Список сокращений
АТФ – аденозинтрифосфат
ВСА – внутренняя сонная артерия
ОНМК – острое нарушение мозгового кровообращения
ПЭТ – позитронно-эмиссионная томография
ТИА – транзиторная ишемическая атака
УКР – умеренные когнитивные нарушения
ХИМ – хроническая ишемия мозга.
MMSE – Mini-Mental State Examination
MOCA – Montreal Cognitive Assessment
SPM – Statisticparametric mapping
Библиографическая ссылка
Поспелова М.Л., Алексеева Т.М., Рыжкова Д.В., Ефимова М.Ю., Лепёхина А.С., Герасимов А.П., Иванова Н.Е. СОСТОЯНИЕ КОГНИТИВНЫХ ФУНКЦИЙ И ПЕРФУЗИИ ГОЛОВНОГО МОЗГА ПРИ ХРОНИЧЕСКОЙ ИШЕМИИ МОЗГА НА ФОНЕ АСИМПТОМНОГО КАРОТИДНОГО АТЕРОСКЛЕРОЗА // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30446 (дата обращения: 23.04.2024).



