Рак молочной железы в настоящее время является одной из важнейших медико-социальных проблем в России, занимая первое место в структуре женской онкологической заболеваемости (20,9% от общей онкологической заболеваемости женщин, что составляет до 96,2 на 100 тыс. человек в год) и смертности, при этом значительная часть пациенток относится к женщинам трудоспособного возраста [1]. Одним из основных методов лечения рака молочной железы является радикальная (тотальная) мастэктомия, заключающаяся в удалении молочной железы, окружающей жировой клетчатки и лимфатических узлов, а также, в зависимости от варианта мастэктомии, удалении большой и/или малой грудной мышц. Тотальная мастэктомия – калечащая операция, часто приводящая к развитию симптомокомплекса органических и функциональных осложнений, получившего название постмастэктомического синдрома (ПМЭС). По данным литературы, частота встречаемости ПМЭС как осложнения в позднем послеоперационном периоде после тотальной мастэктомии варьирует от 24% до 90% [2, 3]. Современная концепция ПМЭС определяет его как совокупность нарушений со стороны лимфатической, сердечно-сосудистой, опорно-двигательной и нервной систем, патогенез которых обусловлен местными фиброзно-рубцовыми и атрофическими изменениями тканей на стороне оперативного лечения, а также нарушениями со стороны периферической и центральной нервной системы.
Выделяют несколько клинических вариантов ПМЭС, которые могут встречаться как изолированно, так и в различных сочетаниях: отечный, нейропатический, церебральный, патобиомеханический и смешанный варианты [3]. В настоящее время считается, что наиболее часто ПМЭС проявляется в смешанном варианте, при котором наблюдается сочетание симптомов со стороны различных систем организма. Все больше внимания уделяется психоневрологическим нарушениям, возникающим после тотальной мастэктомии, которые приводят к резкому ухудшению качества жизни пациенток в послеоперационном периоде.
Одним из самых перспективных способов оценки функциональных нарушений головного мозга при ПМЭС является функциональная МРТ (фМРТ) – методика, основанная на режиме BOLD («blood oxygenation level dependent»), позволяющем определить активацию различных зон головного мозга на основании гемодинамических изменений, возникающих в ответ на предъявление того или иного стимула или в покое. Наиболее распространенным вариантом фМРТ является выполнение ее в состоянии покоя (resting state fMRI, фМРТ покоя), что позволяет оценить функциональную связность (коннективность) различных областей головного мозга, составляющих так называемые нейронные сети покоя [4]. Среди нейронных сетей покоя особое значение имеет так называемая default mode network, или сеть пассивного режима работы мозга (СПРРМ), в состав которой входят обширные зоны медиальной префронатальной коры (МПФК), кора задней части поясной извилины и предклинье. СПРРМ представляет собой динамическую систему, которая связана с различными областями головного мозга, и выполняет множество функций, участвуя в когнитивных процессах памяти, внимания, регуляции эмоций; доказана роль ее функциональных нарушений в патогенезе многих неврологических и психических заболеваний, а также хронического болевого синдрома [5].
Несмотря на ключевую роль фМРТ покоя в современных исследованиях функциональных нарушений головного мозга при различных заболеваниях, возможности ее применения с целью оценки и прогнозирования изменений со стороны центральной нервной системы при ПМЭС остаются недостаточно изученными. В зарубежной литературе встречается ряд работ, посвященных изучению изменений функциональной активности рабочих сетей покоя головного мозга у пациенток на фоне химиотерапевтического и лучевого лечения, которые показали повышенную уязвимость нейросетей пациенток с раком молочной железы в отношении развития нейродегенеративных процессов в будущем [6]. Недостатком этих исследований является отсутствие внимания к наличию изначальных изменений в активности рабочих сетей у пациенток до адъювантной терапии. В единичных исследованиях, посвященных изучению рабочих сетей головного мозга, показаны изменения функциональной активности в префронтальной и поясной коре по данным фМРТ у пациенток с диагностированной депрессией в позднем послеоперационном периоде после тотальной мастэктомии [7]. Таким образом, применение фМРТ покоя у пациенток с ПМЭС требует дальнейшего изучения, так как данный метод имеет большие перспективы в качестве современного инструмента, позволяющего прогнозировать и выявлять изменения работы СПРРМ у данной категории больных с целью предикции развития неврологических проявлений ПМЭС, осуществления индивидуального подхода при проведении лечебно-реабилитационных мероприятий и оценки их эффективности в послеоперационном периоде после тотальной мастэктомии.
Цель исследования – изучение особенностей функциональной реорганизации нейронных сетей головного мозга у пациенток с ПМЭС с применением метода фМРТ в состоянии покоя.
Материалы и методы исследования
Проведено открытое одноцентровое контролируемое исследование функциональной связанности нейронных сетей головного мозга у пациенток с ПМЭС. В исследование вошли 20 пациенток с ПМЭС и 20 здоровых женщин-добровольцев. Средний возраст пациенток составил 46,0±4,8 года (от 32 до 50 лет), средний возраст здоровых женщин-добровольцев – 40,0±7,2 года (от 27 до 42 лет). Все пациентки находились в позднем послеоперационном периоде (>6 месяцев) после тотальной мастэктомии (одно- или двусторонней) по поводу рака молочной железы.
У всех участвующих пациенток был проведен осмотр невролога, сбор анамнеза (дата операции, наличие химиотерапии, лучевой терапии) и жалоб (на отек верхней конечности на стороне оперативного лечения, нарушения чувствительности верхней конечности, парестезии, мышечную слабость, ограничение движения в плечевом суставе, болевой синдром в верхней конечности и надплечье, головные боли, головокружения, нарушения сна). Во время осмотра производились оценка подвижности в плечевом суставе, проба Адсона, используемая для оценки синдрома верхней апертуры грудной клетки и заключающаяся в пальпации пульса на правой и левой лучевой артерии при повороте головы вправо и влево с одновременным глубоким вдохом, кистевая динамометрия для оценки силы кистей рук с двух сторон. Осуществлялось сравнительное измерение окружности рук в 5 точках для оценки отека.
Проводились комплексная МРТ головного мозга, включавшая традиционный протокол МРТ в 3 взаимно перпендикулярных плоскостях (с использованием стандартных импульсных последовательностей Т1-, Т2-, TIRM, MPRAGE), а также фМРТ в состоянии покоя (последовательность BOLD), направленная на визуализацию функциональной активности нейронных сетей головного мозга в состоянии покоя. Исследование проводилось на МР-томографе Siemens Magnetom Trio A Tim 3,0 Т.
Все пациентки подписывали информированное согласие. Исследование выполнено с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации c согласия Этического комитета ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России (заключение от 31.10.2019).
Статистическая обработка и оценка результатов данных фМРТ покоя осуществлялись с использованием программного пакета CONN v.18 (Functional connectivity toolbox), который позволяет провести статистическое картирование зон активации, определить структурные особенности сетей покоя и осуществить индивидуальный и межгрупповой анализ СПРРМ. В исследовании использовали анализ roi-to-roi и seed-to-voxel на основе выбора зоны интереса.
Результаты исследования и их обсуждение
У всех пациенток отмечались те или иные клинические проявления ПМЭС: отек верхней конечности на стороне оперативного лечения (n=18, 90%), нарушения чувствительности верхней конечности (n=12, 60%), парестезии (n=11, 55%), мышечная слабость (n=14, 70%), ограничение движения в плечевом суставе (n=8, 40%), болевой синдром в верхней конечности (n=12, 60%) и надплечье (n=9, 45%), головные боли (n=11, 55%), головокружения (n=4, 20%), нарушения сна (n=5, 25%). При выполнении функциональных проб положительная проба Адсона была выявлена у 12 пациенток (60%). У 14 из 20 пациенток (70%) отмечалось снижение силы кисти на стороне оперативного лечения при выполнении кистевой динамометрии.
В исследовании анализировали изменения функциональных связей МПФК с другими отделами головного мозга. Выбор МПФК в качестве ключевой точки в исследовании обусловлен ее значением как одного из центральных звеньев СПРРМ. МПФК связывает обширные зоны, включающие орбитофронтальную кору и такие структуры, как центральное серое вещество среднего мозга, миндалевидное тело и гипоталамус, при этом играя важную связующую роль в передаче соматосенсорной информации в структуры, которые отвечают за моторные и висцеральные реакции, участвуя в системе внутреннего «вознаграждения» (reward system) и отвечая за принятие решений.
По результатам исследования данных фМРТ в покое у пациенток с ПМЭС (20 пациенток), в отличие от группы здоровых женщин-добровольцев (20 человек) того же возраста, определялись значимые изменения функциональной коннективности головного мозга при выполнении межгруппового статистического анализа (p<0,005) (two-sample t-test, seed-to-voxel). В таблице 1 представлен результат межгруппового сравнения, который демонстрирует изменения функциональной коннективности между различными областями ЦНС у пациенток с ПМЭС.
Таблица 1
Межгрупповой анализ данных фМРТ покоя пациенток с ПМЭС в сравнении со здоровыми женщинами-добровольцами
|
Рабочая сеть покоя: медиальная префронтальная кора |
|
|
Область исследования |
Статистический показатель, Т |
|
Гиппокамп, правый |
–4,71 |
|
Гиппокамп, левый |
–4,58 |
|
Субкаллезная кора |
–5,36 |
|
Мозжечок |
–2,16 |
|
Средняя височная извилина (передние отделы), правая |
–2,96 |
|
Средняя височная извилина (передние отделы), левая |
–4,94 |
|
Правый таламус (медиальные ядра) |
–2,85 |
|
Левый таламус (медиальные ядра) |
–4,02 |
Отмечалось угасание функциональной связанности МПФК с другими структурами СПРРМ. Наблюдались значимое уменьшение числа функциональных связей между МПФК и гиппокампом (с двух сторон), мозжечком, субкаллезной корой, билатеральное ослабление связей со средней височной извилиной и медиальными ядрами таламуса у пациенток с ПМЭС в сравнении с контрольной группой.
У пациенток происходила функциональная реорганизация нейронных сетей с вовлечением СПРР с преобладанием процессов разобщения внутри- и межполушарных связей, т.е. значимо нарастали процессы дезорганизации и нейродегенерации (р<0,001) (рисунок).
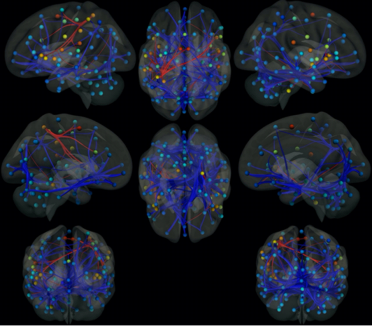
Результаты межгруппового анализа фМРТ в покое группы пациенток с ПМЭС и здоровых женщин-добровольцев того же возраста. Схематические данные, полученные путем анализа графов. Красным цветом отмечены значимые положительные (усиление) функциональные связи, синим – значимые отрицательные (угасание, реорганизация)
Функциональные связи между МПФК и гиппокампом обеспечивают формирование комплексных механизмов долговременной памяти, включая так называемую рабочую память, необходимую для процесса принятия решений [8]. Снижение функциональной коннективности между МПФК и гиппокампом может являться предиктором начальных когнитивных нарушений у пациенток, которые могут быть связаны с различными патофизиологическими механизмами.
Средняя височная извилина представляет собой важный центр, участвующий в таких сложных когнитивных процессах, как целенаправленное внимание, распознавание лиц, семантическая память, также доказано ее участие в языковых процессах [9]. Кроме того, центры средней височной извилины благодаря функциональным связям с гиппокампом вовлечены в регуляцию механизмов долговременной памяти. Ослабление функциональной коннективности между средней височной извилиной и МПФК может указывать на начальное снижение когнитивных функций, таких как долговременная память и внимание. По данным последних исследований была также выявлена связь между нарушениями коннективности в системе МПФК – средняя височная извилина и развитием депрессивных расстройств [10].
Субкаллезная поясная кора (поле Бродмана 25) играет важную роль в патофизиологии депрессивных расстройств. В современных исследованиях показано, что гиперактивация в данной области является одной из возможных нейрофизиологических причин развития депрессии. В нейровизуализационных исследованиях депрессии субкаллезная поясная кора характеризовалась более высокой коннективностью с орбитофронтальной корой и отрицательными связями с МПФК [11], и данные функциональные связи были вовлечены в так называемую систему отсутствия вознаграждения, которая является ключевым звеном развития депрессивной симптоматики. Таким образом, нарушение функциональной коннективности между МПФК и субкаллезной корой может свидетельствовать о дисбалансе нормальной регуляции в системе вознаграждения, что приводит к развитию симптомов депрессии [12].
Функциональные связи между медиальными ядрами таламуса и МПФК принимают участие во многих нейрофизиологических процессах. В физиологических условиях активация медиального таламуса и увеличение функциональных связей между таламусом и МПФК влияют на улучшение рабочей памяти. Так как таламус является ключевым связующим звеном в восприятии болевых стимулов, то этот механизм может служить для преобразования болезненного стимула в кратковременно поддерживаемую в памяти «конструкцию», чтобы направлять поведение человека и избегать опасных ситуаций [13]. Однако при патологических состояниях происходит нарушение нормального распределения функциональных связей между медиальным таламусом и МПФК, что может быть фактором, способствующим развитию хронической боли [14].
Несмотря на общее представление о мозжечке как структуре, не имеющей значительной вовлеченности в сеть пассивного режима работы мозга (СПРР), в настоящее время существует ряд исследований, показывающих роль мозжечка в ряде высших когнитивных процессов благодаря обширным связям с различными областями префронтальной коры [15]. Поэтому снижение функциональных связей между мозжечком и МПФК может свидетельствовать в целом о снижении активности в СПРР.
Выводы
Полученные результаты фМРТ покоя у пациенток с ПМЭС свидетельствуют о реорганизации СПРР со снижением общей коннективности, а также уменьшением числа функциональных связей МПФК с важнейшими зонами головного мозга, участвующими в регуляции когнитивных процессов памяти, внимания, эмоций. Полученные результаты требуют дальнейшего обсуждения и изучения в контексте их корреляции с клиническими данными и результатами других исследований.
Список сокращений:
МПФК – медиальная префронтальная кора
ПМЭС – постмастэктомический синдром
СПРРМ – сеть пассивного режима работы мозга
фМРТ – функциональная магнитно-резонансная томография
Работа поддержана грантом Минобрнауки РФ 075-15-2020-901 на создание и развитие научных центров мирового уровня
Библиографическая ссылка
Буккиева Т.А., Поспелова М.Л., Ефимцев А.Ю., Фионик О.В., Алексеева Т.М., Труфанов Г.Е., Самочерных К.А., Иванова Н.Е., Красникова В.В., Горбунова Е.А., Левчук А.Г. ФУНКЦИОНАЛЬНАЯ РЕОРГАНИЗАЦИЯ НЕЙРОННЫХ СЕТЕЙ ГОЛОВНОГО МОЗГА У ПАЦИЕНТОК С ПОСТМАСТЭКТОМИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30448 (дата обращения: 25.04.2024).



