Одним из ключевых компонентов гемостаза являются тромбоциты. Эти кровяные безъядерные дисковидные пластинки постоянно секретируют в кровяное русло содержимое своих гранул и, несмотря на небольшой размер, являются одним из главных участников процесса гемостаза [1]. Основными функциями тромбоцитов служат остановка кровотечения посредством образования тромбоцитарного тромба в месте повреждения сосуда, а также участие в образовании фибрина [2, 3]. Тромбоциты являются постклеточными структурами, которые активируются при воздействии агонистов, таких как тромбин, арахидоновая кислота, аденозиндифосфат (АДФ) или коллаген [4]. Когда агонист связывается с рецептором на поверхности тромбоцитов, происходит перестройка цитоскелета, что является необходимым условием для агрегации кровяных пластинок и образования тромбов [5]. Изменение функциональных свойств тромбоцитов имеет важное значение в патогенезе ишемической болезни сердца и нарушений мозгового кровообращения, обусловленных тромботическим повреждением сосудов. В связи с этим актуальными являются исследование и систематизация механизмов регуляции тромбоцитарного звена гемостаза.
Активность тромбоцитов определяется воздействием разного рода гуморальных факторов. Эндотелиальные клетки продуцируют ингибиторы, которые контролируют количество тромбоцитов в области повреждения сосуда. Особое влияние на тромбоциты и непосредственно на процесс гемостаза оказывает оксид азота (NO). Известно, что NO ингибирует адгезию тромбоцитов к эндотелию и их последующую агрегацию, а также обладает рядом эффектов, которые приводят к вазорелаксации, эндотелиальной регенерации и ингибированию хемотаксиса лейкоцитов [6, 7]. Известно, что особенности влияния NO на функциональные свойства тромбоциты in vitro определяются концентрацией донатора в культуральной среде [8]. В нашей лаборатории было показано, что инкубация с нитропруссидом натрия, который является экзогенным донатором NO, в конечной концентрации 100 мкмоль/л приводит к снижению агрегационной способности тромбоцитов, что может свидетельствовать об угнетении их активности [9]. Кроме того, присутствие нитропруссида натрия в этой концентрации приводит к структурно-функциональным изменениям тромбоцитов и снижению их осмотической стойкости, что проявляется ускоренной гибелью кровяных пластинок, поврежденных метаболитами NO, в гипотонической среде [10].
Цель исследования – выявление особенностей влияния нитропруссида натрия в концентрации 1000 мкмоль/л на морфологические характеристики и осмотическую стойкость тромбоцитов in vitro у крыс.
Материал и методы исследования
В экспериментах in vitro использовано 10 беспородных крыс-самцов весом 200–220 г. Работа проводилась в соответствии с этическими правилами экспериментов с животными («Правила лабораторной практики в Российской Федерации» приказ МЗ и СР РФ № 708н от 23.08.2010 г.). После эвтаназии, осуществляемой посредством цервикальной дислокации, и торакотомии производили забор крови из левого желудочка сердца. Цитратную кровь (соотношение 9:1) центрифугировали 10 мин при 1500 об/мин для получения богатой тромбоцитами плазмы (центрифуга ОПН-3, Россия). Затем из обогащенной тромбоцитами плазмы отбирали 2 порции по 0,5 мл. К первой порции тромбоцитарной суспензии в качестве экзогенного донатора оксида азота добавляли 0,1 мл раствора нитропруссида натрия (НПН) с конечной концентрацией в инкубационной среде 1000 мкмоль/л. В качестве контроля использовали суспензию тромбоцитов, в которую добавляли такое же количество 0,9%-ного раствора NaCl. Обе пробирки подвергали инкубации в термостате (термостат ТВ-80-1, Россия) при температуре 37ºC в течение 15 мин. Для морфологического анализа мазки суспензии тромбоцитов окрашивали азур-2-эозином по Романовскому и делали микрофотографии с применением иммерсионного объектива (микроскоп «Ломо Микмедво-1», Россия). Фотографии обрабатывали посредством компьютерной цитоморфометрии с использованием GNU Image Manipulation Program (GIMP 2.10.14, США). Определяли большой и малый диаметр тромбоцитов (рис. 1), их площадь и индекс элонгации. В препарате подсчитывалось количество тромбоцитов с грануломером. На основании анализа преобладания красного или синего цветов спектра в окрашенном препарате производили расчет индекса омоложения тромбоцитов (ИОТр), показывающего соотношение количества «молодых» и «старых» кровяных пластинок.
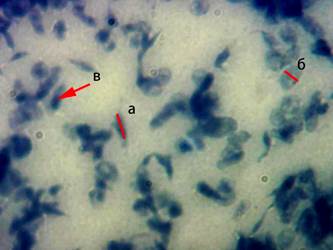
Рис. 1. Микрофотография мазка тромбоцитарной суспензии (окраска азур-2-эозином по Романовскому, увеличение – х1000); а – длина тромбоцита, б – ширина тромбоцита, в – тромбоцит с грануломером
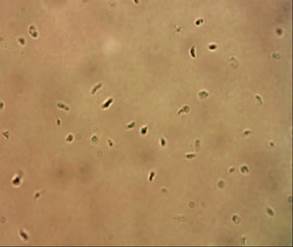
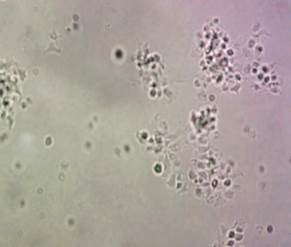
При используемом способе окраски гранулы кровяных пластинок приобретают фиолетово-красный цвет, благодаря чему возможно оценить степень зрелости тромбоцитов в зависимости от интенсивности красного или синего цвета. Повышение доли синего по отношению к остальным цветам свидетельствует об увеличении количества «молодых» форм. Увеличение доли красного цвета характеризует преобладание в препарате «старых» тромбоцитов. О функциональной активности тромбоцитов можно судить по степени насыщенности их гранулами, от которой зависит удельная оптическая плотность кровяных пластинок. Для исследования осмотической резистентности тромбоцитов использовали «гипотонический шок», который воспроизводили разведением тромбоцитарной суспензии дистиллированной водой в соотношении 1:1. Конечная концентрация раствора по осмотическому давлению соответствовала 0,45%-ному раствору NaCl. Готовили препараты «раздавленная капля» и фотографировали их сразу после добавления дистиллированной воды, а также через 5, 10 и 20 мин воздействия. Фотографии препаратов, полученных с помощью оптической микроскопии (микроскоп «Ломо Микмедво-1», Россия), исследовали с использованием программы GIMP 2.10.14. Осмотическую стойкость тромбоцитов оценивали по изменению количества, размеров и формы свободных кровяных пластинок (рис. 2а), а также количества и размеров их агрегатов в препарате (рис. 2б). Определяли длину, ширину, площадь и индекс элонгации тромбоцитов (ИЭТ). ИЭТ = (L-W)/(L+W), где L – длина, W – ширина тромбоцита.
|
|
|
|
а |
б |
Рис. 2. Суспензия тромбоцитов (неокрашенный препарат «раздавленная капля», ув. х1000): а – единичные тромбоциты в физиологическом растворе, б – агрегаты тромбоцитов в гипотонической среде (20 мин экспозиции)
Статистический анализ полученных результатов производили с использованием программы Statistica (StatSoft, США) и электронных таблиц Excel. Для оценки нормальности распределения использовали критерий Шапиро–Уилка. Рассчитывали среднее арифметическое, среднее квадратическое отклонение, ошибку среднего. Различия считали статистически значимыми при p≤0,05.
Результаты исследования и их обсуждение
Морфологический анализ мазков тромбоцитарной суспензии показал, что ИОТр достоверно меньше в препаратах тромбоцитов, инкубированных с НПН, и составляет 1,20±0,07 по сравнению с 1,59±0,05 в контроле (p=0,0017) (рис. 3). Это указывает на снижение количества «молодых» форм, уменьшение функциональной активности тромбоцитов и, как следствие, угнетение тромбоцитарного компонента гемостаза [9]. Длина, ширина и площадь тромбоцитов, инкубированных с НПН, составляют 3,7±0,18 мкм, 1,85±0,07 мкм, 5,42±0,43 мкм2 соответственно, что достоверно меньше, чем в контроле (4,61±0,13 мкм (p=0,0028), 2,5±0,15 мкм (p=0,0053), 9,09±0,67 мкм2 (p=0,0015) соответственно). Это может быть обусловлено образованием более мелких кровяных пластинок при их разрушении в результате повреждающего влияния производных оксида азота. Однако уменьшение морфометрических показателей сопровождается снижением количества тромбоцитов с грануломером в опытных препаратах до 48,0±2,58 по сравнению с 61,14±1,75 в контроле (p=0,0025), что может свидетельствовать о более низкой функциональной активности кровяных пластинок. При активации тромбоцитов увеличивается проницаемость мембраны для ионов калия, хлора и кальция [11]. Благодаря поступлению кальция в цитоплазму активируются кальцийзависимые процессы, преобразуется структура сократительных белков цитоплазматической сети и происходит увеличение размеров тромбоцитов с последующим образованием псевдоподий и необратимой агрегацией [12].
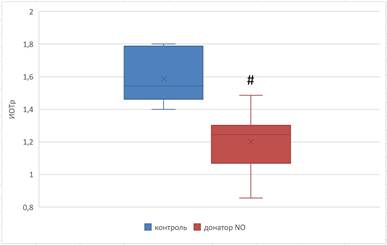
Рис. 3. Изменение ИОТр при инкубации тромбоцитов с нитропруссидом натрия в концентрации 1000 мкмоль/л
Примечание: # – достоверные различия между опытной и контрольной группами (p≤0,05).
В гипотонической среде количество свободных кровяных пластинок уменьшается уже через 5 мин как в препаратах тромбоцитов, предварительно инкубированных с раствором нитропруссида натрия в концентрации 1000 мкмоль/л (в 15 раз), так и в контроле (в 16 раз) (таблица). Количество агрегатов, напротив, возрастает в опытных и в контрольных препаратах.
У тромбоцитов, инкубированных с НПН, в гипотонической среде исходный индекс удлинения в 1,5 раза больше, чем в контроле (p=0,0027). Однако уже через 5 мин «гипотонического шока» этот показатель уменьшается с 0,31±0,03 до 0,22±0,03 (p=0,0404), тогда как в контроле аналогичные изменения отсутствуют, что может быть связано с нарушением стабильности мембраны тромбоцитов, подвергнутых влиянию оксида азота и его метаболитов. Известно, что в гипотонической среде изменяется осмотический баланс тромбоцитов, что становится причиной их гибели. В ответ на уменьшение осмотического давления среды активируются белки аквапорины, ответственные за трансмембранный перенос молекул воды, с последующим набуханием и повреждением кровяных пластинок [13]. В опытных препаратах этот процесс начинается быстрее и выражен в большей степени.
Результаты морфометрического исследования препаратов суспензии тромбоцитов в гипотоническом растворе (M±m)
|
Время воздействия (мин) |
Количество свободных тромбоцитов в препарате |
Количество агрегатов в препарате |
Индекс элонгации тромбоцитов, отн. ед. |
|||
|
Контроль |
Донатор NO |
Контроль |
Донатор NO |
Контроль |
Донатор NO |
|
|
0 |
310,14±18,74 |
354,29±21,31 |
0 |
0 |
0,19±0,02 |
0,31±0,03 # |
|
5 |
34,00±7,24 * |
35,57±5,89 * |
24,86±2,10 * |
23,43±4,01 * |
0,27±0,04 |
0,22±0,03 * |
|
10 |
24,57±4,24 * |
31,86±8,18 * |
20,86±2,58 * |
21,71±3,92 * |
0,18±0,02 |
0,16±0,02 * |
|
20 |
20,29±2,31 * |
22,86±3,66 * |
27,14±4,90 * |
20,43±3,10 * |
0,21±0,04 |
0,22±0,03 * |
Примечание: * – достоверные отличия по сравнению с исходными значениями (p≤0,05), # – достоверные различия между опытной и контрольной группами (p≤0,05).
Площадь тромбоцитов, предварительно инкубированных с НПН, при помещении в гипотоническую среду более чем в 10 раз больше, чем в контрольных препаратах, и составляет 3,81±0,15 мкм2 при 3,05±0,16 мкм2 в контроле (p=0,0047), что может быть следствием ускоренного перехода воды в кровяную пластинку при увеличении проницаемости ее мембраны. Через 20 мин воздействия гипотонического раствора площадь тромбоцитов опытной группы уменьшается до 2,69±0,16 мкм2, тогда как в контроле она составляет 3,22±0,15 мкм2 (p=0,0360), несколько превышая исходное значение. Площадь тромбоцитов опытных препаратов в гипотоническом растворе уменьшается уже к 10-й минуте экспозиции (рис. 4), вероятно, благодаря разрушению кровяных пластинок, наиболее подверженных действию метаболитов оксида азота, индуцирующих процессы свободнорадикального окисления и структурно-функциональные изменения мембраны, характеризующие преждевременное старение кровяных пластинок.
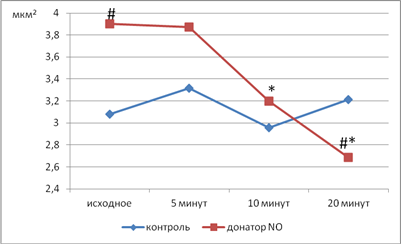
Рис. 4. Изменение площади свободных тромбоцитов в динамике действия гипотонического раствора
Выводы
Таким образом, следствием инкубации с нитропруссидом натрия в конечной концентрации 1000 мкмоль/л является уменьшение морфометрических параметров тромбоцитов, что может быть результатом их разрушения под влиянием метаболитов оксида азота. Снижение индекса омоложения и количества кровяных пластинок с грануломером свидетельствует об их более низкой функциональной активности, что, в свою очередь, может проявляться уменьшением размеров кровяных пластинок. Повреждающее действие производных оксида азота сопровождается пониженной осмотической резистентностью мембраны тромбоцитов, следствием чего является ускорение процесса их набухания и разрушения в гипотонической среде.
Работа является частью комплексного исследования, выполняемого в соответствии с планом государственного задания ФГБОУ ВО «ИвГМА» Минздрава России на 2020 год «Исследование функционального резерва тромбоцитарного и гуморального компонентов гемостаза при гипоксии тканей, органов и систем».
Библиографическая ссылка
Кормилицына М.А., Голубева Е.К., Пахрова О.А. ОСОБЕННОСТИ МОРФОЛОГИИ И ОСМОТИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ТРОМБОЦИТОВ КАК РЕЗУЛЬТАТ ПРЕИНКУБАЦИИ С ДОНАТОРОМ ОКСИДА АЗОТА IN VITRO У КРЫС // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30466 (дата обращения: 24.04.2024).