Прием алкоголя в высоких дозах оказывает отрицательное влияние на гемодинамику: изменяет артериальное давление, повышает риск аритмии, ухудшает эндотелиальную функцию. Это увеличивает риск ишемического и геморрагического инсульта. Алкоголь и его метаболиты оказывают выраженное вазоактивное действие, в том числе непосредственно влияя на функцию эндотелия. В частности, in vitro низкие концентрации алкоголя увеличивают выделение оксида азота (NO) и повышают эндотелий-опосредованную вазодилатацию, но в высоких концентрациях этанол оказывает обратное действие [1].
Фармакологические подходы к устранению похмелья требуют усовершенствования, для чего необходимо более глубокое понимание патологических процессов, которые протекают в организме при этом состоянии [2]. Похмелье определяется как комплекс симптомов, характеризующихся общим дискомфортом, возникающим после полного метаболизма ранее принятого алкоголя (т.е. в ситуации, когда алкоголь не может быть определен в крови). Похмелье сопровождается истощением внутриклеточных субстратов из-за поэтапного и интенсивного процесса биотрансформации этанола и его метаболитов.
Одним из перспективных направлений в терапии похмелья является разработка средств, ускоряющих метаболизм ацетальдегида. Ацетилцистеин – предшественник глутатиона, регулятора окислительно-восстановительных процессов в клетках, в том числе и в гепатоцитах. Глутатион инактивирует активные формы кислорода (АФК), образование которых зависит от интенсивности окислительно-восстановительных реакций. Метаболизм алкоголя протекает в несколько стадий: алкоголь – ацетальдегид – уксусная кислота. Когда в организм попадает большое количество этанола, гепатоциты длительное время пребывают в условиях интенсификации метаболических процессов, которые сопровождаются образованием большого количества АФК и реактивных метаболитов, инактивируемых в том числе глутатионом. Замедление метаболизма ацетальдегида является следствием истощения запасов восстановленного глутатиона, поэтому применение веществ, способных повышать его содержание, может способствовать активизации механизмов выведения ксенобиотиков, предотвратить, облегчить или сократить длительность похмельного синдрома [3].
Цель исследования заключалась в определении эффективности профилактического или терапевтического введения ацетилцистеина в отношении вазодилатирующей функции эндотелия сосудов головного мозга крыс после острой алкогольной интоксикации.
Материал и методы исследования
Работу выполнили на самцах крыс линии Вистар (300–450 г). Исследование проводили в двух сериях (рис. 1), которые различались порядком введения алкоголя (20%-ного водного раствора этанола, 3 г/кг, в/б) и ацетилцистеина (1 г/кг, per os). В первом случае вначале профилактически вводили ацетилцистеин (за 60 мин), а затем алкоголь. Во второй серии ацетилцистеин вводили терапевтически животным через 30 мин после пробуждения от сна, вызванного введением алкоголя. В обеих сериях животных распределяли на 3 группы по 12–14 особей. Крысам из первой группы вводили этанол и воду (положительный контроль); крысам из второй группы – этанол и ацетилцистеин; животным из третьей (интактной) группы вместо этанола вводили эквивалентное количество дистиллированной воды.
У животных, получавших этанол, регистрировали латентный период потери установочного рефлекса, время сна и возникающий неврологический дефицит по балльной шкале Combs and D' Alecy (1987), включающей в себя оценку мышечной силы, цепкости и равновесия животных (от 1 до 3 баллов в каждом из тестов). Меньший суммарный балл соответствовал более выраженным неврологическим нарушениям [4]. Поскольку до начала эксперимента все животные были интактными и физически здоровыми, оценку их состояния перед введением этанола или физраствора не проводили. Крыс, которые не просыпались спустя 8 ч 30 мин после введения этанола (n = 2–4 на группу), исключали из эксперимента.
На последнем этапе животных наркотизировали (золетил и ксилазил в дозах 20 и 8 мг/кг соответственно) и определяли уровень мозгового кровотока и эндотелийзависимую вазодилатацию (выраженность эндотелиальной дисфункции) [5]. Мозговой кровоток регистрировали методом лазерной допплеровской флоуметрии, а по его изменению в ответ на модификацию синтеза оксида азота стимуляцией (ацетилхолин) и блокадой (метиловый эфир Nω-нитро-L-аргинина, L-NAME) эндотелиальной синтазы оксида азота (eNOS) судили о выраженности эндотелиальной дисфункции в постинтоксикационном периоде.
Статистическую обработку результатов проводили с использованием программного обеспечения Prism 6 (GraphPad Software Inc., США). Распределение количественных показателей оценивали с использованием критерия Шапиро–Уилка. Межгрупповые различия оценивали при помощи однофакторного дисперсионного анализа с пост-тестом Ньюмена–Кеулса. Данные представлены в виде среднего значения и стандартной ошибки среднего.
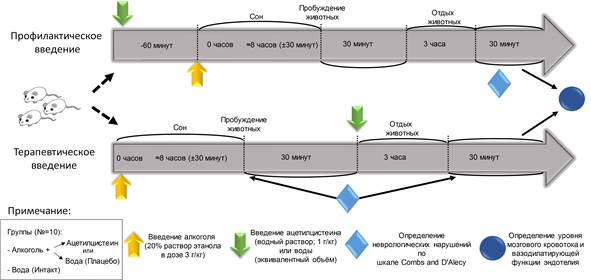
Рис. 1. Схематичное отображение дизайна исследования протективного действия ацетилцистеина на крыс после их острой интоксикации этанолом
Результаты исследования и их обсуждение
После внутрибрюшинного введения этанола крысы засыпали в течение 2 мин, и их сон длился в среднем 8 ч ± 30 мин. По времени наступления и продолжительности сна все отобранные в эксперимент животные были сопоставимы. Постинтоксикационное состояние характеризовалось угнетенным поведением: они были вялыми и испытывали сонливость.
У животных, которым вводили этанол, регистрировали симптомы тяжелого неврологического дефицита, выраженность которых несущественно снижалась через 3 ч в контрольной группе и значительно уменьшилась через 3 ч после терапевтического введения ацетилцистеина (рис. 2А и 2Б). У крыс, которым ацетилцистеин вводили профилактически, эти симптомы были выражены в значительно меньшей степени, чем у крыс, которым вводили плацебо, что свидетельствовало о более выраженном профилактическом действии препарата в отношении последствий острой интоксикации этанолом (рис. 2В).
Мозговой кровоток интактных животных был интенсивнее, чем у животных, находящихся в постинтоксикационном состоянии. Терапевтическое введение ацетилцистеина после острой алкогольной интоксикации существенно не влияло на уровень мозгового кровотока, но значительно повышало эндотелийзависимую вазодилатацию: при стимуляции ацетилхолином скорость кровотока значительно повышалась, достигая уровня интактных животных, в то время как у животных контрольной группы этот показатель практически не изменился. Блокада синтеза оксида азота приводила к одинаковой по выраженности степени снижения скорости мозгового кровотока (рис. 3А1 и А2). Профилактическое введение ацетилцистеина способствовало повышению уровня мозгового кровотока относительно контрольной группы и значимо более выраженному изменению мозгового кровотока в ответ на стимуляцию и блокаду синтеза оксида азота (рис. 3Б1 и Б2).
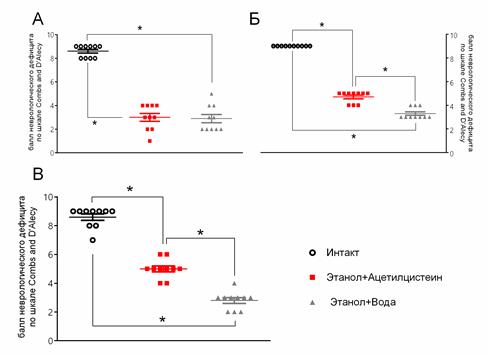
Рис. 2. Влияние ацетилцистеина на балл неврологического дефицита по шкале Combs and D' Alecy после острой алкогольной интоксикации при терапевтическом (А, Б) и профилактическом (В) введении (* – p<0,05; сравниваемые группы обозначены линиями)
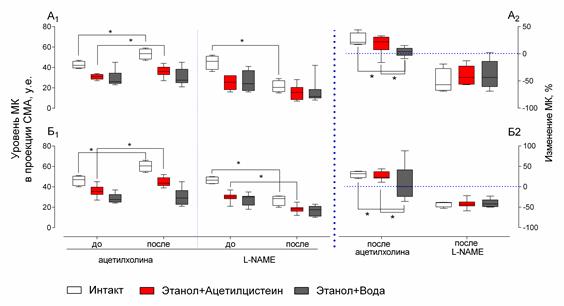
Рис. 3. Влияние ацетилцистеина на мозговой кровоток и эндотелийзависимую вазодилатацию у животных после острой алкогольной интоксикации при терапевтическом (А1 и А2) и профилактическом (Б1 и Б2) введении (* – p<0,05; % – изменение кровотока относительно начальных значений; сравниваемые группы обозначены линиями;
МК – мозговой кровоток; СМА – средняя мозговая артерия)
Этанол под действием алкогольдегидрогеназы метаболизируется до ацетальдегида, который в последующем превращается в ацетат. При небольших концентрациях этанола эти реакции протекают последовательно, при возрастании концентраций – параллельно со стремительным уменьшением концентрации никотинамидадениндинуклеотида (НАД) и увеличением концентрации НАДН. Интенсивный метаболизм алкоголя в гепатоцитах сопровождается повышенной генерацией аденозинтрифосфата (АТФ) и интенсификацией продукции АФК, что приводит к истощению запасов восстановленного глутатиона и к снижению метаболической активности клетки. Повышение концентрации НАДН вызывает кетоз и гиперлактацидемию, что способствует развитию ацидоза. Ацетилцистеин выступает в роли предшественника L-цистеина, из которого образуется антиоксидант глутатион [2, 3].
Согласно ранее полученным результатам, дополнительное введение ацетилцистеина в организм способствует увеличению запасов глутатиона [4, 6, 7], что позволяет пролонгировать интенсивное течение окислительно-восстановительных процессов в гепатоцитах и тем самым облегчить и ускорить метаболизм этанола и его продуктов, предупредив их токсическое влияние на организм. Необходимо учитывать наличие нейрокогнитивных нарушений в постинтоксикационном периоде, поэтому важна способность окисленного глутатиона и S-нитрозоглутатиона связываться с сайтом распознавания глутамата рецепторов NMDA и AMPA (через их γ-глутамильные фрагменты) и выступать в роли эндогенного нейромодулятора (в миллимолярных концентрациях они также могут модулировать окислительно-восстановительное состояние рецепторного комплекса NMDA). Поскольку N-ацетилцистеин является пролекарством глутатиона, он может также модулировать все вышеупомянутые функции. Цистин – аминокислота, выступающая субстратом для антипортера цистин-глутамата на астроцитах, способствует выбросу глутамата, что важно для восстановления гомеостаза нейромедиаторов (нарушен в постинтоксикационном периоде) и соответственно нейрокогнитивных функций [8].
Ацетальдегид является центральным фактором развития и прогрессирования кардиотоксических свойств этанола, что связано с высоким уровнем супероксида (O2•-), снижением митохондриальной поляризации и высокой активности НАДФН-оксидазы [9]. Эндотелий сосудов является основной структурой, функция которой может быть нарушена вследствие окислительного стресса и альдегидов. Ацетилцистеин снижает выраженность эндотелиальной дисфункции, вызванной дисфункцией альдегиддегидрогеназы 2 (ALDH2; основного фермента, метаболизирующего ацетальдегид) [10]. Ацетальдегид также увеличивает проницаемость микрососудов для белков плазмы [11]. Регулярное употребление алкоголя или эпизодический прием его больших количеств приводит к нарушению функций эндотелия в сочетании со сниженной биодоступностью NO, в том числе и за счет образования асимметричного диметиларгинина (эндогенного ингибитора NOS), который снижает синтез оксида азота [12, 13]. Эндотелий головного мозга – ключевая структура, формирующая ГЭБ, дисфункция которого, наблюдающаяся при злоупотреблении алкоголем, связана с окислительным стрессом, возникающим в результате метаболизма этанола и токсического действия метаболитов (ацетальдегида) в эндотелиоцитах. Этанол усиливает каталитическую активность и экспрессию ферментов, участвующих в его метаболизме, что параллельно увеличивает образование АФК, при этом возникает дефицит антиоксидантов. Окислительный стресс приводит к активации киназы легкой цепи миозина и к снижению целостности ГЭБ, а также к повышению его проницаемости для моноцитов [14]. Следовательно, этанол и его токсичные метаболиты негативно влияют на функцию эндотелия.
Таким образом, ацетилцистеин может применяться для предупреждения или купирования похмельного синдрома и эндотелиальной дисфункции в сосудах мозга. Он облегчает метаболизм ксенобиотиков в печени и может оказывать протективное действие в отношении эндотелиоцитов, сохраняя локальную активность альдегиддегидрогеназы 2 на высоком уровне, облегчая и ускоряя метаболизм ацетальдегида. Профилактическое введение ацетилцистеина очевидно способствует более быстрому метаболизму алкоголя и его метаболитов, ослаблению их общетоксического действия, в том числе в отношении эндотелиоцитов, поскольку их вазолидатирующая функция снижалась в меньшей степени.
Заключение
Профилактическое введение ацетилцистеина снижало общетоксическое действие этанола, в то время как терапевтическое введение ускоряло восстановление животных после перенесенной интоксикации; это сопровождалось не только уменьшением выраженности неврологического дефицита, но и улучшением вазодилатирующей функции эндотелия сосудов головного мозга. Таким образом, ацетилцистеин может применяться для предупреждения или купирования похмельного синдрома и эндотелиальной дисфункции.
Работа выполнена за счет средств, полученных при грантовой поддержке Президента Российской Федерации по Соглашению о предоставлении из федерального бюджета грантов в форме субсидий в соответствии с п. 4 ст. 78.1 Бюджетного кодекса Российской Федерации (внутренний номер МК-3454.2019.7) № 075-15-2019-176 от 23.05.2019 г.
Библиографическая ссылка
Куркин Д.В., Морковин Е.И., Осадченко Н.А., Бакулин Д.А., Абросимова Е.Е., Горбунова Ю.В., Ковалев Н.С., Дубровина М.А., Тюренков И.Н. ВЛИЯНИЕ ПРОФИЛАКТИЧЕСКОГО И ТЕРАПЕВТИЧЕСКОГО ВВЕДЕНИЯ АЦЕТИЛЦИСТЕИНА НА ДИСФУНКЦИЮ ЭНДОТЕЛИЯ ПОСЛЕ ОСТРОЙ ИНТОКСИКАЦИИ ЭТАНОЛОМ // Современные проблемы науки и образования. – 2021. – № 1. ;URL: https://science-education.ru/ru/article/view?id=30522 (дата обращения: 20.04.2024).



