Сегодня достигнуты большие успехи в эндоваскулярном и микрохирургическом лечении интракраниальных аневризм, однако в настоящее время не существует способов прогнозирования их роста и рецидивирования на фоне проводимого лечения. Механизмы формирования и роста аневризм сложны и недостаточно изучены. Многочисленные работы, посвященные изучению патогенеза церебральных аневризм, пока не оказали значительного влияния на клиническую идентификацию и/или лечение интракраниальных аневризм (ИА). Поэтому крайне важно, чтобы исследования в области генетики, молекулярной биологии и генетической эпидемиологии аневризм были приближены к клинической практике. В этом обзоре мы проанализировали современное состояние понимания клеточной, генетической и эпигенетической регуляции формирования ИА для создания теоретической основы исследований, предпринимаемых нами с целью поиска биологических маркеров, которые могут быть связаны с образованием, ростом и рецидивированием ИА после хирургического лечения.
Цель обзора – проанализировать современную литературу, отражающую результаты изучения клеточных, генетических и эпигенетических механизмов образования и роста интракраниальных аневризм (ИА). В период с января 1990 г. по декабрь 2020 г. в базе данных PubMed был выполнен поиск по ключевым словам: «церебральная аневризма», «патогенез» и «микроРНК». Всего было найдено 45 статей, которые были отобраны для обзора и анализа.
Аневризмы сосудов головного мозга чаще всего возникают в местах бифуркации сосудов, в которых происходит наибольшее изменение напряжения сдвига потока крови на сосудистую стенку. Эндотелиальные клетки первыми воспринимают и обрабатывают механические стимулы напряжения сдвига и растяжения благодаря множественным механорецепторам на их поверхности, регулируемым механо-микроРНК эндотелия, что приводит к различным внутриклеточным ответам, которые изменяют стенку сосуда [1]. Считается, что под гемодинамическим воздействием наиболее уязвимые участки стенки церебральных сосудов (особенно области бифуркации) начинают претерпевать изменения структуры, что постепенно приводит к формированию аневризматических выпячиваний. Анализ экспрессии генов показывает, что высокое напряжение сдвига потока крови на стенку сосуда, характерное для образования аневризм, ведет к местной активации генов KLF2, KLF4, VCAM, NOS3, ICAM-1 и E-селектина, связанных с пролиферативным и провоспалительным состоянием [1]. Ключевым событием в формировании аневризм является разрушение внутренней эластической мембраны в стенке артерии – структуры, поддерживающей эластичность сосуда и не допускающей его максимального растяжения. Утрата эластической мембраны в месте формирования аневризмы обусловлена износом волокон коллагена под действием большей механической нагрузки. Гладкомышечные клетки (ГМК) в норме способны синтезировать, восстанавливать и поддерживать коллагеновые волокна. Коллаген собирается путем скручивания 3 полипептидных цепей (α1, α2 и α3), и комбинация их структуры создает 27 типов коллагена. В церебральной артериальной стенке встречается 5 видов коллагена (типы I, III, IV, V и VI), причем типы I и III составляют 80–90% от общего коллагена, а тип III является основным, обеспечивающим эластичность и растяжение артериальной стенки. Диаметр фибрилл коллагена с более высоким соотношением III/I приводит к формированию тонкого волокна и более гибкой артерии, а снижение этого соотношения вызывает избыточное расширение сосудов и образование аневризм [2].
Известно, что часть ИА остаются стабильными и никогда не разрываются во время жизни пациента, они обнаруживаются только на вскрытии. Такие аневризмы демонстрируют изменения в мышечном слое стенки, которые выражаются в миграции медиальных гладкомышечных клеток в интиму, где они подвергаются фенотипическому изменению из сократительного состояния в так называемый синтетический фенотип, характеризующийся пролиферацией и синтезом коллагена, поэтому гистология неразорвавшейся стенки ИА часто напоминает миоинтимальную гиперплазию или неоинтимальную гиперплазию [3]. ГМК при таком виде гиперпластических поражений интимы ведут себя иначе, чем в нормальном медиальном слое стенки сосуда [4, 5]. Развитие гиперплазии интимы у нервавшихся ИА само по себе не ведет к росту и разрыву ИА, а, напротив, за счет ремоделирования внеклеточного матрикса, пролиферации ГМК, синтеза коллагенa и других компонентов матрицы, которые усиливают стенку сосуда, поддерживают ее прочность, противостоят гемодинамическому давлению. Неоинтимальная гиперплазия интимы считается «ранозаживляющей реакцией» стенки аневризмы [2].
Другим типом аневризм являются растущие аневризмы, склонные к разрыву. Гистологические исследования стенки разорвавшихся ИА продемонстрировали потерю сократительных ГМК, дегенерацию внеклеточного матрикса и инфильтрацию воспалительными клетками, активацию гуморального иммунитета, сильное нарушение формирования гиперплазии интимы [6]. В стенках аневризм, потерявших ГМК, становится невозможным устранение износа коллагена, вызванного механическим и протеолитическим стрессом, которому стенка аневризмы непрерывно подвергается, что приводит к постепенному ослаблению и дегенерации стенки рвавшейся аневризмы [7]. Иммуногистохимические исследования с использованием антител против актина показали небольшое количество дегенерированных ГМК в рвавшихся аневризмах и замену мышечного слоя фибро-гиалиновой тканью, были обнаружены доказательства фрагментации ДНК в ГМК в стенке аневризмы в виде наличия антител к одноцепочечной ДНК у 54% рвавшихся аневризм. Напротив, апоптотические тельца были обнаружены только в 7% нервавшихся ИА [8]. Aпоптоз ГМК в стенке аневризмы вызван ее непосредственным повреждением, дегенерацией и потерей ГМК, снижением их плотности в стенке рвавшейся аневризмы. Фенотипическая модуляция ГМК в ИA вызывается фактором некроза опухоли-α (TNF-α), который экспрессируется на высоком уровне в стенке разорвавшейся ИА. TNF-альфа инициирует многочисленные пути, которые приводят к воспалению и апоптозу эндотелия, дегенерации ГМК и внутренней эластической мембраны в стенке аневризмы. В совокупности эти данные показывают, что ГМК под влиянием медиаторов воспаления, в частности TNF-α, способствуют формированию аневризмы, ее росту и разрыву. Следовательно, выявление биохимических механизмов регулирования фенотипов ГМК и возможность их коррекции будут иметь решающее значение для прогнозирования роста и разрыва стенки церебральной аневризмы [9, 10]. Математические модели скорости роста аневризмы, а также данные клинического наблюдения демонстрируют, что рост аневризмы не является постоянным и происходит в соответствии с индивидуальными временными рамками [11]. Скорее всего, это отражает различия способности разных фенотипов ГМК сохранить структурную прочность стенки ИА за счет синтеза нового коллагена и поддержания или увеличения прочности на разрыв стенки аневризмы [12]. Y. Wang et al. (2019) продемонстрировали, что снижение экспрессии circRNA_0020397 в тканях стенки артерии и клетках аневризмы может вносить вклад в снижение пролиферации ГМК посредством увеличения экспрессии miR-138 [13].
Формирование аневризмы инициируется гемодинамически вызванной эндотелиальной дисфункцией: возникает воспалительный ответ с участием нескольких цитокинов и медиаторов воспаления, а также макрофагов, Т-клеток и тучных клеток [10, 12]. Эндотелиальная дисфункция, в свою очередь, вызывает пролиферацию vasa vasorum в стенке ИА за счет активации ангиогенеза (рис.). Это создает условия, при которых воспалительные клетки проникают в слой ГМК и вызывают их фенотипические изменения [14, 15]. ГМК также привлекают макрофаги в стенку церебральной артерии при формировании ИА за счет экспрессии хемоаттрактантного белка-1 (MCP-1) [15, 16]. Макрофаги, проникающие в зону образования аневризмы, продуцируют металлопротеиназы (ММР), которые разрушают коллагеновый матрикс стенки аневризмы, а их активность регулируется тканевыми ингибиторами металлопротеиназы (TIMP-1). При этом ММР-2 обнаруживается в более высоких концентрациях в сыворотке крови пациентов с аневризмами, а экспрессия TIMP-1 снижена [17, 18]. Потери ГМК, повреждение эндотелия и повышенная проницаемость стенки рвавшейся аневризмы для циркулирующей плазмы объясняют, почему липиды и иммуноглобулины появляются в стенке ИА. Липиды поглощаются клетками стенки аневризмы и становятся окислительно модифицированными, что делает их цитотоксичными для ГМК. Иммуноглобулины, которые накапливаются в стенке аневризмы, также являются провоспалительными. Накопление окислительно модифицированных липидов усиливает воспаление в стенке аневризмы и прямую цитотоксичность для ГМК, ускоряя их дегенерацию и увеличивая риск разрыва аневризмы. Следовательно, изучение механизмов молекулярного регулирования трансформации фенотипов ГМК имеет решающее значение для прогнозирования роста и разрыва церебральной аневризмы [11, 19].
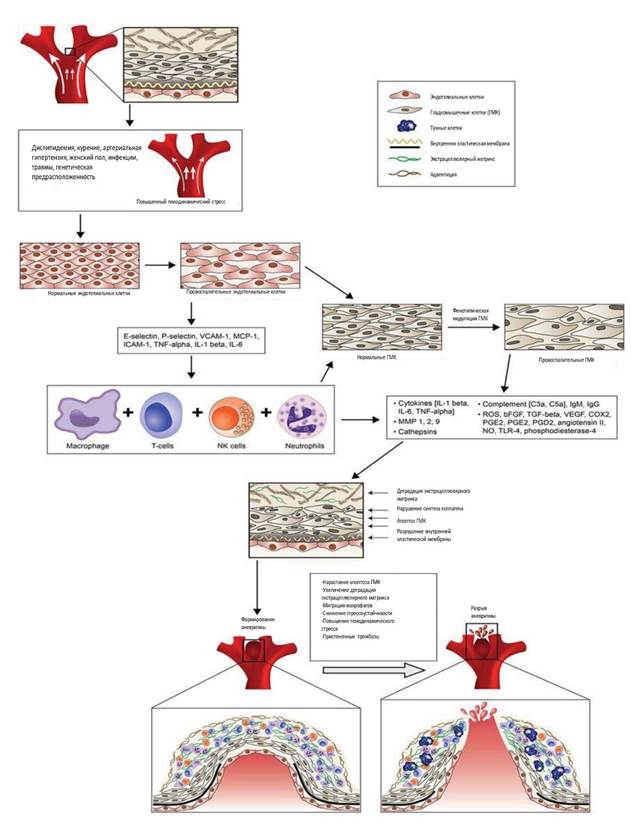
Образование и разрыв интракраниальной аневризмы (ИА)
Примечание: формирование аневризмы инициируется гемодинамически вызванной эндотелиальной дисфункцией. Возникает воспалительный ответ с участием нескольких цитокинов и медиаторов воспаления, а также макрофагов, Т-клеток и тучных клеток. Одновременно гладкомышечные клетки (ГМК) претерпевают фенотипическую модуляцию до провоспалительного фенотипа. Воспалительная реакция в стенке сосуда приводит к нарушению внутренней эластической пластинки, деградации внеклеточного матрикса и образованию аневризмы. Дальнейшая дегенерация сосудистой стенки в конечном итоге приводит к разрыву ИА. bFGF – основной фактор роста фибробластов; СОХ2 – циклооксигеназа-2; ECM – внеклеточный матрикс; ICAM – молекула межклеточной адгезии; ИL – интерлейкин; МСР – хемоаттрактантный белок моноцитов; ММР – матриксная металлопротеиназа; NO – оксид азота; PGD – простагландин D; PGE – простагландин E; ROS – активные формы кислорода; TGF – трансформирующий фактор роста; TNF – фактор некроза опухоли; VCAM – молекула адгезии сосудистых клеток; VEGF – фактор роста эндотелия сосудов (In Chalouhi N, et al., 2013) [12].
Многочисленные генетические исследования выявили около 20 локусов генов, достоверно связанных с образованием интракраниальных аневризм, из которых 11 локусов генов были внесены в ОМIМ (Online Mendelian Inheritance in Man) как определяющие фенотип (ANEURYSM INTRACRANIAL BERRY, ANIB) [19]. Анализ большого полногеномного ассоциативного исследования (GWAS) в финских, голландских и японских когортах, включивших 5 891 человека с церебральными аневризмами и 14 181 контрольного здорового добровольца, был выполнен для того, чтобы найти генетические полиморфизмы, которые связаны с образованием ИА или аневризматическим САК [20]. В данном исследовании идентифицировали 5 локусов хромосом с генами-кандидатами, которые ассоциированы с образованием ИА. Среди этих локусов особый интерес представляет Локус 9p21.3, кодирующий циклинзависимые ингибиторы киназ, так как потеря функции этих киназ способствует апоптозу ГМК. Кроме того, идентифицированы три гена коллагенов, обнаруженных в стенке аневризмы (COL1A2, COL3A1 и COL5A2) и не выявлявшихся в контрольных сосудах. Интересно, что из трех генов с пониженной регуляцией один кодировал тканевой ингибитор металлопротеиназы, другой – тенасцин С, белок, регулирующий прикрепление фибробластов к внеклеточному матриксу во время заживления ран. Эти данные свидетельствуют о том, что синтез нового и ремоделирование поврежденного внеклеточного матрикса активируются в стенках нервавшихся ИА, подтверждая представление о том, что ГМК синтетического фенотипа пытаются восстановить и поддерживать внеклеточную матрицу для достаточной прочности стенки аневризмы, сопротивляющейся гемодинамическому давлению. В то же время ГМК медиального типа в стенках рвавшихся аневризм подвергаются апоптозу уже в самом начале образования аневризмы, и они становятся не способными к адаптации и ремонту коллагена в стенке ИА, подвергающейся постоянному износу и гемодинамическому стрессу, воздействию протеаз, что ведет к росту аневризмы и ее последующему разрыву. Тем не менее эти пять локусов риска, выявленных на данный момент, объясняют только 5% семейных ИА, что делает невозможным предсказание возникновения ИА на основании генетических исследований [21, 22]. R. Morgaet al. (2020) изучали характер экспрессии и функциональную роль мРНК в системном ответе на разрыв внутричерепной аневризмы у пациентов в острой фазе разрыва ИA (первые 72 ч), в хронической фазе (3–15 месяцев) и в контрольной группе здоровых добровольцев. Среди исследуемых групп было идентифицировано 542 дифференциально экспрессируемых мРНК (108 пиРНК, 99 рРНК, 90 микроРНК, 43 скРНК, 36 тРНК). piРНК и rРНК обнаруживают существенное снижение их количества после разрыва ИА, тогда как микроРНК в значительной степени активируются. Гены мРНК с пониженной регуляцией включали piR-31080, piR-57947, 5S рРНК, LSU-рРНК и SSU-рРНК [23].
Международное исследование (ISUIA) оценивало нервавшиеся церебральные аневризмы с учетом демографических данных пациентов и локализации множественных ИА. Выявлено, что чаще множественные ИА расположены в области средней мозговой артерии (28,6%) и задних соединительных артерий (13,7%) [24]. Риск развития аневризм увеличивается в семьях с аневризмой в анамнезе, особенно в Японии и Финляндии. В мире около 3% населения страдают ИА, однако заболеваемость аневризмами в Финляндии в 2 раза больше. В финской популяции идентифицировали три новых локуса на хромосомах 18q11.2 и 10q24.32, связанных с аневризмой. Три локуса были связаны с аневризмой (2q23.3; 5q31.3; 6q24.2) и один – с количеством аневризм (7p22.1). Локус 7p22.1 чаще встречался в Финляндии (4,6%), чем в Нидерландах (0,3%). Пять локусов объясняют 2,1% наследственных аневризм в Финляндии [25]. Коллаген типа I α2 (COL1A2) был связан с наличием аневризм у пациентов из Японии, Китая и Кореи. Однако это не объясняет формирования большинства аневризм [26]. Существует несколько наследственных состояний, устойчиво связанных с формированием ИА, включая аутосомно-доминантный поликистоз почек, нейрофиброматоз I типа, синдром Марфана, множественную эндокринную неоплазию I типа, эластическую псевдоксантому, наследственную геморрагическую телеангиэктазию и Элерс–Данлоса синдром II и IV типов [27]. Полногеномные исследования сцепления генов в семьях с ИА идентифицировали несколько локусов на хромосомах 1p34.3-p36.13, 7q11, 19q13.3 и Xp22 (ген перлекана, ген эластина, ген А2 коллагена 1-го типа), а также 3 полиморфизма (эндотелиальная синтаза оксида азота T786C, интерлейкин-6 G572C и интерлейкин-6 G174C), которые были значимо связаны как с рвавшимися, так и с нервавшимися аневризмами. При этом ген эндотелиальной синтазы оксида азота T786C увеличивал риск разрыва аневризмы, в то время как IL-6 G174C оказался защитным. Два геномных локуса (эндотелиин рецептор А и ингибитор циклинзависимой киназы 2) были обнаружены у больных с аневризмами в японской популяции [28]. В исследовании китайской популяции изучены профили экспрессии генов при 103 внутричерепных аневризмах, идентифицировано 3736 генов с дифференциальной экспрессией, из которых 179 показали более чем 10-кратное превышение в стенках аневризм по сравнению с контрольным сосудом [29]. Это гены, обусловливающие пролиферацию, миграцию, апоптоз ГМК и атеросклероз: ALOX5, APOC1, APOE, HMOX1, MSR1, OLR1,PLA2G7, SPP1, AGTR1, PDE4C и RASL12, из которых ALOX5, APOC1, APOE, HMOX1, MSR1, OLR1, PLA2G7,и SPP1 были активированы, в то время как AGTR1, PDE4C и RASL12 подавлялись у пациентов с аневризмой. Гены, участвующие в разрушении внеклеточного матрикса: APOE,IBSP, COL1A1, POSTN, SPP1 и COL4A6, из которых APOE, IBSP, POSTN и SPP1 подверглись повышенному регулированию, в то время как COL4A6 подавлялся в стенке аневризмы. Гены, участвующие в воспалительных реакциях: ALOX5, APOE, CCL18, CCL3, CD86, CXCR4, FCGR1A, FCGR3A,HMOX1, IL8, LYZ, PLA2G7, RGS1, SERPINA1, SPP1,TYROBP, AGTR1, AOC3, COL4A6, CXCL14, PDE4C,TNC и TRPV1, из которых ALOX5, APOE, CCL18, CCL3,CD86, CXCR4, FCGR1A, FCGR3A, HMOX1, IL8, LYZ,PLA2G7, RGS1, SERPINA1, SPP1 и TYROBP были с повышенной регуляцией, в то время как AGTR1, AOC3, COL4A6, CXCL14, PDE4C, TNC и TRPV1 были подавлены в стенке аневризмы. Гены – медиаторы воспаления, включая IL8 и IFI30, были активированы в аневризмах, и экспрессия генов комплемента FCGR1A, FCGR1B, FCGR1C, FCGR3A и FCGR3B также была значительно выше в аневризмах, чем в контрольном сосуде. В этом исследовании определено, что 9 генов, связанных с иммунными и воспалительными реакциями (AGTR1, AOC3, COL4A6, CXCL14, PDE4C, TNC, TRPV1, AIF1L и CYP4B1), были подавлены в аневризмах. Таким образом, выявлено, что гены с дифференциальной экспрессией в стенках аневризм, в основном, задействованы в иммунных и воспалительных процессах в ГМК, в их фенотипической дифференциации и миграции. Однако авторы не обнаружили существенных различий в профиле экспрессии генов нервавшихся и рвавшихся аневризм [28]. Всего в стенке церебральных аневризм было проверено 1332 генов, для сравнения исследовались ткани поверхностной височной артерии. Были выявлены повышенная регуляция TNF, IL10, IL1B и CTSS, а также пониженная регуляция IL6. Авторы полагают, что гены VCAM1, TNF, CTSS, IL10, IL1B, IL6 и miR-29A / B / C могут быть значимыми для образования и развития ИA [29]. Таким образом, на сегодняшний день четкий постоянный причинный генетический полиморфизм не выявлен, ген-кандидат на идентификацию ИА не обнаружен, показана выраженная генетическая геторогенность в разных популяциях, что не позволяет сделать выводы о существовании генетических механизмов формирования аневризм [19].
Ми́кроРНК(microRNA, miR)– малые некодирующие молекулы РНК (в среднем 22 нуклеотида) – ингибируют трансляцию экспрессии генов путем РНК-интерференции, что приводит к подавлению активности генов. МикроРНК были открыты в 1993 г.Виктором Амбросом с соавторами. Между микроРНК и ее мРНК-мишенью может не быть полного соответствия: микроРНК может иметь несколько мРНК-мишеней, и мРНК может иметь несколько соответствующих ей микроРНК, причем каждая микроРНК имеет приблизительно 200 транскриптов-мишеней, умеренно понижая экспрессию образования сотенбелков (менее чем в 2 раза). Помимо внутриклеточной микроРНК, обнаружена внеклеточная (циркулирующая) микроРНК [30]. В настоящее время делаются попытки идентифицировать микроРНК как биохимические маркеры, прогнозирующие формирование и разрыв ИА [31]. МикроРНК присущи характеристики идеального биомаркера: высокая стабильность в плазме и сыворотке крови (микроРНК находятся или в экзосомах, или в связанной с липопротеидными комплексами или с РНК-связывающими белками форме, что защищает их от ферментативной деградации), сопоставимость профилей микроРНК в норме у мужчин и женщин, а также у лиц разного возраста. Кроме того, экспрессия микроРНК является клеточной, что позволяет локализовать источник микроРНК непосредственно в пораженной аневризмой артерии [32, 33]. Известно, что в формирование аневризм вовлечено несколько патологических процессов: активация иммунного и воспалительного ответа, формирование внеклеточного матрикса, дисфункция эндотелиальных клеток, фенотипические изменения ГМК и апоптоз. Анализ микроРНК, ассоциированных с церебральными аневризмами, демонстрирует их отчетливое влияние на механизмы образования и роста аневризм. Для изучения экспрессии микроРНК и мРНК авторы в своих работах использовали полимеразную цепную реакцию (ПЦР) в режиме реального времени, экспрессию белков определяли с помощью вестерн-блоттинга, а ген-мишень miRNA подтверждали с помощью люциферазного анализа. H. Jin et al. (2013) обнаружили 223 микроРНК в плазме крови у пациентов после разрыва интракраниальных аневризм. Экспрессия miR-16 и miR-25 значительно выше в плазме у пациентов с церебральными аневризмами, чем у здоровых добровольцев [34]. J. Meeuwsen et al. (2017) в плазме идентифицировали 3 циркулирующие микроРНК: miR-183-5p, miR-200a-3p и miR-let-7b, которые позволяют различать пациентов с церебральными аневризмами и группу здоровых добровольцев. Выявлено, что miRNA-183-5p была снижена в плазме у всех пациентов с аневризмами (95% ДИ 0,63–0,97), miRNA-200a-3p (95% ДИ 0,55–0,94) повышена у больных с рвавшимися аневризмами и miRNA-let7b-5p (95% ДИ 0,81–1) снижена у пациентов с нервавшимися АА по сравнению с контролем. У пациенты с рвавшимися аневризмами отмечались повышение экспрессии miR-3679-5p и miR-199a-5p и снижение 13 микроРНК [32]. T. Jiang et al. (2013) [35] идентифицировали 18 микроРНК, экспрессия которых была значительно снижена в образцах стенок рвавшихся церебральных аневризм. Увеличение уровня miR-34a приводит к уменьшению белка SM22a, который поддерживает ГМК в сократительном фенотипе, характерном для рвавшихся аневризм. MiR-21, miR-22 и miR-3665 были повышены у пациентов с разрывами и без разрывов аневризм. У 102 пациентов с ИА в китайской популяции изучена экспрессия miR-126, которая в сыворотке крови пациентов с рвавшимися аневризмами была значительно выше, чем у нормальной группы (p<0,05) [36]. По мнению авторов, высокая экспрессия miR-126 является независимым фактором риска разрыва ИА [37]. M. Supriya et al. (2020) провели изучение микроРНК в плазме с использованием ПЦР у 88 пациентов с аневризматическим САК и 110 здоровых людей из контрольной группы. Профили микроРНК были четко различны у пациентов с разорвавшейся ИА и представителей контрольной группы. 3 микроРНК с повышенной регуляцией (miR-15a-5p, miR-34a-5p, miR-374a-5p) и 5 микроРНК с пониженной регуляцией (miR-146a-5p, miR-376c-3p, miR-18b-5p, miR-24-3p, miR-27b-3p) отличают пациентов с САК от здоровых добровольцев с высокой прогнозируемой вероятностью (0,865 и 0,995 соответственно). Плазменные miR-146a-5p и miR-27b-3p были связаны с плохими клиническими исходами у пациентов с САК [38]. X.W. Suet al. (2015) сравнили уровень экспрессии микроРНК у 20 пациентов с аневризматическим САК и у 20 здоровых добровольцев. У пациентов с разорвавшимися аневризмами выявлен пониженный уровень экспрессии 18 микроРНК, повышенный уровень miR-132-3p – в 3,4 раза (95% ДИ 1,0–5,8) и miR-324-3p – в 45 раз (95% ДИ: от 2408 до 6683) по сравнению с группой здоровых добровольцев [38]. Получены данные (M. Korostynski et al., 2020), что воспалительные реакции в стенке аневризмы, вызывающие ее разрыв, модулируются микроРНК. Обнаружено, что 106 микроРНК по-разному экспрессировались среди больных с рвавшимися и нервавшимися аневризмами [39]. Lopes et al. (2018) исследовали профили экспрессии микроРНК у 27 пациентов с аневризматическим САК и у 6 контрольных пациентов на 7–10-й день после разрыва аневризмы. Интересно, что результаты полностью совпали с полученными M. Korostynski et al. (2020) данными и показали аналогичное повышение экспрессии 3 микроРНК – let-7f-5p, hsa-miR-451a и hsa-miR-941 [40]. Повышение микроРНК индуцирует активацию гибели клеток периферических Т-клеток, снижение количества CD3+ Т-клеток (как CD4+, так и CD8+) в остром периоде САК, что коррелирует с плохим исходом. Наиболее высоко регулируемые пути связаны с воспалением и иммунным ответом, особенно с цитокиновыми процессами [39]. P. Li и соавт. [14] продемонстрировали измененную экспрессию miR-25 и MiR-16 у 40 пациентов с ИА (20 неразорвавшихся и 20 разорванных) и 20 здоровых добровольцев, были идентифицированы 20 микроРНК, которые были изменены как у пациентов с разрывом, так и у пациентов без разрыва. Логистический регрессионный анализ продемонстрировал, что miR-16 и miR-25 были независимыми факторами возникновения аневризм (p<0,001). Поскольку микроРНК были изменены как в случае разрыва ИА, так и при нервавшихся аневризмах, маловероятно, что наблюдаемые изменения в микроРНК были вызваны вторичными осложнениями ИA, такими как САК и повреждения мозга. Более того, все образцы плазмы у пациентов без разрыва были взяты перед любым фармакологическим и/или хирургическим лечением; следовательно, также маловероятно, что измененные уровни микроРНК у пациентов с ИA были результатом клинического лечения [14].
Растущее количество данных свидетельствует о том, что miRNA высвобождаются в кровь клетками посредством различных клеточных транспортных механизмов. Появляются все новые свидетельства того, что микроРНК играют важную роль в нормальном функционировании эндотелиальных клеток (например, miR-155 модулирует формирование цитоскелета эндотелиальных клеток в ответ на повышенное гемодинамическое напряжение). МикроРНК-125b экспрессируется эндотелиальными клетками сосудов и влияет на основные белки мембран эндотелиоцитов (коннексины и кадгерины), которые участвуют в поддержании эндотелиальной проницаемости [33], miR-16, некоторые члены семейства miRNA let-7 и miRNA-18a участвуют в регуляции ангиогенеза. МiR-25 и miR-7 экспрессируются ГМК и являются негативным регулятором экспрессии коллагена. Это указывает на то, что наиболее часто встречающимися биологическими процессами, регулируемыми этими микроРНК, являются воспалительные реакции, эндотелиальная дисфункция, нарушение функции ГМК и образование коллагена. Все эти биологические эффекты имеют отношение к развитию ИA, функциональные взаимосвязи между аневризмой и каждой отдельной микроРНК еще предстоит выяснить [14].
Важно отметить, что у пациентов с неразорвавшимися аневризмами отмечались значительные изменения в 119 микроРНК. Выявлено, что miRNA-let7b-5p снижена у пациентов с нервавшимися аневризмами по сравнению с контролем [34]. TGF-β (трансформирующий фактор роста) является белком, который контролирует пролиферацию, клеточную дифференцировку ГМК. В своей работе M. Chan и соавт. (2010) [41] показали, что PDGF-BB (Platelet-derived growth factor – фактор роста тромбоцитов) взаимодействует с miR-24, приводя к снижению экспрессии TGF-β, что способствует формированию защитного синтетического фенотипа ГМК в стенках нервавшихся аневризм. X. Sima et al. (2017) [42] обнаружили, что кластер miR-143/145 подавлен у пациентов с ИА, а miR-143 может стать биохимическим маркером модуляции фенотипа ГМК, поскольку контролирует образование неоинтимы в нервавшихся аневризмах посредством своего целевого гена Kruppel-подобного фактора 5, защищая тем самым аневризмы от разрыва [42]. Авторы изучили влияние двух функциональных SNP в промоторе кластера miR-143/145 и обнаружили, что риск ИА был ниже у лиц с генотипами rs4705342 CC/СТ, чем у лиц с генотипом TT. Исследования сцепления по всему геному и ассоциации гаплотипов с аневризмами обнаружили доказательства сцепления на пятой хромосоме 5q22-31 и идентифицировали локус в 5q23.2 для miR-143 и miR-145.Однако эти данные были получены при исследовании населения Китая, и результаты не могут быть напрямую распространены на другие этнические группы [42]. W-Z Hou et al. (2017) обнаружили, что экспрессия мiR-370-3p была увеличена в стенках церебральной аневризмы, а прямой мишенью для нее является KDR (Kinase insert domain receptor – рецептор фактора роста сосудистого эндотелия, тип 2 VEGFR-2). KDR повышает пролиферацию, выживаемость, миграцию и дифференцировку эндотелиальных и гладкомышечных клеток. МiR-370-3p значительно подавляет KDR и блокирует пролиферацию синтетического фенотипа ГМК и неоинтимальной гиперплазии, что усиливает рост ИА и риск ее разрыва [43]. MiR-133, экспрессируемая в стенках аневризмы, также предотвращает пролиферацию ГМК и ингибирует изменения их фенотипа путем подавления фактора транскрипции Sp-1 (specificity protein 1) [44].
В работе D. Liu et al. (2014), посвященной изучению измененной экспрессии микроРНК у пациентов с церебральными аневризмами, выявлены значительно повышенные уровни miR-370-3p, miR-205 и miR-618-5p в стенках ИА по сравнению с нормальной контрольной группой (p<0,05) [44]. Обнаружено повышение уровня экспрессии miR-205 в стенке ИА, мишенью которой является тканевый ингибитор металлопротеиназ 3 (англ. tissue inhibitor of metalloproteinases 3, TIMP3). Белки группы TIMP в норме регулируют активность металлопротеиназ (MMР), а TIMP3, экспрессируемый клетками эндотелия, является единственным представителем группы, способным связываться с экстрацеллюлярным матриксом, локально угнетая действие ММР. Преобладание активности MMР над TIMP приводит к увеличению разрушения белков матрикса, в том числе коллагена и эластина, ослаблению стенки сосуда и повышению восприимчивости стенки артерии к гемодинамическому напряжению и, как следствие, к прогрессированию аневризмы и ее разрыву. TIMP3 не только блокирует разрушающее действие ММР, но также уменьшает экспрессию провоспалительного регулятора фактора некроза опухоли – TNFα. Повышение miR-205 в стенке аневризмы угнетает экспрессию TIMP3 и повышает экспрессию провоспалительного регулятора TNFα, усиливая воспалительный процесс в стенке ИА. Таким образом, повышенная экспрессия miR-205 может потенцировать рост и разрыв ИА [44, 45]. Интересно, что некоторые молекулы из семейства микроРНК-133, обнаруженные при ИА, экспрессируются также в кардиомиоцитах, скелетных мышцах, ГМК, были выявлены и при многососудистом (≥3) поражении коронарных артерий у пациентов с ИБС (miRNA-27a, miRNA-133a и miRNA-203) и сильно коррелируют со степенью коронарного атеросклероза [46, 47].
Таким образом, при анализе литературы выявлено, что для разорвавшихся аневризм характерно повышение экспрессии следующих микроРНК: miR-15a-5p, miR-16, miR-21, miR-22, miR-25, miR-27b-3p, miR-34a-5p, miR-125-b, miR-126, miR-132-3p, miR-133, miR-146a-5p, miR-138, miR-199a-5p, miR-200a-3p, miR-205, miR-324-3p, miR-370-3p, miR-374a 5р, miR-3679-5p, miR-3665. Экспрессия снижена по сравнению с контролем для miR-let-7b-5p, miR-18b-5p, miR-24-3p, miR-27b-3p, miR-143, miR-145, miR-183-5p, miR-376c-3p, которые, по-видимому, обладают защитным против аневризм действием. Кроме того, авторы подтвердили, что в идентифицированных при аневризмах микроРНК не было типичных miRNA, полученных из клеток крови (miR-20a, miR-106a, miR-185 и miR-144).
Выводы
1. Предпринятые большие исследовательские усилия для выявления негенетических факторов, которые можно было бы использовать для прогнозирования риска наличия ИА, позволяют утверждать, что сегодня существуют достаточно легко определяемые высокочувствительные и специфичные биохимические маркеры в виде микроРНК, которые участвуют в молекулярных и клеточных процессах образования и прогрессии ИА.
2. Понимание биологического значения дифференциальной экспрессии микроРНК при ИА важно для создания экономически эффективных скрининговых тестов в целях выявления бессимптомных ИА, особенно в популяции со значительно повышенным риском (например, членов семей первой степени родства пациентов с ИА и САК).
3. Идентификация надежных биомаркеров микроРНК позволит в клинической практике прогнозировать поведение ИА, выявлять на дооперационном этапе аневризмы, склонные к росту, разрыву и рецидивированию после микрохирургического и эндоваскулярного лечения, что позволит создать оптимальную хирургическую стратегию лечения, в том числе с использованием высокотехнологичных реконструктивных методик.
Библиографическая ссылка
Рожченко Л.В., Бобинов В.В., Горощенко С.А., Петров А.Е., Самочерных К.А. КЛЕТОЧНЫЕ, ГЕНЕТИЧЕСКИЕ И ЭПИГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РОСТА ЦЕРЕБРАЛЬНЫХ АНЕВРИЗМ // Современные проблемы науки и образования. – 2021. – № 2. ;URL: https://science-education.ru/ru/article/view?id=30560 (дата обращения: 20.04.2024).



