Жировое повреждение паренхиматозных органов пищеварительной системы является основным отягощающим следствием неправильного питания и ожирения. Ожирение значительно увеличивает риск развития неалкогольной жировой болезни печени (НАЖБП) и поджелудочной железы (НЖБ ПЖ). Проблема ожирения приобретает глобальные масштабы пандемии, что, в свою очередь, оказывает большое влияние на развитие и распространенность заболеваний паренхиматозных органов пищеварительной системы. По данным Всемирной организации здравоохранения в 2016 г. более 1,9 млрд взрослых имели избыточный вес, из них свыше 650 млн страдали ожирением. Нарушение структуры питания и малоподвижный образ жизни служат основными триггерами развития ожирения и сопутствующих ему заболеваний органов пищеварения. Однако патогенетические механизмы, лежащие в основе развития жирового перерождения паренхиматозных органов пищеварительной системы, не ограничиваются только социальными факторами, а являются многогранными и комплексными.
В частности, к формированию указанных патологий, а также к их прогрессированию приводит активация процессов перекисного окисления липидов при недостаточной антиоксидантной защите [1]. Одной из причин развития окислительного стресса и усиления свободнорадикальных реакций в железах пищеварительной системы служит истощение активности синтеза глутатиона и сопряженных с ним ферментов [2]. Глутатион-зависимая антиоксидантная система поддерживает тиол-дисульфидный гомеостаз за счет необходимого баланса глутатиона и функционально связанных ферментов, включая глутатион-S-трансферазу, глутатионпероксидазу и глутатионредуктазу [3]. Печень имеет приоритетное значение в метаболизме глутатиона, удаляя резорбированный цистеин из портального кровотока и превращая его в менее реактивный глутатион, который возвращается в кровоток. Поскольку печень играет центральную роль в межорганном гомеостазе глутатиона, ее дисфункция может влиять на эндогенную продукцию и использование глутатиона и, возможно, в дальнейшем приводить к нарушению регуляции глутатион-зависимой антиоксидантной системы [4].
Поддержание необходимого тиол-дисульфидного гомеостаза является важным фактором физиологической редокс-регуляции клеточной сигнализации и апоптоза [5]. Многочисленные исследования доказали важность коррекции тиол-дисульфидного баланса при жировом повреждении печени, однако недостаточно сведений о состоянии редокс-системы глутатиона в динамике формирования заболеваний паренхиматозных органов пищеварительной системы. Жировое повреждение печени и поджелудочной железы являются ассоциированными заболеваниями, которые, возможно, влияют друг на друга в отношении начала и их прогрессирования. Интересным является также установление взаимосвязанной роли редокс-статуса печени и поджелудочной железы в условиях ожирения.
Цель исследования – изучить состояние тиол-дисульфидного звена антиоксидантной системы по уровню глутатиона и активности глутатионовых ферментов в печени и поджелудочной железе у крыс линии Вистар в динамике развития их жирового повреждения.
Материал и методы исследования. Эксперимент осуществляли на 30 половозрелых крысах-самцах линии Вистар в возрасте 6 месяцев и начальной массой 172±5 г. Ожирение и жировое повреждение органов пищеварительной системы у крыс формировали в течение 12–24 недель высококалорийным рационом, богатым животными жирами и холестерином [6]. Все манипуляции с животными и их эвтаназию осуществляли согласно правилам лабораторной диагностики (GLP), требованиям Европейской конвенции по защите экспериментальных животных 86/609 ЕЕС, приказам МЗ РФ № 267 от 19.06.2003 г. и МЗ СССР № 755 от 12.08.1977 г. Экспериментальное исследование было одобрено локальным этическим комитетом Научно-исследовательского института медицинской климатологии и восстановительного лечения (протокол № 6 от 20.12.2018 г).
Животные были разделены на 3 группы: интактная группа крыс находилась на стандартном рационе питания (10 крыс); опытная группа 1 – крысы содержались на экспериментальном рационе в течение 12 недель (10 крыс) и опытная группа 2 (10 крыс) – 24 недели соответственно. После декапитации животных печень и поджелудочная железа извлекались и взвешивались. Состояние редокс-системы глутатиона печени и поджелудочной железы оценивали по содержанию восстановленного глутатиона (ГЛ), активности глутатионредуктазы (ГР), глутатионпероксидазы (ГП). Определение ГЛ проводили колориметрическим методом (ArborAssays, USA). Активность ГР и ГП в паренхиматозных органах пищеварительной системы оценивали иммуноферментным методом (Northwest Life Science Specialties, LLC, USA).
Для подтверждения жирового повреждения паренхиматозных органов пищеварительной системы проводили гистологическое исследование печени и поджелудочной железы на препаратах, окрашенных гематоксилин-эозином по Романовскому. Морфологию тканей анализировали при помощи микроскопа фирмы «Carl Zeiss» (Германия). Статистическую обработку результатов осуществляли в программе Statistika 10.0. Вычисляли среднее арифметическое значение (М), ошибку среднего арифметического значения (m) и представляли в виде M±m. Статистическую значимость различий средних величин определяли с помощью критерия Стьюдента после проверки на нормальность распределения.
Результаты исследования и их обсуждение. Подтверждением развития ожирения у крыс опытных групп стало интенсивное увеличение общей массы тела (табл. 1). Так, масса крыс опытной группы 1, находящихся на высококалорийном рационе в течение 12 недель, увеличивалась на 189,2±11,3 г. Через 24 недели эксперимента масса животных опытной группы 2 возрастала на 299,5±6,1 г. Развитие ожирения у крыс характеризовалось увеличением массы органов пищеварительной системы. По сравнению с интактной группой масса печени возрастала в 1,7 раза через 12 недель эксперимента и в 2,8 раза на 24-й неделе алиментарной жировой нагрузки (p<0,001). Масса поджелудочной железы у крыс опытной группы 1 увеличивалась в 2 раза, у крыс опытной группы 2 – в 3,2 раза относительно интактных животных (р<0,001).
Таблица 1
Масса печени и поджелудочной железы крыс с ожирением, M±m
|
Масса |
Интактная группа |
Опытная группа 1 |
Опытная группа 2 |
|
Общая масса тела крысы |
172,2±5,3 |
361,5±12,7*** |
471,9±69,1** |
|
Печень, г |
9,1±0,3 |
16,2±1,0*** |
27,9±4,1*** |
|
Поджелудочная железа, г |
3,5±0,1 |
7,0±0,3*** |
11,2±0,2*** |
Примечание здесь и в таблице 2: (*) – статистическая значимость различий относительно интактной группы:
* – р<0,05; ** – р<0,01; *** – р<0,001.
Полученные данные свидетельствуют, что воздействие на крыс высококалорийным рационом в течение 12–24 недель приводит к развитию ожирения и гипертрофии паренхиматозных органов пищеварительной системы.
Гистологический анализ поджелудочной железы и печени у крыс при формировании ожирения выявил значительные изменения морфологии органов в сравнении с крысами интактной группы. Через 12 недель развития жирового повреждения в тканях поджелудочной железы у крыс опытной группы 1 наблюдались признаки жировой инфильтрации панкреатических клеток, что характеризовало формирование стеатоза (рис. 1а). На препаратах печени обнаруживались признаки стеатогепатита в виде жировой дистрофии гепатоцитов в сочетании с фокальными участками некроза ткани (рис. 1б). Исследование морфологии тканей паренхиматозных органов пищеварительной системы крыс опытной группы 2 выявило очаги некроза с воспалительно-клеточной инфильтрацией и нарушение дольчатого строения тканей, формирование фиброзной трансформации как в поджелудочной железе, так и в печени (рис. 1в, 1г).
а) 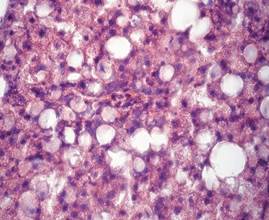 б)
б) 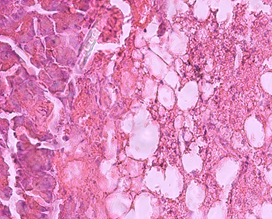
в) 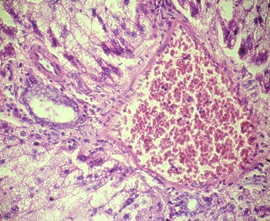 г)
г) 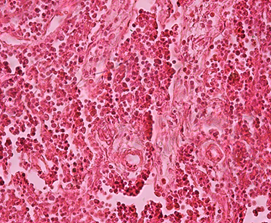
Гистологическое строение печени и поджелудочной железы у крыс с жировым повреждением: а) печень крысы опытной группы 1; б) печень крысы опытной группы 2; в) поджелудочная железа крысы опытной группы 1; г) поджелудочная железа крысы опытной группы 2. Окраска гематоксилин-эозином. Ув. ок. х15, ув. об. х40
Активность редокс-системы глутатиона в печени крыс опытной группы 1 через 12 недель жирового повреждения характеризовалось незначительным снижением количества восстановленного глутатиона (р<0,01), тогда как активность ГП и ГР уменьшалась в 2,5 и 4,5 раза (р<0,001) соответственно относительно животных интактной группы (табл. 2).
Таблица 2
Динамика изменений показателей редокс-системы глутатиона в печени и поджелудочной железе крыс с ожирением, M±m
|
Показатели |
Интактная группа |
Опытная группа 1 |
Опытная группа 2 |
|
Печень |
|||
|
Глутатион, мкг/мг белка |
7,12±0,13 |
5,21±0,17*** |
4,10±0,14*** |
|
Глутатионредуктаза, нмоль НАДФН/мин/мг белка |
3,91±0,13 |
1,45±0,11*** |
0,98±0,04*** |
|
Глутатионпероксидаза, нмоль ГЛ /мин/мг белка |
2,63±0,03 |
1,09±0,02*** |
0,92±0,02*** |
|
Поджелудочная железа |
|||
|
Глутатион, мкг/мг белка |
5,40±0,17 |
3,61±0,21** |
2,71±0,16*** |
|
Глутатионредуктаза, нмоль НАДФН/мин/мг белка |
2,10±0,13 |
1,36±0,09*** |
1,20±0,06*** |
|
Глутатионпероксидаза, нмоль ГЛ /мин/мг белка |
3,79±0,19 |
2,53±0,13*** |
1,73±0,18*** |
Через 24 недели эксперимента у крыс опытной группы 2 наблюдалось угнетение всех компонентов глутатионового звена в печени. Концентрация ГЛ в печени снижалась в 2 раза (р<0,001), активность ГП и ГР – в 3 и 5 раз соответственно (р<0,001) по сравнению с интактными животными. Похожая динамика изменения активности редокс-системы глутатиона наблюдалась и в поджелудочной железе. Установлено, что на 12-й неделе формирования ожирения уровень глутатиона в поджелудочной железе крыс уменьшался на 49% (р<0,01) относительно интактных животных. Активность глутатионовых ферментов у крыс опытной группы 1 в данном органе снижалась на 35% для ГР и на 33% для ГП (р<0,001). Жировое повреждение пищеварительной железы в течение 24 недель значительным образом сказалось на тиол-дисульфидном статусе поджелудочной железы. Наблюдалось угнетение всех исследуемых параметров антиоксидантной защиты: уровень ГЛ снизился в 2 раза, активности ГР и ГП – в 1,7 и 2,1 раза соответственно относительно здоровых животных.
Заключение. Исследования жирового перерождения тканей печени и поджелудочной железы ведутся давно, но при обсуждении патогенетического механизма развития до сих пор существуют многочисленные споры о триггерах формирования и утяжеления заболеваний желез пищеварительной системы. Важную роль в прогрессировании заболевания и развитии фиброза при жировом повреждении паренхиматозных органов системы пищеварения играет окислительный стресс, триггерами которого являются липотоксичность, гипоксия, что выражается в секреции провоспалительных цитокинов, запуске процессов фиброгенеза и прогрессировании патологии. Дефицит активности систем антиоксидантной защиты может быть основным фактором прогрессирования жировой болезни печени и поджелудочной железы. Однако механизмы, лежащие в основе защитного действия антиоксидантов, нуждаются в изучении. Редокс-система глутатиона задействована в устранении продуктов перекисного окисления макромолекул, таких как липиды, белки. Современные результаты исследований предполагают, что ферментная редокс-система глутатиона может быть важной терапевтической мишенью для предотвращения прогрессирования и развития заболеваний паренхиматозных органов пищеварительной системы за счет уменьшения продукции воспалительных цитокинов, ингибирования продукции активных форм кислорода и, соответственно, реализации мощного антифиброзного эффекта.
Результаты нашего исследования показали, что нарушение тиол-дисульфидного гомеостаза и истощение компонентов глутатионового звена антиоксидантной системы происходят на начальных этапах жирового повреждения паренхиматозных органов пищеварительной системы. Прогрессирование повреждения печени и поджелудочной железы приводило к большему дефициту антиоксидантной защиты, проявившемуся в снижении уровня глутатиона и активности глутатионзависимых ферментов. Угнетение активности антиоксидантной защиты служит идеальным фактором для гиперпродукции реактивных форм кислорода, повышения липотоксичности, повреждения макромолекул, деструкции органелл и клеток [7]. Патогенетической основой жирового повреждения паренхиматозных органов пищеварительной системы является дисфункция глутатионового звена антиоксидантной защиты [8]. Интересно, что динамика изменений состояния тиол-дисульфидного звена имела однонаправленный характер как в печени, так и в поджелудочной железе. Полученные результаты исследования показывают тесную структурную и функциональную взаимосвязь между состоянием паренхиматозных органов пищеварительной системы при ожирении, что необходимо учитывать при разработке диагностических и лечебных программ.
Библиографическая ссылка
Денисенко Ю.К., Бочарова Н.В., Ковалевский Д.А., Новгородцева Т.П., Кытикова О.Ю. СОСТОЯНИЕ ТИОЛ-ДИСУЛЬФИДНОГО ЗВЕНА СИСТЕМЫ АНТИОКСИДАНТНОЙ ЗАЩИТЫ ПРИ ЖИРОВОМ ПОВРЕЖДЕНИИ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ // Современные проблемы науки и образования. – 2021. – № 3. ;URL: https://science-education.ru/ru/article/view?id=30790 (дата обращения: 25.04.2024).



