Известно, что реакция с активированными азометинами в присутствии ацетата серебра протекает по типу [2+3]-циклоприсоединения. В работах [1; 2] сообщается, что взаимодействие 3-арилметилиден-3Н-фуран-2-онов с N-бензилиденбензиламином приводило к образованию спиропирролидина.
Результаты и их обсуждение
Учитывая, что еноновый фрагмент пиррол(фуран)-2-онов жестко закреплен и имеет плоское строение, указанные субстраты могут участвовать не только в реакциях [3+2]-циклоприсоединения, но и выступать в роли диполярофилов реакции [4+2]-циклоприсоединения [3]. Примером такого поведения арилметилиденовых производных пиррол(фуран)-2-онов является ранее исследованная реакция с малеиновым ангидридом.
В настоящей работе показано, что введение нитрогруппы в арилметилиденовый фрагмент приводит к изменению пути реакции и образованию продуктов [4+2]-циклоприсоединения - 4-(нитрофенил)-2-фенил-6-Ar-4,4a,7,7a-тетрагидропирроло[3,2-e][1,3]оксазинов 2а-e.
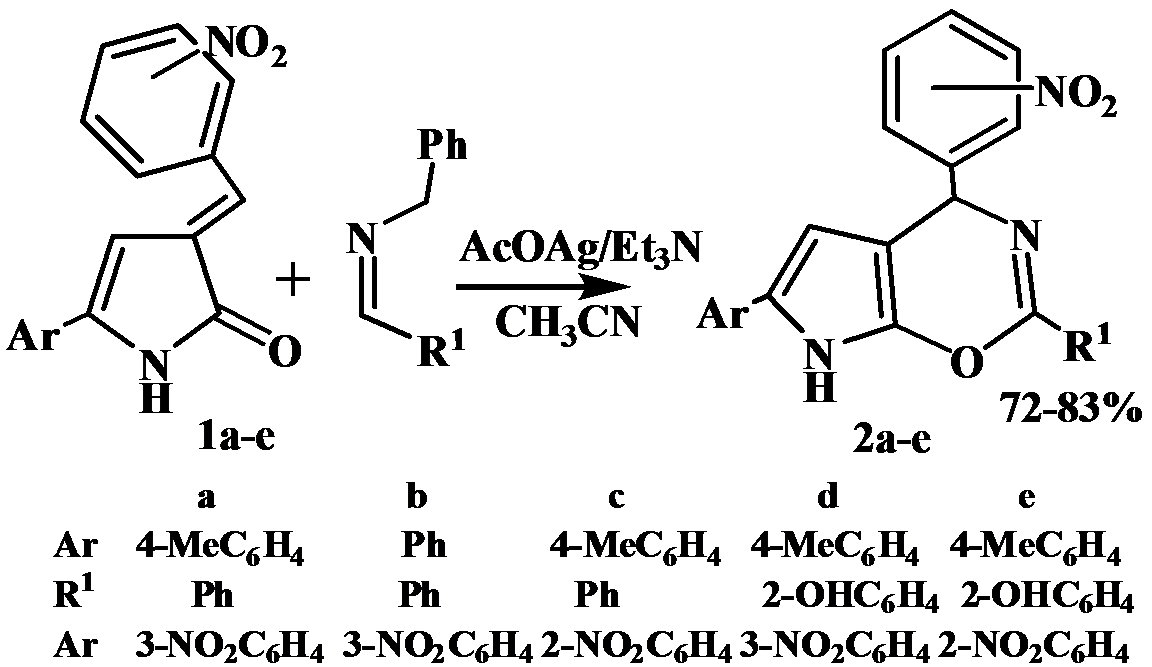
В данном случае реализуется альтернативное направление протекания реакции - реакция Дильса-Альдера. Наличие активированного енонового фрагмента, жестко закрепленного в молекуле 3-арилметилиден-3Н-пиррол-2-онов, обеспечивает возможность использования их в реакциях диенового синтеза.
Состав и строение соединений 2а-e. подтверждены данными элементного анализа, ИК, ЯМР 1Н и 13С спектроскопии.
В ИК-спектрах соединений м отсутствует полоса поглощения, характерная для вторичной аминогруппы, отмечены полосы валентных колебаний карбонильной группы в области 1698-1695 см-1, нитрогруппы при 1516-1507 см-1 (nNO2as), 1345-1342 см-1 (nNO2s).
В спектрах ЯМР 1Н соединений 2а-e. присутствуют: синглет протона третичного атома углерода в области 5.76-5.87 м.д., мультиплет протонов ароматических колец в области 6.94-8.31 м.д., а также сигнал протонов метильной группы при 2.34 м.д. для соединений 2а,c-e, а также мультиплет протонов ароматических колец.
В спектре ЯМР 13С соединений 2а-e. в сильном поле отмечены: сигнал третичного атома углерода и сигнал метильной группы. В слабом поле присутствуют серия сигналов атомов углерода ароматических колец и сигналы атомов углерода бицикла. Для соединений 2d,e. отмечен сигнал атома углерода при гидроксильной группе.
Особенность протекания данного взаимодействия можно объяснить влиянием нитрогруппы. Вероятно, ион серебра за счет электростатических взаимодействий притягивается к нитрогруппе арилметилиденового фрагмента, образуя контактную ионную пару с атомом кислорода. Таким образом, катион серебра оказывается связанным, не участвует в процессе реакции как катализатор, вследствие этого активации N-бензилиденбензиламина не происходит, заряженной 1,3-диполярной частицы не образуется. В данном случае реализуется альтернативное направление протекания реакции - гетерореакция Дильса-Альдера. Предполагаемую схему реакции можно представить следующим образом:
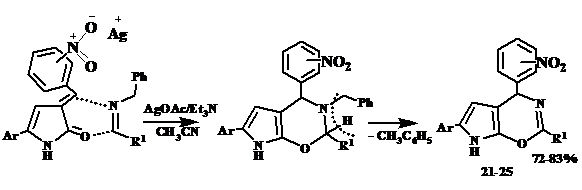
Взаимодействие между 3-арилметилиден-3Н-пиррол-2-оном и N-бензилиденбензиламином протекает по механизму [4+2]-циклоприсоединения, азометин присоединяется по еноновому фрагменту пиррол-2-онов, жестко закрепленному в s-цис-конфигурации, что сопровождается отщеплением молекулы толуола и образованием оксазиновой структуры.
Таким образом, основываясь на проведенных синтетических экспериментах, можно полагать, что применяемый нами подход дает возможность получать как стерически перегруженные спирогетероциклические структуры [2; 3; 7], с β-расположением атома N, имеющих сочлененные пирролиноновый(фураноновый) и пирролидиновый циклы, так и бициклические гетероатомные системы [5].
Экспериментальная часть
Контроль за ходом реакции, качественный анализ состава реакционных смесей, определение индивидуальности и идентификация выделяемых соединений осуществлялись с помощью тонкослойной хроматографии, элементного анализа ИК, ЯМР 1Н спектроскопии.
ИК-спектры снимали на ИК Фурье-спектрометре ФСМ-1201 в вазелиновом масле, в таблетках KBr.
Спектры ЯМР записаны на приборах Varian MSL-400 при 20-25 °С. Рабочая частота для спектров ЯМР1Н - 400 МГц, внутренний стандарт - тетраметилсилан, растворители - дейтерохлороформ, диметилсульфоксид-d6.
4-Ar1-2-R1-6-Ar-4,7-дигидропирроло[3,2-e][1,3]оксазины 2а-e. (Общая методика.) К 0.002 моль N-бензилиденбензиламина, растворенного в 18 мл ацетонитриле, добавляют 0,002 моль 3-арилметилиден-3Н-пиррол-2-онов 2 а-с [4], 0,002 моль триэтиламина и 15% (мольных) ацетата серебра. Реакционную смесь нагревают при постоянном перемешивании до растворения исходных реагентов, после этого выдерживают при комнатной температуре в течение 2-3 дней. Отфильтровывают осадок, нейтрализуют хлоридом аммония, органический слой отделяют, упаривают растворитель. Полученные кристаллы перекристаллизовывают из хлороформа.
4-(3-нитрофенил)-2-фенил-6-(4-метилфенил)-4,7-дигидропирроло[3,2-e][1,3]оксазин 2а. Синтез проводят с использованием 1.63 мл (0,002 моль) 3-нитрофенилиден-3Н-пиррол-2-она. Получают 0.64 г (73%) соединения 2а. Т.пл. 207-209оС. Элем. Анализ: C25H19N3O3: Вычислено С, 72.98; Н, 5.14; N, 10.21. Найдено: С, 73.09; Н, 5.11; N, 10.28.. ИК (KBr), n(max): 1702 (C=O), 1616 (C=C ), 1507, 1342 (NO2), 3171 (NH), 1537 (C - N), 3027-2929 (CH) cm-1. ЯМР1Н (400 MHz, CDCl3): d 2.34 ( с, 1H), 5.71 (с, 1H), 6.45 (с, 1Н), 8.74 (с, 1H), 7.29-8.07 (м, 13H). ЯМР13С (400 MHz, CDCl3) (м.д.): d 22.31, 52.48, 103.21, 117.83, 119.57, 140.20, 146.04, 148.37
4-(3-нитрофенил)-2,6-фенил-4,7-дигидропирроло[3,2-e][1,3]оксазин 2b. Синтез проводят с использованием 1.57 мл (0,002 моль) 2-нитрофенилиден-3Н-пиррол-2-она. Получают 0.54 г (67%) соединения 2b. Т.пл. 210-211оС. Элем. Анализ: C24H17N3O3: Вычислено С, 72.53; Н, 4.82; N, 10.57. Найдено: С, 72.69; Н, 5.71; N, 10.43.. ИК (KBr), n(max): 1698 (C=O), 1626 (C=C ), 1510, 1345 (NO2), 3175 (NH), 1540 (C - N), 3032-2919 (CH) cm-1. ЯМР1Н (400 MHz, CDCl3): 5.76 (с, 1H), 6.56 (с, 1H), 8.57 (с, 1Н), 7.41-8.12 (м, 14H). ЯМР13С (400 MHz, CDCl3) (м.д.): d 22.35, 53.41, 106.74, 118.31, 126.36, 140.27, 146.18, 149.04
4-(2-нитрофенил)-2-фенил-6-(4-метилфенил)-4,7-дигидропирроло[3,2-e][1,3]оксазин 2с. Синтез проводят с использованием 1.64 мл (0,002 моль) 2-нитрофенилиден-3Н-пиррол-2-она. Получают 0.72 г (71%) соединения 2с. Т.пл. 206-207оС.. Элем. Анализ: C25H19N3O3: Вычислено С, 72.98; Н, 5.14; N, 10.21. Найдено: С, 73.12; Н, 5.16; N, 10.43.. ИК (KBr), n(max): 1705 (C=O), 1619 (C=C ), 1505, 1339 (NO2), 3170 (NH), 1531 (C - N), 3025-2921 (CH) cm-1. ЯМР1Н (400 MHz, CDCl3): d 2.32 ( с, 1H), 5.68 (с, 1Н), 6.84 (с, 1H), 8.84 (с, 1H), 7.25-7.96 (м, 13H). ЯМР13С (400 MHz, CDCl3) (м.д.): d 22.37, 56.19, 107.84, 119.02, 136.94, 140.42, 146.84, 149.03
2-(2-гидроксифенил)-4-(3-нитрофенил)--6-(4-метилфенил)-4,7,-дигидропирроло[3,2-e] [1,3]оксазин 2d. Синтез проводят с использованием 1.64 мл (0,002 моль) 2-нитрофенилиден-3Н-пиррол-2-она. Получают 0.72 г (71%) соединения 2с. Т.пл. 206-207оС.. Элем. Анализ: C25H19N3O3: Вычислено С, 70.58; Н, 4.50; N, 9.88. Найдено: С, 70.32; Н, 4.46; N, 10.03.. ИК (KBr), n(max): 1705 (C=O), 1618 (C=C ), 1506, 1334 (NO2), 3171 (NH), 1531 (C - N), 3020-2915 (CH) cm-1. ЯМР1Н (400 MHz, CDCl3): d 2.32 ( с, 1H), 5.67 (с, 1Н), 6.79 (с, 1H), 8.85 (с, 1H), 7.23-7.96 (м, 13H). ЯМР13С (400 MHz, CDCl3) (м.д.): d 22.36, 53.04, 106.93, 117.92, 132.59, 140.37, 146.25, 149.01
2-(2-гидроксифенил)-4-(2-нитрофенил)--6-(4-метилфенил)-4,7,-дигидропирроло[3,2-e] [1,3]оксазин 2e. Синтез проводят с использованием 1.64 мл (0,002 моль) 2-нитрофенилиден-3Н-пиррол-2-она. Получают 0.72 г (71%) соединения 2с. Т.пл. 206-207оС.. Элем. Анализ: C25H19N3O3: Вычислено С, 70.58; Н, 4.50; N, 9.88. Найдено: С, 70.52; Н, 4.57; N, 9.64.. ИК (KBr), n(max): 1706 (C=O), 1620 (C=C ), 1510, 1335 (NO2), 3169 (NH), 1533 (C - N), 3026-2920 (CH) cm-1. ЯМР1Н (400 MHz, CDCl3): d 2.30 ( с, 1H), 5.65 (с, 1Н), 6.78 (с, 1H), 8.90 (с, 1H), 7.29-8.02 (м, 13H). ЯМР13С (400 MHz, CDCl3) (м.д.): d 22.34, 54.72, 107.85, 118.94, 119.87, 140.93, 146.46, 148.44
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 10-03-00640а).
Рецензенты:
- Гусакова Н.Н., д.х.н., профессор, зав. кафедрой химии, агрохимии и почвоведения, ФГБОУ ВПО «Саратовский государственный аграрный университет им. Н.И. Вавилова», г. Саратов.
- Решетов П.В., д.х.н., зав. кафедрой общей и биоорганической химии ГБОУ ВПО «Саратовский медицинский университет им. В.И. Разумовского» Минздравсоцразвития РФ, г. Саратов.
Работа получена 23.11.2011
Библиографическая ссылка
Транковский А.Б., Камнева И.Е., Егорова А.Ю. НЕОБЫЧНОЕ ПРОТЕКАНИЕ РЕАКЦИИ ЦИКЛОПРИСОЕДИНЕНИЯ АЗОМЕТИНОВ К АРИЛМЕТИЛИДЕН-3Н-ПИРРОЛ-2-ОНАМ // Современные проблемы науки и образования. – 2011. – № 6. ;URL: https://science-education.ru/ru/article/view?id=4992 (дата обращения: 20.04.2024).



