Целью нашей работы было определение изменения КСС сыворотки крови пациентов, перенесших плановое АКШ, в течение послеоперационного периода.
Материалы и методы. В исследование были включены 12 пациентов, госпитализированных в ГУЗ «Волгоградский областной клинический кардиологический центр» для планового проведения АКШ. Всем пациентам проводилось АКШ по показаниям при наличии стеноза 50% и более хотя бы одной коронарной артерии. Забор венозной крови производился за 1-3 дня до операции, на 3-й день после операции и перед выпиской (медиана неосложненного послеоперационного периода 15,5; 95% доверительный интервал (ДИ) [14-18] дней, срок госпитализации свыше 20 дней был у 1 пациента). Из образцов крови получали сыворотку и замораживали при -20 °С до дня проведения анализа. Все биохимические анализы проводились в течение 2 ч после оттаивания образцов сыворотки. Повторное замораживание образцов не допускалось.
Исследование проведено с соблюдением всех этических норм.
В исследуемых образцах сыворотки проводилось определение КСС по разработанному нами протоколу [1]. Метод основан на способности сывороточного альбумина связывать Со2+ [3], при этом содержание свободных Со2+ можно определить по образованию окрашенного комплекса с дитиотрейтолом (ДТТ) [4]. Определение проводилось следующим образом. 60 мкл 2,5 мМ СоSO4 смешивали с 600 мкл 0,85% хлорида натрия, затем добавляли 200 мкл сыворотки. После пятиминутной инкубации при комнатной температуре приливали 250 мкл реактива, содержащего 7 мМ ДТТ, 25 мМ HEPES/KOH, рН 7,4, и 0,85% NaCl. Строго через 2 мин измеряли оптическую плотность при длине волны 495 нм против холостой пробы, не содержавшей сыворотки и раствора соли кобальта, на двухлучевом спектрофотометре Thermo Fisher Sсientific Helios α. В качестве калибратора использовали растворы сульфата кобальта с различной концентрацией. КСС выражали в ммоль Со2+/л сыворотки. Предел обнаружения (limit of detection, LOD) и предел надежного количественного обнаружения (limit of quantification, LOQ), рассчитанные в соответствии с рекомендациями Международной конференции по гармонизации (The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use, ICH) [6], составили 0,000569 и 0,001724 ммоль Со2+/л. Аналитическая вариабельность, рассчитанная как коэффициент вариации, в условиях повторяемости не превышала 3%, в условиях воспроизводимости 2,3%.
В образцах крови пациентов дополнительно определяли уровень гемоглобина на автоматическом гематологическом анализаторе фирмы Sysmex kx-21n.
Все статистические расчеты проводили с использованием пакета программ Statistica 6.0 (StatSoft, Inc., США).
Результаты и обсуждение. Поскольку хирургическое вмешательство предполагает усиление гипоксии миокарда, мы проанализировали образцы сыворотки, взятые перед проведением операции и на 3-5-е сутки после АКШ (рис. 1). Было обнаружено статистически значимое снижение КСС на 3-5-й день после АКШ (р<0,009, по критерию Вилкоксона с поправкой Бонферрони), что говорит о повышении ИМА и о наличии ишемии миокарда, которая сохраняется в указанном послеоперационном периоде.
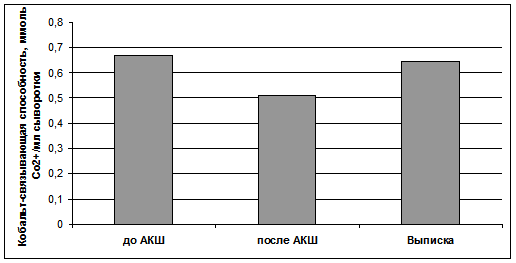
Рис. 1. Динамика изменения кобальт-связывающей способности сыворотки крови пациентов до и после аортокоронарного шунтирования (в послеоперационном периоде). Результаты представлены в виде медиан, 95% ДИ для КСС до АКШ составил 0,582-0,906; после АКШ - 0,455-0,641; выписка - 0,536-0,684 ммоль Со2+/мл сыворотки.
В послеоперационном периоде произошло повышение уровня КСС сыворотки крови с 0,51 95% ДИ [0,455-0,641] ммоль Со2+/л до 0,644 95% ДИ [0,536-0,684] ммоль Со2+/л на момент выписки. Различия между представленными данными статически значимы (р < 0,009, по критерию Вилкоксона с поправкой Бонферрони). Следовательно, в течение послеоперационного периода уровень миокардиальной ишемии снижается, а снабжение миокарда кислородом нормализуется. При этом надо отметить, что величина КСС на момент выписки пациента не отличалась от исходного уровня.
Результаты определения гемоглобина крови показали, что в раннем постоперационном периоде наблюдалось статистически значимое снижение его уровня (p<0,007, по критерию Вилкоксона с поправкой Бонферрони) (рис. 2).
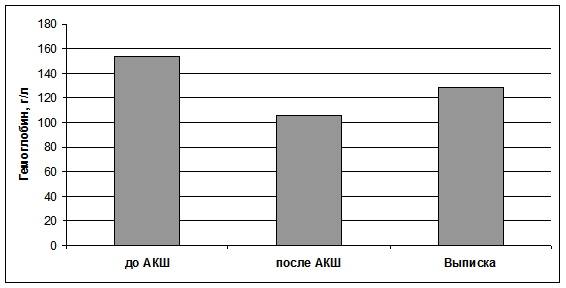
Рис. 2. Динамика изменения гемоглобина крови пациентов до и после аорто-коронарного шунтирования (в послеоперационном периоде). Результаты представлены в виде медиан, 95% ДИ для гемоглобина до АКШ составил 144-164; после АКШ - 103-114,8; выписка - 119-139 г/л.
К концу реабилитации наблюдалась неполная нормализация показателя, в отличие от КСС (наблюдались достоверные отличия от послеоперационного и базового уровня показателя - р = 0,01 для обоих случаев). Согласно одному из основных уравнений оксиметрии снижение уровня гемоглобина на 50% ведет к снижению содержания кислорода крови вдвое [10]. В нашем случае статистически значимая разница в до- и послеоперационном уровнях гемоглобина составила 45,25 г/л (на 29,4%), что в свою очередь привело к снижению содержания молекулярного кислорода почти на 30% и, следовательно, к развитию гипоксемии. Уровень гипоксемии довольно значим, что говорит о весьма вероятном развитии анемической гипоксии.
Существует статистическая значимая связь между КСС и гемоглобином корреляции (R = 0,409, p < 0,015, критерий Спирмена).
Заключение. АКШ вызывает детектируемую лабораторными методами приходящую ишемию миокарда в раннем послеоперационном периоде. Однако к концу срока госпитализации лабораторный показатель содержания ИМА нормализуется. Мы считаем, что данный тест может использоваться для оценки вероятности развития ишемии миокарда и нормализации коронарного кровообращения в послеоперационном периоде. Повышение уровня ИМА прямо пропорционально связано со степенью анемии.
Библиографическая ссылка
Лопатин Ю.М., Литус Е.А., Зайцев В.Г., Островский О.В., Дронова Е.П., Подворчан М.А., Трифонова А.Н., Костерина Н.С. КОБАЛЬТ-СВЯЗЫВАЮЩАЯ СПОСОБНОСТЬ СЫВОРОТКИ КРОВИ КАК МАРКЕР ИШЕМИИ МИОКАРДА У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ // Современные проблемы науки и образования. – 2011. – № 6. ;URL: https://science-education.ru/ru/article/view?id=5114 (дата обращения: 19.04.2024).



