После формирования артериовенозной фистулы (АВФ) у пациентов с хронической почечной недостаточностью, в терминальной стадии (ТХПН), нередко в дистальной части прооперированной конечности наблюдаются серьезные ишемические осложнения. Клинически значительное ухудшение кровотока обнаруживается у 8-10 % пациентов, перенесших операцию по формированию постоянного сосудистого доступа (ПСД) [4,8]. В большинстве случаев после формирования АВФ в нижней трети предплечья по типу «конец v. cephalica - бок a. radialis» в дистальной части лучевой артерии регистрируется ретроградный кровоток [9]. Однако, изменение направления кровотока в лучевой артерии дистальнее анастомоза, не является непосредственной причиной ишемии конечности. Нередко тяжелые формы ишемии выявляются при функционирующей низкопотоковой АВФ, а также - при антеградном кровотоке в дистальной части a. radialis [5]. Механизмы развития ишемии тканей после формирования АВФ недостаточно изучены. В литературе практически нет данных о состоянии сосудов микроциркуляторного русла, параметрах и механизмах регуляции микрокровотока в дистальной части конечности после формирования АВФ.
Цель исследования
Задача настоящего исследования заключалась в получении методом лазерной допплеровской флоуметрии (ЛДФ) [1,2] информации о состоянии микрокровотока в коже кисти пациентов с ТХПН до и после формирования у них АВФ и сопоставлении полученных данных с результатами исследования объемной скорости кровотока в крупных сосудах предплечья.
Материал и методы
Обследовано 152 пациента в возрасте от 33 до 67 лет (81 мужчина и 71 женщина) с ХПН в терминальной стадии. Пациенты были направлены нефрологическим центром Санкт-Петербурга в городские клинические больницы № 4 и № 31 для создания ПСД. У пациентов была сформирована АВФ в нижней трети предплечья по типу «конец v. cephalica - бок a. radialis». Первое исследование проводилось за 1-2 дня до формирования АВФ, второе - по окончании операции, последующие - через 1 неделю, 1, 2, 4 и 12 месяцев после формирования АВФ. Для оценки скорости кровотока в артерии и вене применяли стационарный цветной УЗИ-сканер Vivid 3 с линейным датчиком с частотой сканирования 7 МГц с использованием триплексного режима. Исследование микрокровотока в коже кисти проводили при помощи одноканального лазерного анализатора кровотока ЛАКК-02, исполнение 4. Регистрировали параметры микроциркуляции крови в коже подушечки второго пальца руки [3], на которой планировалась, а в последующем, формировалась АВФ. Для регистрации ЛДФ-грамм и анализа их амплитудно-частотных характеристик применяли прилагаемое к аппарату стандартное программное обеспечение, работающее в операционной системе Windows XP. Обработку полученных результатов проводили с помощью про-граммы StatSoft STATISTICA 6.1.478. Полученные данные представлены в виде средних значений с их стандартным отклонением (M±SE). При обработке полученных результатов для установления достоверности различий между данными, полученными в разные сроки после формирования АВФ, использо-вали критерий t-Стьюдента и критерий Манна-Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
В табл. 1 представлены усредненные результаты исследования кровотока в a. radialis и v. cephalica у 118 пациентов, у которых после наложения анастомоза сформировалась зрелая АВФ, и им проводилось лечение программным гемодиализом. У 34 пациентов на протяжении 2-4 месяцев наблюдения были выявлены признаки нефункционирующей АВФ, им в последующем были сформированы повторные АВФ в других сосудистых областях. Данные, полученные при обследовании пациентов этой группы, были исключены из анализа и статистической обработки.
Таблица 1. Объемная скорость кровотока в a. radialis и v. cephalica до формирования АВФ и в разные сроки функционирования АВФ
|
Объемная скорость кровотока |
До операции |
В конце операции |
1 неделя |
1 мес |
2 мес |
4 мес |
12 мес |
|
A. radialis ( выше анастомоза), мл/мин |
27,8± 4,14 |
68,4±8,22 |
250,5± 47,28 |
355± 84,23 |
426,3± 148,6 |
470,4± 163,4 |
532,4± 193,3 |
|
A. radialis (ниже анастомоза), мл/мин |
-8,41± 5,11 |
-19,9± 7,53 |
-81,5± 23,48 |
-92,3± 37,31 |
-96,1± 43,27 |
-99,8± 46,88 |
|
|
V. cephalica , мл/мин |
19,3± 4,18 |
77,9± 10,11 |
267,4± 63,11 |
432,3± 107,1 |
521,7± 167,1 |
582,4± 185,4 |
624,2± 202,4 |
Примечание: «-» во второй строке означает ретроградное направление кровотока в дистальной части лучевой артерии.
После формирования АВФ характер кровотока в лучевой артерии существенно изменялся: в проксимальной ее части средняя объемная скорость кровотока возрастала в несколько раз, а в дистальной части у 87 % пациентов кровоток изменил направление с антеградного на - ретроградный. На протяжении первой недели функционирования АВФ наблюдался наибольший прирост скорости объемного кровотока, а к 4 месяцам кровоток по АВФ практически достигал максимума (табл. 1). Спустя 4 месяца после формирования АВФ у 93 % пациентов объемная скорость кровотока по АВФ представляла собой сумму объемной скорости кровотока по проксимальной части a. radialis и объемной скорости ретроградного кровотока по ее дистальной части, у 7 % пациентов объемная скорость кровотока по АВФ была меньше объемной скорости кровотока по проксимальной части a. radialis в связи с антеградным направлением кровотока в ее дистальной части. Кровоток по зрелой радиоцефалической фистуле (функционирующая фистула старше 4 мес.) значительно варьировал: от 400 до 900 мл/мин. Рекомендуемые в литературе величины кровотока для дистальной АВФ находятся в достаточно большом диапазоне (500-1000 мл/мин) [9]. Такая величина объемного кровотока по АВФ обеспечивает необходимый кровоток через диализатор, но не гарантирует сохранность чувствительных и двигательных функций дистальной части прооперированной конечности.
Поскольку крупные кровеносные сосуды выполняют функцию коллекторов и не участвуют в обмене веществ между кровью и тканями, представлялось интересным оценить после формирования АВФ изменения и характер кровотока в сосудах микроциркуляторного русла в тканях дистальнее анастомоза [2,6]. Было установлено, что показатель микроциркуляции в коже подушечки второго пальца к концу первой недели функционирования АВФ снизился на 25 % от исходной величины. По мере функционирования АВФ показатель микроциркуляции продолжал снижаться и через 12 месяцев после формирования АВФ составил около 46 % - от исходного (табл. 2).
Таблица 2 Показатели микроциркуляторного кровотока в коже кисти пациентов с ТХПН до и после формирования артериовенозной фистулы
|
Показатель |
До операции |
Через 1 неделю |
Через 1 мес |
Через 2 мес |
Через 4 мес |
Через 12 мес |
|
Показатель микроциркуляции, пф. ед. |
17,47± 5,38 |
13,18± 4,58* |
11,62± 4,78* |
10,44± 3,63* |
9,46± 3,92* |
8,08± 3,43* |
|
Среднеквадратическое отклонение, пф. ед. |
1,69±0,81 |
1,64± 0,61 |
1,58± 0,71 |
1,54± 0,62 |
1,53± 0,57* |
1,50± 0,62* |
|
Амплитуда нейрогенных колебаний, пф. ед. |
1,16±0,55 |
1,00± 0,42* |
0,93± 0,41* |
0,86± 0,43* |
0,81± 0,45* |
0,78± 0,40* |
|
Амплитуда миогенных колебаний, пф. ед. |
0,52±0,21 |
0,89± 0,33* |
1,08± 0,37* |
1,17± 0,42* |
1,27± 0,36* |
1,33± 0,42* |
|
Амплитуда эндотелийзависимых колебаний, пф. ед. |
1,32± 0,56 |
1,30± 0,63 |
1,28± 0,49 |
1,21± 0,55* |
1,19± 0,45* |
1,17± 0,43* |
|
Нейрогенный тонус, отн. ед. |
5,31±2,03 |
8,42± 2,31* |
9,04± 3,34* |
9,96± 3,77* |
10,94± 4,17* |
12,11± 4,22* |
|
Миогенный тонус, отн. ед. |
11,37± 3,88 |
8,83± 2,93* |
7,97± 2,55* |
7,26± 2,41* |
7,14± 2,31* |
7,03± 2,22* |
|
Эндотелийзависимый компонент тонуса, отн. ед. |
4,46±2,14 |
4,79± 2,36 |
4,97± 2,47* |
5,49± 2,81* |
5,80± 2,91* |
3,16* |
|
Показатель шунтирования, отн. ед. |
2,11±0,71 |
1,44± 0,51* |
1,11± 0,48* |
0,91± 0,44* |
0,74± 0,37* |
0,58± 0,21* |
Примечание: * - p<0,05.
Вейвлет-анализ позволил установить, что амплитуда нейрогенных колебаний в переменной составляющей ЛДФ-грамм после формирования АВФ снизилась, а нейрогенный тонус микрососудов исследуемой области за время наблюдения повысился с 5,31±2,03 до 12,11±4,22 отн. ед. Известно, что уменьшение амплитуды нейрогенных колебаний является индикатором увеличения сопротивления и уменьшения кровотока по артериоло-венулярным шунтам [1,10]. Полученные величины нейрогенного сосудистого тонуса в коже кисти у пациентов с АВФ позволяют сделать заключение об изменении функционального вклада нейрогенной регуляции в общую перфузию тканей, заключающегося в увеличении тонического напряжения гладких мышц артериоло-венулярных шунтов, ограничении кровотока по ним и перераспределении потока крови в микроциркуляторном русле, преимущественно в сосуды обменного типа.
Амплитуда миогенных колебаний сосудистого тонуса увеличилась сразу же после формирования у пациентов АВФ и возрастала на протяжении всего времени наблюдения, т.е. отмечалось выраженное увеличение вклада миогенного компонента в модуляцию микрокровотока (табл. 2). Известно, что возрастание миогенных колебаний в ЛДФ-грамме свидетельствует о снижении тонуса прекапиллярных сфинктеров, регулирующих приток крови в нутритивное русло [1,2]. Уменьшение тонуса прекапилляров наряду с увеличением нейрогенного тонуса создают условия для преимущественного потока крови через капилляры. Об усилении кровотока по капиллярам свидетельствует и динамика показателя шунтирования (табл. 2). Известно, что уменьшение показателя шунтирования меньше 1 означает поступление основного объема крови, проходящего через микроциркуляторное русло, в нутритивное звено микроциркуляции [1,7,10].
У 12 пациентов (7 мужчин и 5 женщин) на протяжении 4 месяцев после формирования АВФ были отмечены субъективные и объективные признаки синдрома «обкрадывания»: жалобы на парестезии, боли во время сеансов гемодиализа и вне сеансов, выраженное уменьшение мышечной силы. У 3 пациентов из этой группы кровоток по АВФ достигал максимальных величин, зарегистрированных в нашем исследовании (800-900 мл/мин), 5 пациентов имели кровоток в пределах 600-700 мл/мин; а у 4 пациентов с развившимся синдромом «обкрадывания» объемный кровоток через 4 месяца функционирования АВФ составлял менее 500 мл/мин. Было установлено, что у этих пациентов уже к концу 1 недели после формирования АВФ показатель микроциркуляции в коже кисти был достоверно меньше по сравнению со средней величиной показателя микроциркуляции в общей группе обследованных. Вейвлет-анализ ЛДФ-грамм пациентов с синдромом «обкрадывания» позволил выявить у них к концу 1 недели функционирования АВФ значительно более низкий нейрогенный компонент тонуса микрососудов (увеличился на 1,27 отн. ед.) по сравнению с аналогичным показателем в общей группе обследованных (увеличился на 3,11 отн. ед.) (рис 1).
В то же время миогенный компонент сосудистого у пациентов с синдромом «обкрадывания» статистически не отличался от аналогичного показателя в общей группе пациентов.
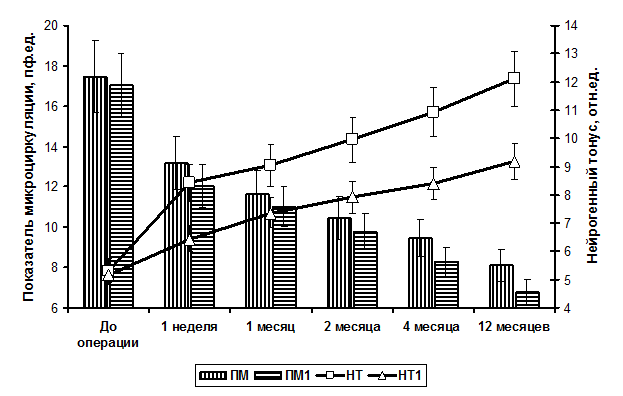
Рис. 1. Динамика показателя микроциркуляции (ПМ) и нейрогенного тонуса (НТ) микрососудов кожи кисти в общей группе обследованных и в группе пациентов с синдромом «обкрадывания» (ПМ1 и НТ1) на протяжении 12 месяцев наблюдения
Таким образом, после формирования АВФ и на протяжении всего времени ее функционирования, общий микрокровоток в тканях конечности дистальнее анастомоза существенно уменьшается, у некоторых пациентов до критической величины. При этом местные регуляторные механизмы сосудистого тонуса (нейрогенный и миогенный), вызывая констрикцию артериоловенулярных шунтов и дилатацию прекапиллярных сфинктеров, приводят к снижению показателя шунтирования в ткани и перераспределяют поток крови в микроциркуляторном русле таким образом, что большая его часть проходит через капилляры и принимает участие в обменных процессах в тканях. В итоге по капиллярам тканей ниже анастомоза поток крови снижается в значительно меньшей степени по сравнению с уменьшением общего микрокровотока в этих тканях.
При анализе показателей, характеризующих микрокровоток в коже ладони прооперированной конечности, в общей группе пациентов и в группе пациентов с развившимся синдромом «обкрадывания», прежде всего, следует отметить достоверные различия в величине показателя микроциркуляции и нейрогенного тонуса микрососудов. Причины выраженного ухудшения перфузии тканей ниже анастомоза в группе пациентов с развившимся синдромом «обкрадывания» этой неясны. Однако, более важными в данной группе пациентов, по нашему представлению, являются изменения нейрогенного тонуса микрососудов в прооперированной конечности. На протяжении всего времени наблюдения в группе пациентов с синдромом «обкрадывания» нейрогенных тонусов микрососудов был на 20-25 % меньше аналогичного показателя в общей группе обследованных. Низкий нейрогенный тонус микрососудов кожи приводит к преимущественному сбросу артериальной крови из артериол в венулы по артериоло-венулярным анастомозам [1,10], кровоток по капиллярам в условиях ухудшения перфузии тканей после формирования АВФ возрастает незначительно, что, наряду с уменьшением показателя микроциркуляции, может быть одной из основных причин развивающейся ишемии тканей дистальной части конечности.
Заключение
У части пациентов с ТХПН (по нашим данным, это около 10 %) возможности нервной регуляции микрокровотока в тканях дистальной части конечности по каким-то причинам ограничены и при формировании АВФ, приводящей к уменьшению перфузии тканей конечности ниже анастомоза, нервная регуляция не справляется с задачей ограничения кровотока через артериоловенулярные шунты. В итоге, слабая степень констрикции артериоло-венулярных шунтов на фоне уменьшения общего микрокровотока в тканях дистальной части конечности не обеспечивает необходимого увеличения капиллярного кровотока в тканях кисти, что способствует развитию синдрома «обкрадывания».
Рецензенты:
- Пантелеев С.С., д.б.н., заведующий лабораторией кортико-висцеральной физиологии Института физиологии им. И.П.Павлова РАН, г. Санкт-Петербург.
- Чурина С.К., д.м.н., профессор, заведующий лабораторией экспериментальной и клинической кардиологии Института физиологии им. И.П.Павлова РАН. г. Санкт-Петербург.
Библиографическая ссылка
Гурков А.С., Лобов Г.И. РЕГИОНАЛЬНАЯ ГЕМОДИНАМИКА ПОСЛЕ ФОРМИРОВАНИЯ АРТЕРИОВЕНОЗНОЙ ФИСТУЛЫ ДЛЯ ГЕМОДИАЛИЗА // Современные проблемы науки и образования. – 2011. – № 6. ;URL: https://science-education.ru/ru/article/view?id=5200 (дата обращения: 18.04.2024).



