Основным вопросом лечения инсомний в настоящее время является не столько недостаточная эффективность применяемых лекарственных средств, сколько недостаточная безопасность лечения этими препаратами [1]. Одним из главных представителей нового класса является золпидем, который широко и эффективно используется в медицинской практике за рубежом, а в последние годы и в России [3, 5].
Однако в связи с нежелательными побочными явлениями со стороны центральной нервной системы (спутанность сознания, эйфория и др.) может быть использовано в немедицинских целях. Немедицинское применение препарата и значительное превышение рекомендованных доз золпидема способно вызывать лекарственный делирий. Несмотря на сравнительно невысокий наркогенный потенциал [4], может вызывать пристрастия и присутствует в сфере незаконного оборота психоактивных веществ. При одновременном применении с препаратами, действующими на ЦНС, алкоголем, наблюдается взаимное усиление действия, что является причиной интоксикаций различной степени тяжести и даже отравлений [2, 7].
Для своевременной и объективной диагностики интоксикаций золпидемом, учитывая нехарактерность клинической картины, особое значение приобретают результаты химического анализа биологических жидкостей (моча, кровь).
Целью исследования явилась разработка и оптимизация методик экстракции, идентификации и количественного определения золпидема для его клинико-диагностических и химико-токсикологических анализов.
На первом этапе предварительного скрининга установлено, что из реакций с осадительными реактивами наиболее чувствительной является взаимодействие с реактивом Драгендорфа (0,57 мкг вещества в пробе). При изучении реакций окрашивания наиболее чувствительной является реакция с реактивом Марки (10 мкг в пробе). Обе реакции использованы для обнаружения зон локализации золпидема при ТСХ.
Далее исследована возможность идентификации золпидема методом ТСХ на пластинах Merck в индивидуальных растворителях и различных комбинированных системах растворителей, применяемых при ХТА лекарственных веществ в условиях аналитического скрининга. Для детектирования зон локализации золпидема на хроматограммах использовали:
- визуальное наблюдение пластинки в фильтрованном УФ-свете при λ=254 (темно-фиолетовые пятна, предел обнаружения 0,30 мкг) и при 365 нм (свечение, проявляющееся в виде сиреневой флуоресценции, предел обнаружения 0,18 мкг);
- обработку реактивом общегруппового назначения Драгендорфа в модификации по Молдаверу (коричневато-оранжевые пятна, предел обнаружения 0,35 мкг);
- обработку более специфическими реагентами: реактив Марки капельно (красно-оранжевое окрашивание, предел обнаружения 7,0 мкг).
Установлено, что в исследованных 11 индивидуальных растворителях (метанол, этанол, ацетон, хлороформ и др.) золпидем не обладает достаточной хроматографической подвижностью, оставаясь в основном вблизи стартовой линии.
При исследовании же в комбинированных системах растворителей хроматографическая подвижность золпидема проявляется в интервале Rf от 0,38 до 0,77, при значении 0,64 в общей универсальной скрининговой системе: толуол - ацетон - этанол - 25 % раствор аммиака, 45:45:7,5:2,5; и скрининговой для азотсодержащих соединений основного характера системе: диоксан - хлороформ - ацетон - 25 % раствор аммиака, 47,5:45:5:2,5 (Rf 0,67), которые были избраны нами в качестве базовых для ХТА золпидема.
Была исследована возможность доказательства и определения золпидема методами УФ-, ГХ/МС-спектроскопии и ВЭЖХ.
Исследование золпидема методом хромато-масс-спектроскопии проведено на хроматографе Agilent 6850, газохроматографическая колонка HP-5MS. Для обнаружения использован масс-селективный детектор (МСД) фирмы Hewlett-Packard. Газ?носитель - гелий. Скорость расхода газа-носителя 1,5 мл/мин. Ввод пробы ручной, без деления потока газа-носителя. Объем пробы 1 мкл в этаноле. МСД работает в режиме электронного удара при 70 эВ.
Время удерживания золпидема 9,65 мин. Проведена регистрация масс-спектров в режиме полного сканирования от 40 до 450 аем. Характеристические ионы при выделении фрагментограммы с временем удерживания 9,65 мин. - 235, 307, 219, 92 m/z (данные приведены в порядке уменьшения интенсивности). При сравнении с масс-спектрами библиотек совпадение времени удерживания и масс-спектра составляло 98%.
Количественное ГХ/МС определение проводили в тех же условиях, применяя метод внутреннего стандарта (метиловый эфир налидиксовой кислоты). Предел обнаружения - 10 нг/мл, предел определения - 25 нг/мл.
УФ-спектрофотометрия проведена на приборе Specord 40 М.
Для определения золпидема как соединения, содержащего хромофорные группы, использован метод УФ-спектрофотометрии. УФ?спектры поглощения стандартного раствора золпидема с концентрацией 18 мкг/мл снимались в 1 см кюветах в интервале длин волн 220?400 нм относительно чистого растворителя. Анализ электронных спектров в различных растворителях показал, что золпидем имеет УФ-спектры в полярных растворителях (вода, метанол, 0,1М раствор хлористоводородной кислоты), характеризующиеся одной полосой поглощения с двумя максимумами и одним минимумом.
При наличии ярко выраженного максимума абсорбции золпидема в 0,1М растворе хлористоводородной кислоты при 295 нм разработана спектрофотометрическая методика его определения. Подчинение основному закону светопоглощения от 4 до 32 мкг/мл золпидема. Коэффициент корреляции 0,9996. Удельный показатель 480. Чувствительность определения 0,21 мкг/мл.
Метод ВЭЖХ применен для идентификации и количественного определения золпидема на основе приборного комплекса «Милихром А-02» с УФ?детектором, стальной хроматографической колонкой диаметром 2 мм, длиной 75 мм, заполненной обращенно-фазным сорбентом марки Силасорб 100?5С18, размер частиц 5 мкм. В качестве подвижной фазы избрана смесь ацетонитрил - вода 65:35 при рН 3 (добавлением фосфатного буфера). Скорость подачи элюента 75 мкл/мин. Объем вводимой пробы на анализ 5 мкл. УФ-спектр золпидема в подвижной фазе характеризуется одной полосой поглощения с тремя максимумами и двумя минимумами. Максимум при 240 нм избран в качестве аналитической длины волны. Идентификация золпидема строилась на определении абсолютного времени удерживания - 2,82±0,02 спектральных соотношений при 240/300 нм - 0,538. Расчетная чувствительность обнаружения золпидема - 31 нг/мл. Для количественного определения использовали метод абсолютной калибровки. Линейная зависимость площади хроматографического пика от концентрации золпидема в интервале 6,5-130 мкг/мл. Коэффициент корреляции при ВЭЖХ составил 0,9998.
Для решения вопроса максимального экстагирования соединения из объектов анализа учитывали показатель ионизации (рКа золпидема 6,2) [6].
Золпидем был включен в программу для ПК, которая позволила получить значения степени ионизации золпидема в процентах при рН 1-14. Установлено, что при рН 1-2 соединение полностью ионизировано. Начиная с рН 3, появляется его молекулярная форма, которая достигает 100 % при рН 10. Поэтому возможно, что при ХТА и КДА максимальная экстракция золпидема органическими растворителями из водных извлечений должна достигаться при рН 9-10. Степень ионизации золпидема при данных рН минимальна. Однако в связи с лабильностью исследуемого соединения в щелочной среде (наличие амидной группировки) следует предполагать как наиболее оптимальное значение рН среды 8.
Далее было проведено экспериментальное подтверждение предположений экстрагируемости золпидема различными органическими растворителями в зависимости от рН среды: хлороформ, метиленхлорид и эфир. Растворители, имеющие величину диэлектрической проницаемости большую, чем у хлороформа, не исследовались в связи с их значительной смешиваемостью с водой.
Золпидем экстрагируется органическими растворителями, достигая максимума экстракции хлороформом 99,50 %, метиленхлоридом 99,85 %, эфиром 98,43 % при рН 8.
Полученные результаты послужили основой для разработки методик определения золпидема в биожидкостях. Из крови и мочи изолирование сводилось к прямой дробной экстракции метиленхлоридом (или хлороформом) при рН 8.
При исследовании биологических жидкостей УФ?спектрофотометрическое определение проводилось в аликвоте 1/2 часть извлечения при затравке 0,25 мг на 15 мл мочи или 5 мл плазмы.
При исследовании биожидкостей методом ВЭЖХ определение проводили при затравке 0,1 мг на 2 мл мочи или плазмы.
Разработанные методики анализа биологических жидкостей сведены в логическую схему.
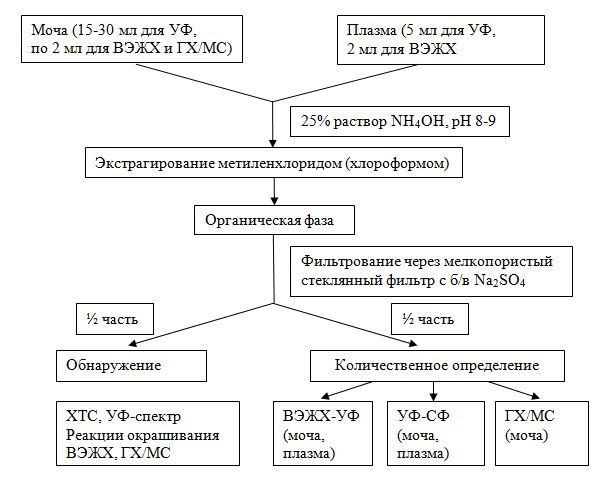
Рисунок 1. Схема ХТА золпидема в биологических жидкостях
Данные количественного определения золпидема в моче и плазме приведены в таблице 1.
Таблица 1. Результаты количественного определения золпидема в моче и плазме
|
Добавлено золпидема, в мг |
Найдено золпидема, в % |
Метрологические характеристики |
Добавлено золпидема, в мг |
Найдено золпидема, в % |
Метрологические характеристики |
|
При УФ-спектрофотометрии |
|||||
|
На 15 мл мочи |
На 5 мл плазмы |
||||
|
0,25 |
89,92 |
x‾ = 94,11 S = 2,97Sx‾ = 1,33 εα = 3,70 Е= ±3,93% |
0,25 |
76,80 |
x‾ = 78,73 S = 2,60Sx‾ = 1,16 εα = ±3,22 Е = ±4,09% |
|
0,25 |
95,08 |
0,25 |
82,40 |
||
|
0,25 |
96,85 |
0,25 |
80,08 |
||
|
0,25 |
92,19 |
0,25 |
78,45 |
||
|
0,25 |
96,50 |
0,25 |
75,92 |
||
|
При ВЭЖХ-определении |
|||||
|
На 2 мл мочи |
На 2 мл плазмы |
||||
|
0,1 |
94,06 |
x‾ = 96,40 S = 2,97Sx‾ = 1,33 εα = 3,70 Е = ± 3,84 |
0,1 |
74,87 |
x‾= 76,39 S = 1,82Sx‾ = 0,81 εα = 2,25 Е = ± 2,95 |
|
0,1 |
96,73 |
0,1 |
77,48 |
||
|
0,1 |
99,00 |
0,1 |
77,70 |
||
|
0,1 |
99,49 |
0,1 |
73,99 |
||
|
0,1 |
92,73 |
0,1 |
77,9 |
||
Как видно из таблицы 1 при статистической обработке данных, полученных в ходе количественного определения золпидема в модельных пробах мочи и плазмы методами УФ-спектрометрии и ВЭЖХ, отражается вполне удовлетворительная сходимость результатов.
Проведен анализ золпидема в образцах реальной мочи пациентов после приема однократных терапевтических доз методом ГХ/МС. К исследуемым пробам по 2 мл добавляли по 20 мкл раствора внутреннего стандарта (спиртовый раствор метилового эфира налидиксовой кислоты) и образцы подвергали ТФЭ на патронах AccuBond II EVIDEX. Элюировали смесью дихлорметан - пропанол - 25% раствор аммиака, 4:1:0,1. Элюат испаряли досуха в токе азота при 60 ?С. Остатки реконструировали 200 мкл этилацетата и анализировали ГХ/МС, вводя по 1 мкл в инжектор хроматографа. Получена хроматограмма с временем удерживания 9,65 мин. Проведена регистрация масс-спектров в режиме селективного ионного мониторинга по ионам m/z 235, 307, 219 (золпидем) и 188, 215, 246 (внутренний стандарт). Результаты ГХ/МС количественного определения золпидема, выделенного из реальной мочи, получены с использованием компьютерной программы ChemStationG1701DA. Количественная оценка соответствия найденного соединения истинному соответствует требованиям метода.
Определяемые концентрации золпидема в моче после перорального приема 10 мг находятся выше предела количественного определения, что демонстрирует высокую чувствительность использованной ГХ/МС методики и позволяет обнаруживать и количественно определять золпидем в реальной моче на стадии его элиминации при приеме однократной терапевтической дозы.
Выводы
- Описана процедура пробоподготовки биологических жидкостей (моча, плазма) для анализа в них золпидема, заключающаяся в жидкостно-жидкостной экстракции (УФ-спектрометрия и ВЭЖХ) и твердофазной экстракции (ГХ/МС).
- Базируясь на использовании методов ТСХ, ВЭЖХ, УФ и ГХ/МС спектрометрии определены основные характеристики идентификации золпидема, в результате чего становится возможным проведение достоверного и надежного анализа этого соединения в биологических жидкостях для целей химико-токсикологического и клинико-диагностического исследований.
- Показана применимость методики ГХ/МС анализа для определения золпидема в образцах реальной мочи после приема разовых терапевтических доз.
Рецензенты:
- Михалев А. И., д. фарм. н., профессор, зав. кафедрой биологической химии, ГБОУ ВПО ПГФА Минздравсоцразвития, г. Пермь.
- Ярыгина Т. И., д. фарм. н., профессор, профессор кафедры фармацевтической химии очного факультета, ГБОУ ВПО ПГФА Минздравсоцразвития, г. Пермь.
Библиографическая ссылка
Хомов Ю.А., Крылова Е.А., Егорова Е.И. ИЗОЛИРОВАНИЕ, ОБНАРУЖЕНИЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЗОЛПИДЕМА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ // Современные проблемы науки и образования. – 2012. – № 2. ;URL: https://science-education.ru/ru/article/view?id=5868 (дата обращения: 20.04.2024).



