Водные растворы электролитов находят широкое практическое применение. Они проявляют значительные отклонения от идеальности, учет которой проводят с использованием осмотических коэффициентов растворов и средних ионных коэффициентов активности электролитов [3]. Вклад в неидеальность растворов электролитов определяется, главным образом, электростатическими взаимодействиями, гидратацией и ионной ассоциацией. Предложены различные модели растворов, уравнения которых содержат терм, учитывающий электростатические взаимодействия в рамках теории Дебая-Хюккеля, а также другие термы, которые содержат эмпирические параметры, с нечетко определенным физическим смыслом.
Целью настоящей работы явилось сопоставление результатов описания термодинамических свойств растворов хлоридов щелочных металлов уравнениями двух вариантов кластерной модели растворов [4]. Эмпирическими параметрами этой модели являются числа ассоциации (Аs) и гидратации ионов (h1 и h2) и ионных пар (h). При их оценке по концентрационным зависимостям осмотических коэффициентов растворов (φ) и средним ионным коэффициентам активности электролитов (γ±) возникают определенные трудности. Действительно, при учете среднеионной гидратации уравнения модели содержат 4 параметра, а при учете гидратации катионов и анионов в отдельности - 6 параметров. Поэтому функция невязки при моделировании, минимизируемая в методе наименьших квадратов, становится многоэкстремальной. В результате возникают наборы часто значительно различающихся оценок параметров, соответствующие дополнительным локальным минимумам. Все эти наборы параметров обеспечивают высокую точность при описании экспериментальных данных, однако только некоторые из них физически адекватны.
Уравнения кластерной модели растворов
Набор уравнений кластерной модели растворов, учитывающий среднеионную гидратацию, имеет следующий вид:
![]() (1)
(1)
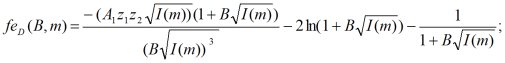 (2)
(2)
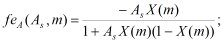 (3)
(3)
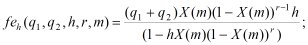 (4)
(4)
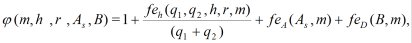 (5)
(5)
где z1, z2 - заряд соответственно катиона и аниона растворенного вещества, q1, q2 - количество катионов и анионов в молекуле, m - моляльность растворенного вещества, B - коэффициент Дебая, As - коэффициент, характеризующий степень ассоциации в растворе, n1 = 55,508 моль - количество вещества в 1 кг воды, φ - осмотический коэффициент, h - средняя степень гидратации иона, r - отношение дисперсии распределения ионов в растворе по степеням гидратации к среднему числу гидратации.
Выражения (1) - (4) являются вспомогательными функциями. С их использованием выражение для осмотического коэффициента в шестипараметрической модели, учитывающей гидратацию отдельных ионов, имеет следующий вид:
![]()
где h1, r1, h2, r2 имеют тот же смысл, что и параметры h и r в предыдущей модели, но относятся соответственно к катионам и анионам электролита.
Приведенные выше уравнения используются для описания экспериментальных данных с помощью метода наименьших квадратов. В модели также фигурируют уравнения для коэффициента активности раствора, но они не участвуют в оптимизации, а являются проверочными. Эти уравнения связаны с выражением для φ уравнением Гиббса-Дюгема и имеют следующий вид соответственно для четырех- и шестипараметрической модификаций модели:
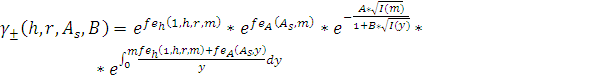
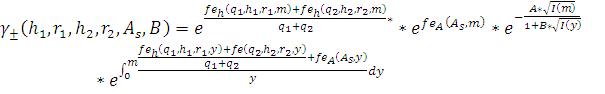
Моделирование экспериментальных данных
Первым этапом нахождения адекватной оценки параметров является получение множества решений, которые с точностью, сопоставимой или лучшей, чем точность измерения, описывают экспериментальные зависимости φ(m). Для этого используется многократная локальная оптимизация квазиньютоновским методом из различных начальных точек. Координаты начальных точек выбираются случайным образом.
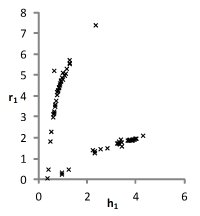
На рис. 1 представлены множества пар значений параметров уравнения для водных растворов хлоридов натрия, калия и цезия, при которых с достаточной точностью описываются экспериментальные концентрационные зависимости осмотических коэффициентов растворов. Решение считается приемлемым при условии малости функции невязки и расположении его строго внутри области, задаваемой ограничениями. Это позволяет исключить решения, не обладающие физическим смыслом.
Можно видеть (рис. 1), что полученные графики для пар параметров (h1,r1) и (h2, r2) практически совпадают, что является следствием симметричности уравнений кластерной модели относительно них при рассмотрении растворов электролитов 1-1. Решения выбирались с учетом точности описания экспериментальных данных. Порогом принималась погрешность измерений φ(m).
NaCl
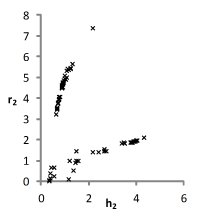
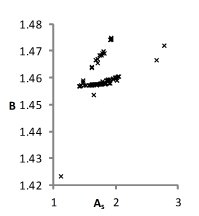
KCl
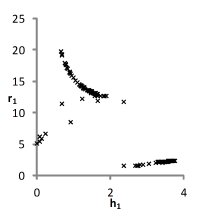
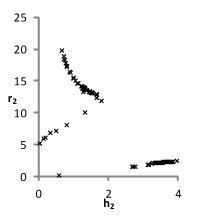
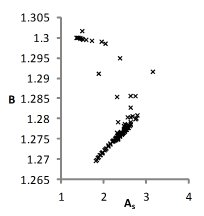
CsCl
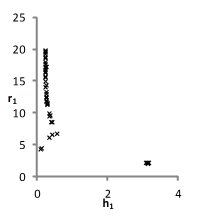
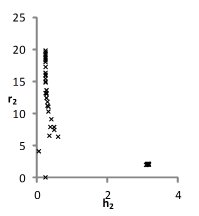
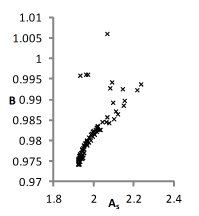
Рис. 1. Множества значений параметров уравнений модели, полученные при описании концентрационных зависимостей осмотических коэффициентов растворов с высокой точностью.
На рис. 2 приведены графики модельных и экспериментальных зависимостей φ(m), соответствующие погрешности измерений. Видно, что даже в этом случае отклонения расчетных зависимостей от эксперимента малы.
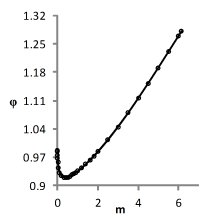
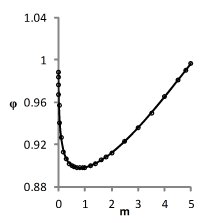
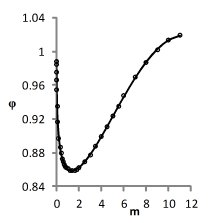
Рис. 2. Теоретические и экспериментальные зависимости φ(m)
для вектора решения, обеспечивающего наихудшую точность описания данных соответственно для растворов NaCl, KCl, CsCl.
Использование среднеионной модели для выделения адекватных решений
Одним из методов фильтрации множества решений является сопоставление результатов расчета по различным модификациям модели. Множества параметров таких модификаций должны частично пересекаться или, по крайней мере, должна быть известна функциональная связь между некоторыми из них. В частности, общими параметрами для двух рассмотренных модификаций кластерной модели являются число ассоциации As и параметр уравнения Дебая B. Средние числа гидратации иона в этих моделях для электролитов 1-1 связаны следующим соотношением:
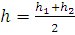 (6)
(6)
где h1, h2 - средние числа гидратации катиона и аниона соответственно, h - аналогичная среднеионная величина (т.е. рассчитанная без разделения ионов на катионы и анионы). Величины As и B в двух модификациях модели совпадают и имеют одинаковый физический смысл. В двух вариантах модели также фигурируют параметры r1, r2 и r - величины, характеризующие отношения дисперсий распределения гидратов по стехиометрическим числам соответственно для катионов, анионов и электролита в целом к соответствующим числам гидратации. Однако дисперсии определены относительно разных математических ожиданий, поэтому для них выражение, аналогичное (6), для гидратации не выполняется.
При использовании варианта уравнения модели со среднеионной гидратацией проблема многоэкстремальности функции невязки проявляется в значительно меньшей степени [5]. В этом случае множество решений более компактно, для водного раствора NaCl оно практически стягивается в точку. На рис. 3 крестообразными маркерами обозначены множества решений, полученные с помощью уравнений шестипараметрической модели, с последующим применением к ним выражений (6) и аналогичного ему для r. Тем не менее следует помнить, что конкретных ограничений на r нет, и усреднение по нему осуществлялось лишь для возможности иллюстрации результатов двух модификаций модели на одном графике.
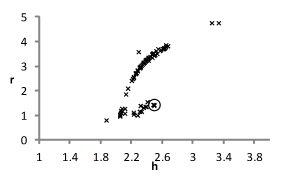
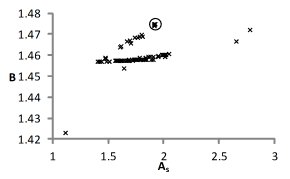
Рис. 3. Сопоставление множеств решений для раствора NaCl с использованием шестипараметрической (x) и четырехпараметрической среднеионной модели растворов (O).
Из рисунка 3 видно, что области среднеионного решения соответствуют пары параметров множества решений при использовании первой модификации модели. Однако из графиков невозможно сделать вывод, относятся ли данные пары оценок к одному или разным векторам решения. Отрицательный ответ на данный вопрос может означать неадекватность используемой модели для рассматриваемых растворов.
Перебором всех полученных решений установлено, что существуют решения, близкие результату, полученному с использованием среднеионной модификации кластерной модели. Эти решения приведены в таблице 1. При этом по причинам, изложенным выше, расхождения по r не принимаются во внимание.
Таблица 1 - Близкие решения, полученные с использованием уравнений двух вариантов кластерной модели (1 - двухгидратный, 2 - среднеионный) для водных растворов NaCl
|
|
Вариант модели |
h1 |
r1 |
h2 |
r2 |
h |
r |
As |
B |
|
1 |
1 |
2.31 |
1.36 |
2.68 |
1.46 |
2.50 |
|
1.92 |
1.47 |
|
2 |
|
|
|
|
2.50 |
1.41 |
1.93 |
1.47 |
|
|
2 |
1 |
2.58 |
1.43 |
2.42 |
1.38 |
2.50 |
|
1.92 |
1.47 |
|
2 |
|
|
|
|
2.50 |
1.41 |
1.93 |
1.47 |
|
|
3 |
1 |
3.98 |
1.93 |
1.08 |
5.31 |
2.53 |
|
1.89 |
1.46 |
|
2 |
|
|
|
|
2.50 |
1.41 |
1.93 |
1.47 |
Таким образом, при существовании более простых модификаций моделей, они могут быть использованы для значительного сужения области поиска адекватного решения. Часто полученная область содержит две-три точки (под точками подразумеваются существенно различающиеся решения).
Для дополнительной фильтрации множества решений рассмотрена возможность использования данных по коэффициентам активности индивидуальных ионов γ+ и γ- в растворе, оценки которых доступны для многих электролитов [2]. Для шестипараметрической кластерной модели эти выражения принимают вид:
и 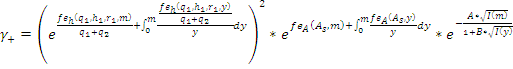
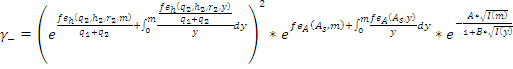
Из рис. 4 для NaCl видно, что только третье из приведенных в табл. 1 решений обеспечивает приемлемое воспроизведение проверочных зависимостей γ+(m) и γ-(m).
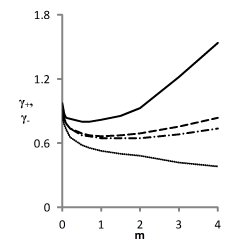
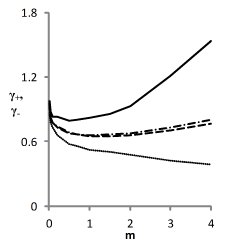
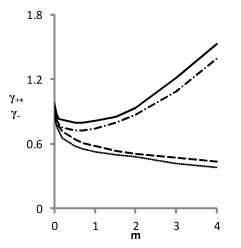
Рис. 4. Модельные (- ∙- - катион, ------ - анион )
и литературные (____ - катион, ∙∙∙∙∙∙∙ - анион)
концентрационные зависимости γ+ и γ- для водных растворов NaCl, соответствующие решениям, приведенным в табл. 1.
Из рис. 4 также видно, что точность описания литературных зависимостей коэффициентов активности индивидуальных ионов относительно невелика. Это объясняется тем, что величины γ+ и γ- недоступны для прямого измерения, и приводимые в литературе данные также вычисляются на основе уравнений тех или иных моделей.
Результаты применения описанной процедуры к рассмотренным в данной работе растворам приведены в табл. 2.
Таблица 2 - Решения, полученные с помощью сопоставления двух модификаций модели (водные растворы NaCl, KCl, CsCl)
|
|
Вариант модели |
h1 |
r1 |
h2 |
r2 |
h |
r |
As |
B |
|
NaCl |
1 |
3.98 |
1.93 |
1.08 |
5.31 |
2.53 |
|
1.89 |
1.46 |
|
2 |
|
|
|
|
2.50 |
1.41 |
1.93 |
1.47 |
|
|
KCl |
1 |
2.82 |
1.64 |
0.33 |
6.90 |
1.58 |
|
1.59 |
1.30 |
|
2 |
|
|
|
|
1.60 |
1.10 |
1.63 |
1.30 |
|
|
CsCl |
1 |
3.15 |
2.07 |
0.60 |
6.33 |
1.88 |
|
2.24 |
0.99 |
|
2 |
|
|
|
|
2.13 |
1.97 |
2.72 |
1.04 |
Отметим, что числа гидратации, отвечающие этим решениям, находятся в определенном соответствии с литературными данными.
Заключение
Проблема многоэкстремальности оптимизируемой функции при моделировании электролитов может существенно сузить область применимости математической модели. Особенно это касается моделей, уравнения которых содержат более четырех параметров. Методы глобальной оптимизации позволяют частично преодолеть проблему многоэкстремальности функции невязки. Однако для большинства рассмотренных растворов значения данной функции в своих локальных минимумах значительно меньше погрешности измерения экспериментальных данных. Это означает, что, несмотря на то что чисто математически нахождение глобального минимума предпочтительнее, с практической точки зрения любой из локальных минимумов, обеспечивающих приемлемую точность, может являться решением, соответствующим истинным значениям параметров, т.е. физически интерпретируемым решением. В такой ситуации эксперт, анализирующий результаты моделирования, может сделать ошибочный вывод о неадекватности рассматриваемой им модели при предоставлении ему решения, соответствующего только одному локальному минимуму целевой функции. Применение подхода, основанного на фильтрации множества всех решений, с достаточной степенью точности описывающих экспериментальные данные, приведенного в настоящей работе, позволяет существенно снизить вероятность таких ошибок. Фильтрация решений проводится на основании анализа соответствия литературных и модельных концентрационных проверочных зависимостей γ+ и γ-. Кроме того, при существовании некоторых упрощенных вариантов моделей с меньшим числом параметров - на основе анализа соответствия оценок параметров, полученным по различным уравнениям.
В настоящее время проведена интеграция предложенной в статье методики в разрабатываемую систему моделирования свойств электролитов и проверки адекватности математических моделей растворов, представленную в [1].
Рецензенты
- Соловьев Сергей Николаевич, д.х.н., профессор, заведующий кафедрой общей и неорганической химии, Российский химико-технологический университет им. Д.И. Менделеева, г. Москва.
- Аллахвердов Грант Рантович, д.х.н., профессор, Институт фармацевтических реактивов РЕФАРМ, г. Москва.
Библиографическая ссылка
Потапов Д.А., Леонова Н.М., Рудаков А.М., Сергиевский В.В. ФИЗИЧЕСКАЯ ИНТЕРПРЕТАЦИЯ ПАРАМЕТРОВ ПРИ МОДЕЛИРОВАНИИ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ РАСТВОРОВ ЭЛЕКТРОЛИТОВ // Современные проблемы науки и образования. – 2012. – № 5. ;URL: https://science-education.ru/ru/article/view?id=7121 (дата обращения: 19.04.2024).



