Белок YB-1 - многофункциональный ДНК- и РНК-связывающий белок млекопитающих, участвующий в различных внутриклеточных процессах, связанных с хранением, воспроизведением и экспрессией генетической информации, и функционирующий как в ядре, так и в цитоплазме. YB-1 может взаимодействовать с актиновым и тубулиновым цитоскелетами, а также секретироваться из клеток и выступать в качестве экстраклеточного регулятора различных процессов в организме [1].
YB-1 содержит 324 а. о. и состоит из трех доменов [8]. На N-конце находится небольшой домен, богатый аланином и пролином, далее идет домен холодового шока (CSD) [7], а за ним - протяженный C-концевой домен, состоящий из чередующихся кластеров положительно и отрицательно заряженных аминокислотных остатков, с размером каждого кластера примерно в 25-30 остатков. Данные о том, каким образом неструктурированные N- и C- домены белка располагаются относительно CSD-домена, отсутствуют.
Ранее, с помощью АСМ было показано, что инкубация белка YB-1 в 20 мМ Hepes-KOH, pH 7.6, 2 MLiCl приводит к образованию фибрилл [2]. Для того чтобы приблизиться к пониманию процесса фибриллогенеза белка YB-1, необходимо выявить параметры протофибрилл, определяющих их функциональное состояние и упаковку в протяженные фибриллы. Кроме того, определение влияния внешних условий на процесс фибриллогенеза даст возможность получать фибриллы с регулируемыми свойствами.
Целью данной работы было исследование кинетики образования фибриллярных структур белком YB-1 с помощью методов атомно-силовой микроскопии (АСМ) [4] и аналитического ультрацентрифугирования (АУ) [3].
Материалы и методы
Очистка белка YB-1 и образование фибрилл
Белок YB-1 получали, как описано ранее [2]. Для получения фибрилл белка YB-1 концентрированный препарат белка размораживали и доводили его концентрацию до 0.1 мг/мл буфером 20 мМHEPES-KOH, pH 7.6, содержащем 2MLiCl или 150мМKCl. Препарат белка прогревали в течение 15 мин при 30 ºС, дальнейшую инкубацию белка проводили при 4 ºС.
Атомно-силовая микроскопия
Сканирование осуществлялось на приборе Интегра-Вита («НТ-МДТ», Зеленоград) в полуконтактном режиме. В работе использовались стандартные кремниевые кантиливеры NSG 03 длиной 100 мкм, с резонансной частотой 62-123 кГц и радиусом закругления острия 10 нм.
Для исследования методом АСМ все образцы готовились одинаково следующим образом. На свежесколотую слюду помещали каплю раствора белка объемом 5-10 мкл. После этого слюду с нанесенным раствором помещали во влажную атмосферу, для предотвращения высыхания капли, и выдерживали в течение 5 минут. Затем каплю раствора удаляли фильтрованной бумагой и подложку с образцом, не высушивая, дважды промывали в дистиллированной воде в течение 30 секунд для удаления не адсорбированного вещества. После промывания подложку с образцом высушивали на воздухе.
Аналитическое ультрацентрифугирование
Эксперименты по АУ проводились на центрифуге BeckmanXL (BeckmanCoulter) на скорости 40000 об/мин при 20 °C. Распределения дифференциального коэффициентаc(s) и c(M) рассчитывались с помощью программы SEDFIT [10]. Расчеты коэффициентов седиментации проводились с поправкой на температуру и ионную силу буферного раствора.
результаты исследования и их обсуждение
Анализ свежеприготовленного белка YB-1 в условиях высокой (2 М LiCl) и низкой (150 мМ КCl) ионных силахметодами АУ и АСМ
Седиментационный анализ свежеприготовленного белка YB-1 в условиях высокой ионной силы 2М LiCl приведен на рисунке 1А. Как видно из рисунка, распределение по константе седиментации и по молекулярной массе унимодально. Вычисляемая величина константы седиментации s составляет, s20w = 2.72 S. Вычисляемая молекулярная масса М составляет 35.3 кДа, что всего лишь на 2 % меньше теоретической величины, рассчитанной из первичной последовательности (36 кДа). Отметим, что константа седиментации равная 2.72 S соответствует глобулярному белку в растворе.
Седиментационный анализбелка YB-1 в условиях умеренной ионной силы 150мМ KCl (свежеприготовленный) дает константу седиментации равную 2.80 S, что также соответствует глобулярному белку в растворе (рис.1 В). Вычисляемая молекулярная масса М при этом равна 36.2 кДа.
То, что свежеприготовленный белок находится в глобулярном состоянии, подтверждается полученными АСМ изображениями мономеров белка на подложке (рис. 1 Б, Г). Таким образом, можно утверждать, что на начальном этапе ионные условия не влияют на конформацию белка в растворе. Кроме того, из этого следует, что в растворе неструктурированные N- и C- домены белка располагаются компактно вокруг доменахолодового шока.
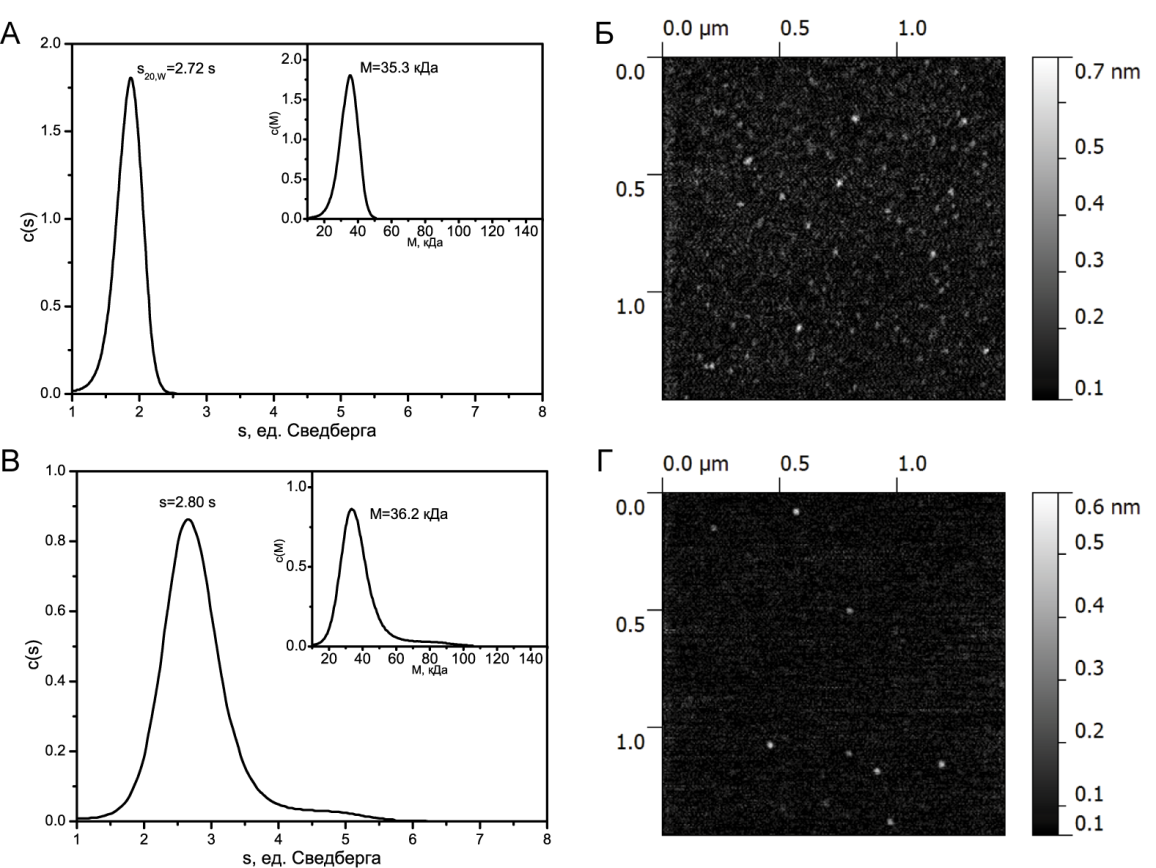
Рис. 1. А - седиментационный профиль белка YB-1 в условиях высокой ионной силы (2 MLiCl). Основной график иллюстрирует распределение седиментационной постоянной, а вложенный график иллюстрирует распределение молекулярной массы. Б - АСМ изображение мономеров белка YB-1 в условиях высокой ионной силы (2MLiCl). В - седиментационный профиль белка YB-1 в условиях умеренной ионной силы (150мМ КCl). Основной график - распределение седиментационной постоянной, а вложенный график - распределение молекулярной массы. Г - АСМ изображение мономеров белка YB-1 в условиях умеренной ионной силы (150мМ КCl)
Объем YB-1 в растворе (АУ) и на подложке (АСМ)
Несмотря на то, что при взаимодействии с зондом высота и ширина биологических объектов получается отличной от реальной, расчет объема белковых молекул по данным атомно-силовой микроскопии дает весьма достоверные результаты. Кроме того, многие работы [9] указывают на то, что объем глобулярных белков, измеряемый АСМ, коррелирует с молекулярной массой.
В первом приближении объем белка в растворе можно рассчитать по формуле [5]:
V = (M0/N0)(Vl + dV2),
где M0 - молекулярный масса белка, N0 - число Авогадро, Vl и V2 - парциальные удельные объемы белка (0.74 см3·г-1 и 1 см3·г-1 в растворе, соответственно), d - степень гидратации белка (0.4 моль H2O/моль белка).
Для мономера белка YB-1(молекулярная масса 36 кДа) в растворе имеем гидродинамический объем равный:
Vгидр = 68.17 нм3
АСМ-изображение свежеприготовленного белка YB-1 в условиях умеренной ионной силы представлено на рисунке 1 Г. Хорошо видно, что белок находится в мономерной форме. Анализируя АСМ-изображения мономеров белка YB-1, были получены средние значение высоты, которая составила 0.42 нм и средний диаметр на половине максимальной высоты, который был равен 34 нм.
Для оценки объема микрочастиц белка из АСМ изображений применяем формулу для сегмента сферы:
V = (h/6) (3r2 + h2),
где h - высота молекулы белка, r - радиус белка.
Для измеренных с АСМ-изображений параметров (среднее значение высоты и ширины высчитывалось по профилю сечения для набора частиц), получаем:
VАСМ= 60.7 ± 7.0 нм3
Таким образом, объем белка YB-1 на подложке по данным АСМ на 11 % меньше такового, рассчитанного по гидродинамическим параметрам.
Кинетика образования фибриллярных структур белком YB-1
После инкубации белка YB-1 в условиях высокой ионной силы 2 М LiCl в течение суток наблюдалось изменение седиментационного профиля (рис. 2 А). На рисунке видно второй меньший пик, константа седиментации которого соответствует димеру белка. Через трое суток точное определение константы седиментации становится невозможным, а молекулярная масса отдельных образованных в растворе структур становится 7∙106 Да, что говорит о прошедшей в растворе процессе полимеризации вещества (рис. 2Б). При этом структуры, наблюдаемые на АСМ-изображениях, представляют собой протяженные фибриллы, что коррелирует с полученными гидродинамическими данными (рис. 2В), а также с полученными раннее данными других работ [2, 6].
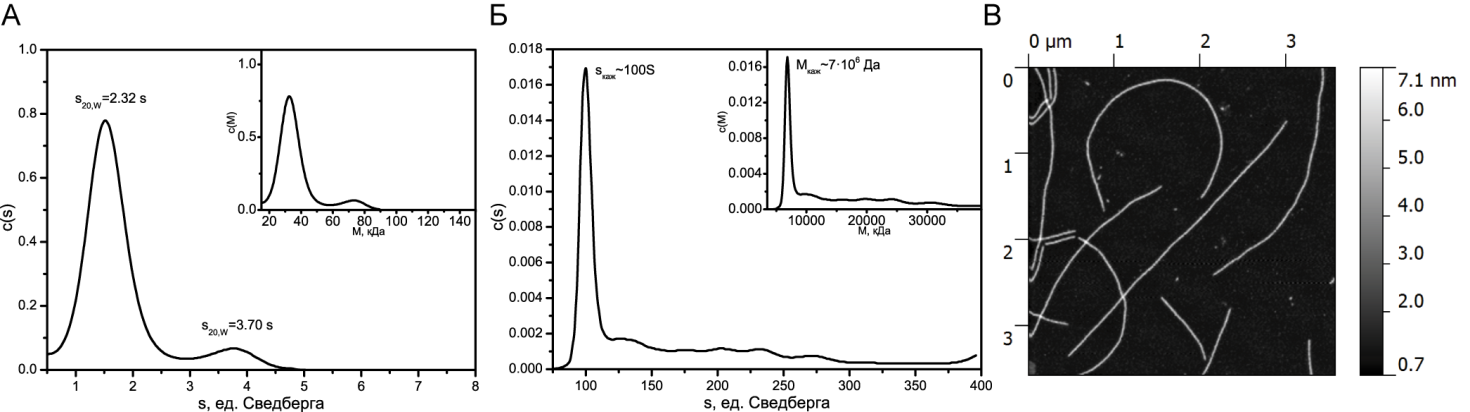
Рис. 2. А - седиментационный профиль белка YB-1 после суток инкубации в растворе в условиях высокой ионной силы (2MLiCl). Основной график - распределение седиментационной постоянной, вложенный график - распределение молекулярной массы. Б - седиментационный профиль белка YB-1 после трех суток инкубации в растворе в условиях высокой ионной силы (2MLiCl). Основной график - распределение седиментационной постоянной, вложенный график - распределение молекулярной массы. В - АСМ изображение фибрилл белка YB-1 после трех суток инкубации в растворе в условиях высокой ионной силы (2MLiCl)
В условиях умеренной ионной силы в процессе инкубации белок YB-1 коэффициент седиментации не изменялся, что свидетельствует об отсутствии процесса полимеризации.
Заключение
В данной работе с помощью методов АСМ и АУ было показано, что свежеприготовленный белок YB-1 находится в глобулярной мономерной форме и ионные условия не влияют на его конформацию в растворе. Это говорит о том, что в растворе неструктурированные N- и C- домены белка располагаются компактно вокруг доменахолодового шока. Рассчитанный гидродинамический объем мономеров белка YB-1 в растворе равен 68.17 нм3, а объем белка, адсорбированного на поверхности слюды (по данным АСМ) - 60.7 нм3. После трех суток инкубации белка в условиях высокой ионной силы определение его константы седиментации из АУ было невозможно, что согласуется с полученными ранее АСМ-данными об образуемых фибриллярных структурах. Можно заключить, что структурной единицей, инициирующей возникновение протофибрилл и последующее развитие процесса образования протяженных фибрилл, является димерная форма белка YB-1.
Авторы выражают благодарность Гурьянову С. Г. (Институт Белка РАН) за предоставленный препарат белка YB-1 и Тимченко А. А. (Институт Белка РАН) за помощь в проведении экспериментов по АУ.
Рецензенты:
- Кутышенко Виктор Павлович, д.ф.-м.н., профессор, зав. лабораторией «ЯМР-исследований биосистем», Институт теоретической и экспериментальной биофизики РАН (ИТЭБ РАН), г. Пущино.
- Новосёлова Елена Григорьевна, д.б.н., профессор, главный научный сотрудник, Институт биофизики клетки РАН (ИБК РАН), г. Пущино.
Библиографическая ссылка
Мачулин А.В., Хечинашвили Н.Н. ИССЛЕДОВАНИЕ КИНЕТИКИ ОБРАЗОВАНИЯ ФИБРИЛЛ БЕЛКА YB-1 С ПОМОЩЬЮ МЕТОДОВ АТОМНО-СИЛОВОЙ МИКРОСКОПИИ И АНАЛИТИЧЕСКОГО УЛЬТРАЦЕНТРИФУГИРОВАНИЯ // Современные проблемы науки и образования. – 2012. – № 5. ;URL: https://science-education.ru/ru/article/view?id=7164 (дата обращения: 20.04.2024).



