Введение
Появление значительного количества штаммов бактерий, резистентных к антибиотикам широкого спектра действия, определяет необходимость синтеза новых антибактериальных препаратов и изучения механизмов их действия. Органические соединения селена являются одними из перспективных в этом отношении. Установлена высокая антибактериальная активность ряда селеноорганических соединений против широкого спектра грамположительных и грамотрицательных бактерий, а также различных грибов и вирусов (4Н-селенопиранов и солей селенопирилия, селеноксантенов, селеноциклогексанов, бензоселенохроменов, бензисоселеназолов, селенадиазолов и др.) [8-12].
В настоящее время в ряде регионов России в животноводстве и птицеводстве применяется селеноорганический препарат диацетофенонилселенид (ДАФС-25) [2], проводится синтез и изучение биологической активности его производных.
Следует отметить, что в настоящее время в медицинской практике применяются хлорсодержащие (хлоргексидин, триклозан) и фторсодержащие (фторхинолоны) препараты, оказывающие выраженное антимикробное действие [1, 5].
В связи с этим целью нашей работы явилось изучение сравнительной антимикробной активности селеноорганического соединения диацетофенонилселенид и его галогенопроизводных в отношении клинических штаммов кишечной палочки Escherichia coli (E. coli).
Материалы и методы
В эксперименте использовали препараты 1,5-дифенил-3-селенапентандион-1,5 - диацетофенонилселенид (соединение 1) и его галогенопроизводные: 1,5-ди-(п-хлорфенил)-3-селенапентандион-1,5 (соединение 2) и 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 (соединение 3) в различных концентрациях (рис. 1).
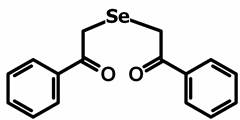
Соединение 1
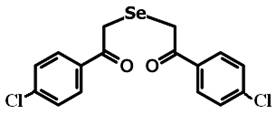
Соединение 2
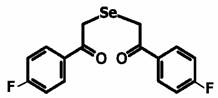
Соединение 3
Рис. 1. Структурная формула исследуемых препаратов – 1,5-дифенил-3-селенапентандион-1,5 - диацетофенонилселенид (соединение 1), 1,5-ди-(п-хлорфенил)-3-селенапентандион-1,5 (соединение 2) и 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 (соединение 3)
Эксперимент проводили на клинических штаммах E. coli. Штаммы бактерий выделяли от больных с гнойными осложнениями, находящихся на лечении в травматолого-ортопедическом стационаре Саратовского научно-исследовательского института травматологии и ортопедии (СарНИИТО). Видовую идентификацию штаммов проводили на основании изучения фенотипических свойств. Бактерии обладали резистентностью к пяти и более профильным антибиотикам: бета-лактамам (цефалоспорины 1–2 поколения, оксациллин, метициллин), макролидам (эритромицин), фторхинолонам (ципрофлоксацин, левофлоксацин), аминогликозидам (гентамицин) и ванкомицину.
Суспензию бактерий готовили по стандарту мутности ГИСК им. Л. А. Тарасевича, путём последовательных разведений до конечной концентрации бактерий – 3·105 клеток в 1 мл.
1 мг соединения растворяли в 100 мкл ДМФА (диметилформамида), добавляли 900 мкл 0.9 %-ного NaCl - проба 1 (1 мг/мл). В качестве контроля использовали 1 мл ДМФА +9 мл 0.9 %-ного NaCl. Затем из пробы 1 отбирали 100 мкл, добавляли 900 мкл из контрольной пробирки, получая пробу 2 (0.1 мг/мл). Из пробы 2 отбирали 100 мкл содержимого, добавляли 900 мкл из контроля, получая пробу 3 (0.01 мг/мл). Из пробы 3 отбирали 100 мкл раствора, добавляли 900 мкл из контроля, получая пробу 4 (0.001 мг/мл).
В пробирки с разведениями препарата добавляли по 100 мкл конечной суспензии (3·105 КОЕ/мл) микроорганизмов, встряхивали и инкубировали в течение 30, 60, 90, 120, 150 мин при комнатной температуре.
В качестве контроля использовали такие же количества бактериальной взвеси, разведенные в аналогичных пропорциях с контролем (ДМФА с 0.9 %-ным NaCl), а также выдержанные в течение тех же промежутков времени. После этого бактериальные взвеси из каждой пробирки в количестве 100 мкл высевали на чашки Петри с твердой питательной средой (мясо-пептонный агар), которые затем помещали в термостат на 24 часа при 37 ºС. Подсчет колоний производили на следующий день.
Статистическую обработку полученных данных осуществляли при помощи пакета программ Statistica 6.0. Проверяли гипотезы о виде распределений (критерий Шапиро –Уилкса). Большинство данных не соответствуют закону нормального распределения, поэтому для сравнения значений использовался U-критерий Манна – Уитни, на основании которого рассчитывался Z – критерий Фишера и показатель достоверности p. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0.05.
Результаты и их обсуждение
Антимикробная активность исследованных препаратов зависела от наличия в молекуле бокового радикала. Так, соединение 1 (ДАФС), лишенное боковых заместителей у фенильных колец, проявляло антибактериальную активность на клинические штаммы E. coli только в максимальной концентрации 1 мг/мл (табл. 1).
Причем антибактериальный эффект возрастал по мере увеличения времени инкубации. При инкубации 60 минут соединение 1 подавляло рост колоний кишечной палочки на 30.7 % (р<0.05), при инкубации 90 минут – на 43.4 % (р<0.05), при инкубации 120 минут – на 85.3 % (р<0.05) и при инкубации 150 минут – на 87.9 % (р<0.001) соответственно по сравнению с контролем. При максимальной инкубации препарат ДАФС был также эффективен в концентрации 0.1 мг/мл и вызывал достоверное уменьшение роста колоний кишечной палочки на 61.6 % (р<0.001) по сравнению с контролем. Достоверная антибактериальная активность также наблюдалась при минимальной инкубации 30 минут в концентрации соединения 1 0.001 мг/мл (табл. 1).
Следовательно, клинические штаммы E. coli чувствительны только к высокой концентрации препарата ДАФС. Причем эта чувствительность возрастает по мере увеличения времени инкубации и составляет максимум при инкубации 120 и 150 минут в концентрации 1 мг/мл.
Соединение 2 оказывало антибактериальное действие на клинические штаммы E. coli в концентрациях от 1 до 0.001 мг/мл и при инкубации 30–150 минут (табл. 2). Минимальная концентрация этого соединения (0.001 мг/мл) эффективно подавляла рост клеток кишечной палочки при инкубации в течение 60–150 минут на 33.5 % (60 минут), 31.2 % (90 минут), 41.0 % (120 минут), 47.2 % (150 минут) (р<0.05).
В концентрации 0.01 мг/мл соединение 2 достоверно уменьшало число клеточных колоний E. coli на 37.1 % (30 минут), 49.6 % (60 минут), 51.1 % (90 минут), 75.6 % (120 минут), 75.9 % (150 минут) соответственно по сравнению с контролем (р<0.05).
Антибактериальная активность препарата 2 в концентрации 0.1 мг/мл выражалась в подавлении роста бактериальных клеток кишечной палочки на 74.9 % (30 минут), 69.6 % (60 минут), 90.0 % (90 минут) соответственно (р<0.05). При инкубации клеток кишечной палочки с соединением 2 в концентрации 0.1 мг/мл в течение 120 и 150 минут рост колоний подавлялся полностью (р<0.001) (табл. 2).
Таблица 1. Антибактериальное действие соединения 1 на клинические штаммы E.coli
|
|
Количество колоний на твердых питательных средах |
|||||
|
Контроль (ДМФА и физ. р-р) |
Опытные группы, концентрация вещества, мг/мл |
|||||
|
1 |
0.1 |
0.01 |
0.001 |
|||
|
Время воздействия, мин |
30 |
937 (874;978) |
1005(878;1141) Zк=0.30; pк=0.762369. |
937(896;970) Zк=0.30; pк=0.762369. |
973(866;1267) Zк=0.34; pк=0.733730. |
773(674;856) Zк=2.87; pк=0.004072. |
|
60 |
882 (664;990)
|
611(453;673) Zк=2.61; pк=0.009109. |
895(874;956) Zк=1.28; pк=0.198766. |
789(645;984) Zк=1.13; pк=0.256840. |
892(833;1056) Zк=0.98; pк=0.325752. |
|
|
90 |
821 (671;907)
|
465(256;569) Zк=2.72; pк=0.006502. |
685(585;1045) Zк=0.30; pк=0.762369. |
929(759;1063) Zк=1.47; pк=0.140466. |
762(563;983) Zк=0.04; pк=0.969850. |
|
|
120 |
804 (442;1025) |
118(79;231) Zк=3.78; pк=0.000157. |
677(451;970) Zк=1.44; pк=0.150928. |
724(548;993) Zк=1.02; pк=0.307490. |
854(678;1061) Zк=0.42; pк=0.677585. |
|
|
150 |
943 (803;977)
|
114(64;183) Zк=3.78; pк=0.000157. |
362(314;487) Zк=3.55; pк=0.000381. |
778(563;971) Zк=1.58; pк=0.112412. |
823(671;934) Zк=1.44; pк=0.150928. |
|
Примечания: в каждом случае приведены средняя величина (медиана – Ме), нижний и верхний квартили (25 %;75 %).
Zк, pк – различия по сравнению с группой контроля.
Таблица 2. Антибактериальное действие соединения 2 на клинические штаммы E.coli
|
|
Количество колоний на твердых питательных средах |
|||||
|
Контроль (ДМФА и физ. р-р) |
Опытные группы, концентрация вещества, мг/мл |
|||||
|
1 |
0.1 |
0.01 |
0.001 |
|||
|
Время воздействия, мин |
30 |
896 (809;906)
|
54(43;89) Zк=3.77; pк=0.000157. |
225(156;256) Zк=3.77; pк=0.000157. |
564(459;675) Zк=3.28; pк=0.001008. |
836(704;897) Zк=1.20; pк=0.226477. |
|
60 |
908 (896;1167)
|
25(4;96) Zк=3.77; pк=0.000157. |
276(89;358) Zк=3.77; pк=0.000157. |
458(387;578) Zк=3.47; pк=0.000507. |
604(498;967) Zк=2.19; pк=0.028366. |
|
|
90 |
982 (867;1108)
|
0(0;0) Zк=3.77; pк=0.000157. |
98(74;207) Zк=3.77; pк=0.000157. |
480(231;652) Zк=3.55; pк=0.000381. |
676(561;786) Zк=3.32; pк=0.000881. |
|
|
120 |
787 (765;890)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;119) Zк=3.77; pк=0.000157. |
192(67;417) Zк=2.41; pк=0.015565. |
464(267;584) Zк=2.19; pк=0.028366. |
|
|
150 |
702 (674;853)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;78) Zк=3.77; pк=0.000157. |
169(91;320) Zк=3.32; pк=0.000881. |
371(117;543) Zк=3.55; pк=0.000381. |
|
Примечания: в каждом случае приведены средняя величина (медиана – Ме), нижний и верхний квартили (25 %;75 %).
Zк, pк – различия по сравнению с группой контроля.
Наконец, в максимальной концентрации соединения 2 (1 мг/мл) наблюдалась наибольшая антимикробная активность в отношении клеток E. coli. При этом уменьшалось число колоний на 93.9 % (30 минут), 97.3 % (60 минут). При инкубации клеток кишечной палочки с соединением 2 в концентрации 1 мг/мл в течение 90, 120 и 150 минут рост колоний подавлялся полностью (р<0.001) (табл. 2).
Полученные результаты демонстрируют высокую антибактериальную активность соединения 2 в отношении клинических штаммов E. coli. Однако полное подавление роста бактерий наблюдалось лишь в максимальной концентрации этого препарата 1 мг/мл и при длительной инкубации 120 и 150 минут. При краткосрочной инкубации (30 минут) препарат 2 был высоко эффективен только в концентрациях 1 и 0.1 мг/мл. Тем не менее, соединение 2 оказывало достоверное антибактериальное действие во всех исследованных концентрациях при времени инкубации от 60 до 150 минут.
Сравнительно большая антибактериальная активность соединения 2 (хлорсодержащего аналога препарата ДАФС) по сравнению с соединением 1 (ДАФС), вероятно, связана с наличием в структуре соединения 2 двух атомов хлора.
Полученные результаты демонстрируют высокую антибактериальную активность соединения 3 в отношении клинических штаммов E. coli. Соединение 3 эффективно подавляло рост бактериальных клеток во всех исследованных концентрациях (0.001–1 мг/мл) и при разном времени инкубации 30–150 минут (табл. 3).
Значительное уменьшение числа клеточных колоний наблюдалось при инкубации клеток кишечной палочки с соединением 3 в минимальной концентрации 0.001 мг/мл: на 41.1 % (30 минут) (р<0.001), 50.2 % (60 минут) (р<0.05), 77.6 % (90 минут), 89.7 % (120 минут), 99.2 % (150 минут) (р<0.001) соответственно.
Соединение 3 в концентрациях 0.01-1 мг/мл проявляло более выраженную антибактериальную активность, значительно уменьшая число выросших колоний. Например, это соединение в концентрации 0.01 мг/мл подавляло рост колоний E. coli на 62.9 % при инкубации 30 минут, на 99.8 % при инкубации 60 минут и на 94.6 % при 90-минутной инкубации (р<0.001). При увеличении времени инкубации до 120 и 150 минут рост бактериальных клеток прекращался (р<0.001).
Наибольший антибактериальный эффект соединения 3 наблюдался в высоких концентрациях (0.1 и 1 мг/мл). При этом при 30-минутной инкубации штаммов кишечной палочки с этим соединением в концентрации 0.1 мг/мл отмечалось уменьшение числа бактериальных колоний на 77.0 %, а при инкубации 60 минут – на 91.3 % (р<0.001) соответственно по сравнению с контролем. Увеличение времени инкубации до 90, 120 и 150 минут приводило к полному подавлению роста бактериальных клеток E. coli.
Таблица 3. Антибактериальное действие соединения 3 на клинические штаммы E.coli
|
|
Количество колоний на твердых питательных средах |
|||||
|
Контроль (ДМФА и физ. р-р) |
Опытные группы, концентрация вещества, мг/мл |
|||||
|
1 |
0.1 |
0.01 |
0.001 |
|||
|
Время воздействия, мин |
30 |
967 (906;995)
|
200(34;345) Zк=3.77; pк=0.000157. |
222(78;341) Zк=3.77; pк=0.000157. |
358(287;674) Zк=3.77; pк=0.000157. |
570(349;850) Zк=3.66; pк=0.000244. |
|
60 |
896 (804;996)
|
28(7;167) Zк=3.77; pк=0.000157. |
78(16;237) Zк=3.77; pк=0.000157. |
204(53;378) Zк=3.62; pк=0.000285. |
446(115;654) Zк=3.09; pк=0.001940. |
|
|
90 |
1003 (895;1089)
|
0(0;6) Zк=3.77; pк=0.000157. |
1(0;9) Zк=3.77; pк=0.000157. |
54(11;118) Zк=3.77; pк=0.000157. |
225(67;342) Zк=3.77; pк=0.000157. |
|
|
120 |
877 (778;943)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;2) Zк=3.77; pк=0.000157. |
0(0;78) Zк=3.77; pк=0.000157. |
90(34;264) Zк=3.70; pк=0.000212. |
|
|
150 |
893 (764;922)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;0) Zк=3.77; pк=0.000157.. |
2(0;18) Zк=3.77; pк=0.000157. |
7(0;108) Zк=3.77; pк=0.000157. |
|
Примечания: в каждом случае приведены средняя величина (медиана – Ме), нижний и верхний квартили (25 %;75 %).
Zк, pк – различия по сравнению с группой контроля.
Наконец, соединение 3 в концентрации 1 мг/мл подавляло рост колоний кишечной палочки на 79.3 % при 30-минутной инкубации и на 96.9 % при 60-минутной инкубации. При более длительной инкубации (90, 120, 150 минут) клинических штаммов E. coli рост клеток подавлялся полностью (табл. 3).
Следовательно, среди изученных селеноорганических соединений, соединение 3 оказывало наибольшее антибактериальное действие на клинические штаммы E. coli во всех исследованных концентрациях и при разном времени инкубации, достигая максимума в концентрациях 0.01–1 мг/мл и при длительной инкубации от 90 минут и более.
Заключение
В проведенном исследовании антимикробная активность селеноорганических препаратов возрастала в направлении 1 → 2 → 3. Сравнительно большая антибактериальная активность препаратов 2 и 3 в отношении клинических штаммов E. coli объясняется наличием в их структуре галогенов – фтора и хлора соответственно. Известно, что фтор – самый электроотрицательный элемент и самый мощный окислитель, поэтому благодаря наличию двух атомов фтора соединение 3 приобретало прооксидантные свойства и, как следствие, становилось самым токсичным из всех исследованных селеноорганических препаратов, проявляя максимальную антибактериальную активность.
Окислительные свойства хлора значительно слабее, чем у фтора, поэтому хлорсодержащий аналог препарата ДАФС (соединение 2) обладал меньшей антимикробной активностью по сравнению с соединением 3.
Кроме того, особенности строения мембран грамотрицательных бактерий обусловливают неэффективность большинства синтетических и натуральных антимикробных агентов против таких грамотрицательных бактерий, таких как Escherichia coli, поскольку клеточная стенка грамотрицательных бактерий для большинства химических соединений является непроницаемой, что связано с особенностями ее строения. Единственным местом проникновения служат пориновые каналы внешней мембраны, которые являются основным путем транспорта питательных веществ внутрь бактериальной клетки [6]. Количество и тип порина может изменяться с изменением условий окружающей среды, таким образом, бактериальная клетка регулирует проницаемость наружной мембраны в ответ на внешний стимул. Через пориновые каналы могут проникнуть соединения с низкой молекулярной массой и определенной пространственной структурой [3,4,7].
Исследованные в данной работе селеноорганические соединения являются низкомолекулярными гидрофобными соединениями, которые, вероятно, могут легко проникать через липополисахаридный слой внешней мембраны грамотрицательных бактерий и оказывать антимикробное действие.
Авторы выражают сердечную благодарность за помощь в подготовке статьи профессору, доктору хим. наук Древко Б. И. и канд. мед. наук Бабушкиной И. В.
Рецензенты:
Микашинович Зоя Ивановна, доктор биологических наук, профессор, заведующая кафедрой общей и клинической биохимии № 1 ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону.
Бондаренко Тамара Ивановна, доктор биологических наук, профессор, профессор кафедры биохимии и микробиологии ФГАОУ ВПО «Южный федеральный университет», г. Ростов-на-Дону.
Библиографическая ссылка
Русецкая Н.Ю., Димидов Д.П., Саратцев А.В., Горошинская И.В., Бородулин В.Б. АНТИБАКТЕРИАЛЬНОЕ ДЕЙСТВИЕ СЕЛЕНООРГАНИЧЕСКОГО ПРЕПАРАТА ДИАЦЕТОФЕНОНИЛСЕЛЕНИДА И ЕГО ГАЛОГЕНОПРОИЗВОДНЫХ НА КЛИНИЧЕСКИЕ ШТАММЫ ESCHERICHIA COLI // Современные проблемы науки и образования. – 2013. – № 3. ;URL: https://science-education.ru/ru/article/view?id=9367 (дата обращения: 20.04.2024).



