Болезнь Блаунта – тяжелая патология опорно-двигательного аппарата у детей, представленная варусной деформацией коленных суставов [1; 2]. В зависимости от формы (ранняя или поздняя) заболевание выявляется в 3-4-летнем возрасте либо в подростковый период [3]. При отсутствии своевременного лечения происходит прогрессирование деформации вплоть до формирования ранних дегенеративных изменений. Наиболее эффективным вариантом лечения является хирургическая коррекция [4]. Этиология болезни Блаунта не известна [1; 4]. В качестве причин, способствующих возникновению деформации, рассмотрены ранняя ходьба, ожирение, дефицит витамина D, расовая принадлежность, генетическая предрасположенность и другие [1; 4; 5]. Одним из главных препятствий к пониманию механизмов развития болезни Блаунта является отсутствие экспериментальной модели. В научной литературе экспериментальная модель данного заболевания не представлена. Моделирование варусной деформации коленных суставов позволит достичь значительных результатов в понимании этиологии и патогенеза формирующегося нарушения.
Создание модели болезни Блаунта основано на гипотезе о роли клеток нервного гребня в индуцировании ортопедической патологии [6]. Рассматриваемый способ моделирования предполагает формирование варусной деформации коленных суставов у экспериментальных животных путем ингибирования экспрессии РАХ3 гена siРНК [7]. Малые интерферирующие РНК (siРНК) относятся к классу двухцепочечных РНК, длиной от 20 до 25 нуклеотидов, действующих в наномолярных концентрациях и способных избирательно подавлять экспрессию определенных генов [8]. Для моделирования ортопедических заболеваний человека наиболее подходящим объектом исследования выступают двуногие животные. Модели на курах, относящихся к двуногим животным, наиболее точно имитируют вертикальное положение тела и подвержены силам гравитации, аналогичным действующим на человека. Ключевым фактором планирования эксперимента на курином эмбрионе явилось то, что эмбриогенез цыпленка хорошо изучен и аналогичен развитию эмбриона человека [9].
Цель исследования: создать модель болезни Блаунта на экспериментальном животном путем ингибирования экспрессии РАХ3 гена интерферирующей siРНК.
Материал и методы исследования. Проведение исследования одобрено Локальным этическим комитетом ФГБУ «ННИИТО им. Я.Л. Цивьяна» Минздрава России (выписка 023/21 из протокола №009/21 от 06.12.2021).
Подбор и синтез последовательности малой интерферирующей РНК (siРНК), направленной на мРНК гена PAX3, выполняли как описано ранее [7]. В исследовании использовалась siРНК к гену PAX3 (NM_204269.1): смысловая нить 5'-X-GCUmAGAUCmACmAUmGAAGAGUUU-3', антисмысловая 5'-ACUCUUCmAUmGUm GAUCUmAGCUU-3', где Cm, Um – 2’-О-метильные аналоги цитидина и уридина, соответственно, а Х – остаток холестерина, присоединенный аминогексильным линкером (n=6). Контрольную siРНК (Ch-siScr), не имеющую значимой гомологии с известными последовательностями мРНК курицы и человека, применяли для определения специфичности действия siРНК: смысловая нить 5'-X-CCmACUmACmAUmACGA GACUUGUU-3', антисмысловая 5'-CmAAGUCUCGUmAUmGUmAGUGGUU-3' [7]. Последовательности siРНК, направленных к гену PAX3, и контрольной siРНК использовали для конструирования холестеринсодержащих конъюгатов, обеспечивающих доставку siРНК в клетки-мишени. 5'-холестериновые конъюгаты siРНК (Ch-ѕіPAX) и Ch-siScr были получены как описано ранее [10]. Дуплексы siРНК с конечной концентрацией 50 мМ хранили при -20°C.
В культуре фибробластов кур по способности подавлять экспрессию гена-мишени была определена биологическая активность Ch-ѕіPAX и контрольной siРНК. Фибробласты цыпленка выделяли из 8-11-дневных куриных эмбрионов и культивировали в среде DMEM с добавлением 10% фетальной бычьей сыворотки (FBS) и антибиотика стрептомицин – пенициллин (100 мг/мл) в условиях CO2 инкубатора при температуре 37°С. Для эксперимента эмбриональные фибробласты куриц высевали в 24-луночные планшеты с плотностью 5×105 клеток на лунку. Через 24 ч питательную среду заменяли свежей DMEM, не содержащей сыворотки (200 мкл/лунка). Ch-ѕіPAX и контрольную siРНК (Ch-ѕіScr) добавляли к клеткам в 50 мкл Opti-Mem до конечной концентрации 5 µM. Альтернативно, клетки трансфицировали siРНК (200 nM) с использованием Липофектамина 2000 (Lipofectamine 2000, Invitrogen, США, (ѕіPAX+Lf)) согласно рекомендациям производителя (1 мкл на лунку). Через три дня после трансфекции из клеток выделяли суммарную РНК с использованием Trizol (Thermo Fisher Scientific, США). Реакцию обратной транскрипции (RT) проводили с использованием набора RT2 First Strand (QIAGEN, Германия) в соответствии с протоколом производителя. Полученную кДНК амплифицировали на термоциклере iCycler IQ5 (Bio-Rad, США) в реакционной смеси объемом 25 мкл, содержащей 5 мкл кДНК, 0,25 μM специфические праймеры (PAX3 прямой 5’-TAACCATGGTGGTGTGCCTC-3’; обратный 5’-GTGGTGCTATAGGTCGGTGG-3’) и смесь мастер-микс Biomaster HS-qPCR SYBR Blue (2×) (BioLab Mix, Россия) с ДНК-полимеразой горячего старта и флуоресцентным красителем SYBR-Green. Схема ПЦР в режиме реального времени (Real-Time PCR): один цикл 95°C – 3 мин., 40 циклов: 95 °C – 30 с, 58 °C – 30 с, 72°C – 30 с. Уровень мРНК PAX3 гена определяли относительно уровня мРНК гена «домашнего хозяйства» GAPDH (прямой 5’-AGATGCAGGTGCTGAGTATG-3’; обратный 5’-CTGAGGGAGCTGAGATGATAAC-3’). Все измерения были выполнены в трех повторах.
Эксперимент по ингибированию PAX3 гена проводили на яйцах кур породы Росс-308 (ROSS-308 – мясная порода бройлеров). Яйца инкубировали при температуре 37.5-38°C и влажности 50-55% в инкубаторе БИ2 «Несушка» на 104 яйца (в соответствии с руководством по эксплуатации). Масса одного яйца составляла 60-70 г. В исследование было включено 40 оплодотворенных яиц, разделенных на 4 группы (в каждой группе 10 яиц): экспериментальная, контрольная и 2 группы сравнения. В нервную трубку куриного эмбриона вводили siРНК к мРНК гена PAX3 (Ch-siPAX, экспериментальная группа) или siScr (Ch-siScr, контрольная группа). Для визуализации вводимого раствора использовали трипановый синий (C34H24N6Na4O14S4). Первую группу сравнения составили интактные яйца, во второй группе сравнения в нервную трубку куриного эмбриона производился укол стеклянным капилляром без введения вещества. Эксперимент выполнен на куриных эмбрионах, соответствующих 16-й стадии (53 часа) эмбрионального развития цыпленка по классификации Гамбургера-Гамильтона. Все манипуляции проведены в стерильных условиях и с использованием стерильного инструментария. В ходе эксперимента яйца дезинцифировали 70% спиртом. С острого конца яйца через специальный прокол отбирали 0.5 мл белка и вырезали отверстие размером 1.5х1.0 см. После вскрытия яйца визуально контролировали развитие эмбриона, наличие сердцебиения и определяли стадию эмбрионального развития. При соответствии развития цыпленка 16-й стадии по классификации Гамбургера-Гамильтона в нервную трубку куриного эмбриона вводили siРНК к мРНК гена PAX3 или siScr [7]. Введение веществ производили при помощи инжекторного шприца и стеклянного капилляра (Narishige Scientific Instrument Lab., Япония) под стереомикроскопом SteREO Discovery V12 (Carl Zeiss, Германия). Визуально оценивали сохранение анатомической целостности эмбриона (рис. 1).
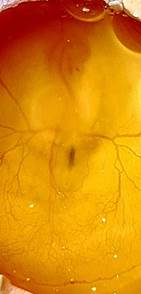
Рис. 1. Микрофотография куриного эмбриона на 16-й стадии эмбрионального развития по Гамбургеру и Гамильтону после введения в полость нервной трубки, интерферирующей siРНК к гену РАХ3. Визуализация трипановым синим, ув. х60
После проведения экспериментальных процедур для закрытия отверстия эмпирического яйца у яйца-донора вырезали участок скорлупы овальной формы размером 2.5х2.0 см. Фиксировали вырезанный фрагмент при помощи яичного белка. Первые сутки после эксперимента яйца не подвергали какому-либо физическому воздействию, в последующие дни инкубации ротировали в соответствии с руководством по эксплуатации инкубатора и физиологией развития куриного эмбриона. Инкубацию яиц контролировали до вылупления птенцов (рис. 2).

Рис. 2. Экспериментальные яйца из экспериментальной, контрольной групп и групп сравнения в период вылупления
Вылупившимся цыплятам для исключения возможности развития ожирения были обеспечены специальные условия содержания и сбалансированное питание на основе комбикормов, соответствующих возрасту птицы и обогащенных белково-витаминными-минеральными комплексами. В 2,5 и 4 месяца животным из экспериментальной и контрольной групп и групп сравнения было проведено рентгенологическое исследование нижних конечностей на цифровой рентгенографической системе GE Discovery XR656 (США). Диагностическое обследование в более раннем возрасте не информативно в связи со значительной долей хрящевой ткани в проксимальном отделе большеберцовой кости.
Результаты исследования и их обсуждение. Для проведения эксперимента на развивающихся куриных эмбрионах эффективность и специфичность ингибирующего действия подобранной Ch-ѕіPAX и контрольной siРНК (Ch-siScr) была определена на культуре фибробластов цыпленка (рис. 3). Через три дня после инкубации клеток с Ch-ѕіPAX уровень экспрессии гена РАХ3 составил 50% по сравнению с уровнем экспрессии данного гена в контрольных фибробластах (Control). В контроле – без введения siРНК, экспрессия гена РАХ3 была принята за 100%. В клетках, трансфицированных siРНК с использованием Липофектамина 2000 (ѕіPAX+Lf), уровень экспрессии гена РАХ3 соответствовал 44%. Экспрессия гена РАХ3 в клетках, инкубированных с Ch-ѕіScr, не отличалась от контроля.
Таким образом, в фибробластах, обработанных siРНК (Ch-ѕіPAX), уровень экспрессии гена РАХ3 достоверно не отличался от уровня экспрессии в клетках, обработанных этой же siРНК в комплексе с Липофектамином (ѕіPAX+Lf), и был ниже по сравнению с контрольными образцами. Проведенные авторами контрольные исследования показали, что применение siРНК в комплексе с Липофетамином при введении в нервную трубку эмбриона оказывает токсическое действие и препятствует развитию и вылуплению цыплёнка, поэтому для дальнейших экспериментов была выбрана Ch-siPAX. Ch-ѕіPAX в культуре клеток понижает уровень экспрессии гена РАХ3 на 50% без помощи трансфекционного агента и может быть использована для проведения эксперимента.
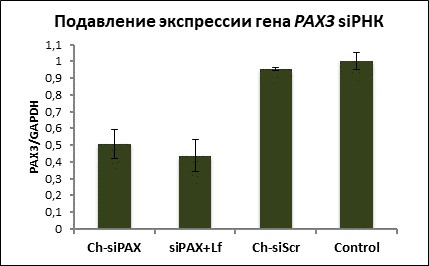
Рис. 3. Уровень экспрессии РАХ3 гена в культуре клеток куриного эмбриона. Результаты ПЦР в реальном времени в фибробластах, обработанных: siРНК к гену РАХ3 (Ch-siРАХ), siРНК к гену РАХ3 вместе с Липофектамином (siPAX + Lf), контрольной siРНК (Ch-siScr) и необработанные клетки (Control)
Способ моделирования болезни Блаунта основан на гипотезе о роли клеток нервного гребня в индуцировании варусной деформации коленных суставов. Нервный гребень – уникальная временная структура у эмбрионов позвоночных, формирующаяся из краевых отделов нервного желобка во время его замыкания в нервную трубку [11]. Мультипотентная популяция клеток, составляющая нервный гребень, обладает мощной способностью мигрировать по всему развивающемуся эмбриону и давать начало различным структурам [12; 13]. Образование гребня происходит вдоль оси тела в соответствии с рострокаудальным градиентом. Клетки претерпевают переход от эпителия к мезенхиме, что позволяет им свободно двигаться по определенным маршрутам, кульминацией которых является их остановка и фенотипическая дифференцировка [14]. Выделение клеток из нервного гребня и их миграция происходит волнообразно и следует непосредственно за волной сегментации сомитов от передней к задней части тела эмбриона. Сомиты – это первые сегментированные структуры, представленные парными блоками мезодермы и расположенные по обе стороны от нервной трубки и хорды [9]. В процессе эмбрионального развития осуществляется дифференцировка каждого сомита на миотом, склеротом и дерматом, из склеротома в дальнейшем образуются хрящи и кости скелета позвоночных. Склеротом развивается из вентральной области каждого сомита. Формирование почек нижних конечностей происходит на уровне 26-32 пар сомитов и соответствует 16-й и 17-й стадиям эмбрионального развития по классификации Гамбургера и Гамильтона (52-64 часа эмбриогенеза) [9]. В нервном гребне в соответствии с отделами зародыша выделают две основные популяции клеток: краниальную и стволовую (туловищный отдел эмбриона). Краниальные клетки являются плюрипотентными, образуют большое разнообразие производных и могут дифференцироваться во все основные типы клеток, включая такие виды соединительной ткани, как хрящ и кость [15]. В окончательной дифференцировке этих клеток критическую роль играет микроокружение. При пересадке краниальные клетки могут отказаться от своей предполагаемой судьбы и дифференцироваться в соответствии с новой средой. Исключением являются клетки стволового нервного гребня, не обладающие способностью формировать хрящ и кость и дающие начало нейронам и глии периферической нервной системы, меланоцитам и секреторным клеткам эндокринной системы [9; 13]. Из туловищной области эмбриона клетки нервного гребня мигрируют по трем путям: дорсолатеральному, между эктодермой и сомитами, вентромедиальному, между нервной трубкой и задним склеротомом и вентролатеральному, когда клетки движутся между сомитами и через различные части самого сомита. Таким образом, пути и конечные пункты миграции клеток туловищного отдела эмбриона находятся под критическим влиянием сигнальных молекул, присутствующих в данной ткани. Ключевым фактором миграции клеток нервного гребня является ген PAX3. PAX3 посредством регуляции экспрессии CXCR4 контролирует дифференцировку, миграцию, адгезию клеток-предшественников нервного гребня и мутации гена PAX3 приводят к нарушению миграции движущихся клеток [12].
В результате эксперимента на курином эмбрионе на 21-е сутки инкубации из яиц вылупились жизнеспособные птенцы. В возрасте 2.5 месяцев (75 дней) и 4 месяцев (122 дня) постнатального развития всем экспериментальным животным было проведено исследование нижних конечностей на цифровой рентгенографической системе. У цыплят из первой группы сравнения, вылупившихся из интактных яиц, в результате диагностики не было детектировано каких-либо структурных нарушений тазобедренных и коленных суставов. Аналогичные данные были получены и у цыплят из второй группы сравнения, которым в нервную трубку производился укол стеклянным капилляром без введения вещества. Деформации суставов не выявлено в 2,5 и 4 месяца постнатального развития и у цыплят из контрольной группы, которым в эмбриональном периоде в нервную трубку была произведена инъекция siScr, не имеющей значимой гомологии с известной последовательностью мРНК курицы и человека (рис. 4).
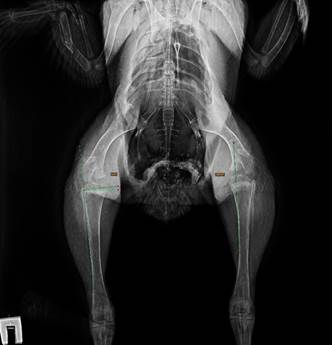
Рис. 4. Рентгенограмма цыпленка из контрольной группы без деформации нижних конечностей, 75 дней постнатального развития. Угол ММВ 108.9°, угол MDA 6.6°
У цыплят из экспериментальной группы с введением Ch-siPAX в нервную трубку куриного эмбриона на 16-й стадии эмбриогенеза по Гамбургеру и Гамильтону рентгенологическое исследование показало формирование варусной деформации коленных суставов при отсутствии изменений в тазобедренных суставах. На переднезадних скрининговых рентгенограммах детектировано расширение и смещение медиального метафиза проксимального отдела большеберцовой кости с образованием выпуклости, напоминающей клюв. Величина угла медиального метафизарного клюва (MMB) может служить потенциальным рентгенографическим параметром при диагностике стадии болезни Блаунта [2]. По мере роста цыплят угол ММВ увеличивался. В возрасте 2,5 месяцев данный показатель составлял 115-120°, в 4 месяца повышался до 122-125°. Аналогично изменялись значения метафизарно-диафизарного угла (MDA), являющегося основой для определения болезни Блаунта [1]: от 8-10° до 11-14° в 2,5 и 4 месяца соответственно (рис. 5). Измеряемые углы у животных из контрольных групп в процессе роста цыплят не менялись, угол ММВ был равен 95-109°, MDA 5-7° (рис. 4). У всех экспериментальных животных диагностировано искривление обеих нижних конечностей, сочетающееся с нарушением походки, переваливанием с ноги на ногу на фоне быстрой утомляемости при движении и невозможностью прохождения более 2 метров без перерыва. Ограничение движений, хромота и переломы костей не зарегистрированы. Таким образом, рентгенологическим исследованием коленных суставов детектированы изменения медиального отдела большеберцовой кости, характерные для болезни Блаунта. Полученные данные по увеличению углов ММВ и MDA в процессе роста и развития цыпленка могут свидетельствовать о прогрессировании деформации.
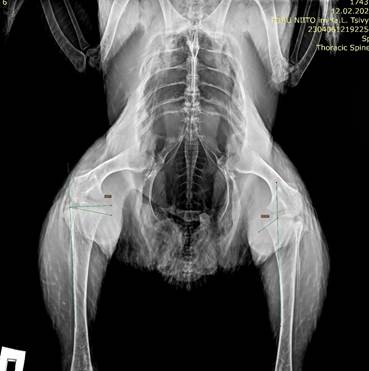
Рис. 5. Рентгенограмма цыпленка с варусной деформацией коленных суставов, 122 дня постнатального развития. Угол ММВ 124.8°, угол MDA 13.7°
Экспериментальные данные показывают, что в результате ингибирования у куриного эмбриона экспрессии гена РАХ3 интерферирующей siРНК на начальных этапах формирования почек нижних конечностей (53 часа эмбриогенеза, 16-я стадия эмбрионального развития по классификации Гамбургера и Гамильтона) в постнатальном периоде у цыпленка развивается варусная деформация коленных суставов. Механизм формирования деформации может быть представлен следующим образом. Введенная в нервную трубку siРНК приводит к снижению активности РАХ3 гена, и процесс миграции клеток нервного гребня нарушается. В 53 часа эмбриогенеза клетки, мигрирующие из туловищного отдела эмбриона и проходящие по вентролатеральному пути, оседают в той части сомита, из которой в дальнейшем развиваются анатомические структуры коленного сустава. Поскольку клетки стволовой популяции нервного гребня не способны формировать хрящ и кость, осевшие клетки не подвергаются хондрогенной дифференцировке и вызывают нарушение роста в данной области. Нарушение роста в зоне депонирования клеток в проксимальном отделе большеберцовой кости приводит к дезорганизации хрящевых и костных структур и выражается развитием болезни Блаунта.
Таким образом, рассматриваемый способ моделирования болезни Блаунта основан на депонировании клеток нервного гребня в формирующемся склеротоме куриного эмбриона путем ингибирования экспрессии РАХ3 гена siРНК в 53 часа эмбрионального развития. Нарушения морфогенеза коленных суставов, заложенные в эмбриогенезе, в постнатальном периоде реализуются в болезнь Блаунта со всеми клиническими признаками.
Заключение. Модель болезни Блаунта получена в эксперименте путем ингибирования экспрессии РАХ3 гена интерферирующей siРНК на 16-й стадии эмбрионального развития цыпленка по классификации Гамбургера и Гамильтона в период формирования почек нижних конечностей. Проведенное исследование является пилотным. Первые результаты диагностированы рентгенологическим методом и свидетельствуют о варусной деформации коленных суставов. Экспериментальные данные позволили прийти к обоснованному выводу о роли клеток нервного гребня в развитии болезни Блаунта. Создание экспериментальной модели с запрограммированной ортопедической патологией в будущем позволит исследовать этиологический фактор и патогенетические механизмы рассматриваемого заболевания.



