В настоящее время имеются различные предположения, позволяющие объяснить связь между аномалиями развития сердечно-сосудистой и мочевыводящей систем [1]. По данным литературы известно, что органы данных систем происходят из одного зародышевого листка – мезодермы, при нарушении развития которой в процессе эмбриогенеза возникают врожденные пороки [1]. Эти изменения могут вместе формировать различные синдромы и хромосомные патологии либо встречаться в виде спорадических случаев [1]. В нашем клиническом примере представлен случай врожденной сочетанной патологии: L-образная почка и аномальное отхождение левой коронарной артерии (АОЛКА) от легочного ствола. Редкий врожденный порок сердца (ВПС), когда левая коронарная артерия отходит не от аорты, а от легочной артерии (ЛА), называется синдромом Бланда – Уайта – Гарланда (СБУГ) [2–4]. При данной патологии нарушается нормальное кровоснабжение сердца, что ведет к развитию ишемических изменений в миокарде [2, 4]. Клинически диагностика затруднена в силу того, что СБУГ может иметь «маски» других нозологий сердечно-сосудистой системы: миокардита, дилатационной кардиомиопатии, инфаркта миокарда, митральной недостаточности [5]. Для уточнения диагноза используются: ЭКГ, ЭХОКГ, рентгенологическое исследование, компьютерная и магнитно-резонансная томография, а также перфузионная сцинтиграфия [4, 6]. В настоящее время существует 9 эхокардиографических признаков АОЛКА: 1) выраженная дилатация левого желудочка (ЛЖ); 2) снижение насосной функции ЛЖ; 3) формирование аневризмы ЛЖ; 4) уплотнение эндокарда ЛЖ; 5) расширение фиброзного кольца митрального клапана (МК); 6) недостаточность МК; 7) расширение устья и проксимального отдела правой коронарной артерии (КА); 8) отсутствие визуализации устья левой КА; 9) систолодиастолический поток в ЛА по данным ЭхоКГ [7]. Консервативное лечение не является эффективным, поэтому всегда встает вопрос о хирургическом вмешательстве [8]. В своей статье М.И. Умалатова делает вывод о том, что имеется определенный патогенетический механизм, способствующий более высокой сочетаемости патологии сердечно-сосудистой и мочевыводящей систем, чем следовало бы ожидать при простом совпадении [1]. А также приводит пример исследования, где S. Mukhopadhyay и соавт. (1991) из 667 детей с пороками сердечно-сосудистой системы у 51 ребенка обнаружили аномалии мочевыводящей системы, что составило 7,53 %, но какой-либо закономерности между данными патологиями выявлено не было [1]. М.В. Эрман и соавт. наблюдали 190 детей с аномалиями развития мочевой системы в возрасте от 2 месяцев до 16 лет [9]. ВПС обнаружен у 25 детей (13,2 %). Чаще всего из ВПС встречались: дефект межжелудочковой перегородки – 28 %, открытый артериальный проток – 20 % и дефект межпредсердной перегородки – 16 % [9].
Цель исследования – описание клинического случая сочетания аномального отхождения левой коронарной артерии с патологией мочевыводящей системы. В данном наблюдении отображается сложность диагностики синдрома Бланда – Уайта – Гарланда на фоне сопутствующей аномалии.
Материалы и методы исследования
Ребенок П. от первой беременности, протекавшей на фоне хронического пиелонефрита, хронической почечной недостаточности, гестоза, гипоксии плода, двукратного обвития пуповины вокруг шеи плода. Роды на сроке 37 недель путем экстренного кесарева сечения в связи с начавшейся асфиксией новорожденного. Оценка по шкале APGAR 7/7 баллов. Вес при рождении – 2660 г, рост – 46 см. Девочка с отягощенной наследственностью по заболеваниям мочевыводящей системы: у мамы прооперирован пузырно-мочеточниковый рефлюкс, хронический пиелонефрит в анамнезе. Ребенок с рождения находится под наблюдением кардиолога с диагнозом: врожденный порок сердца – межпредсердное сообщение, выявленное при рождении; уролога с диагнозом: L-образная почка, двусторонний смешанный пузырно-мочеточниковый рефлюкс II cтепени справа, IV cтепени слева; невролога с диагнозом: краниостеноз. В возрасте 1 года 8 месяцев поступила в отделение урологии детской республиканской клинической больницы (ДРКБ) по экстренным показаниям в связи с обострением инфекции мочевыводящих путей (ИМВП) (подъем температуры тела до 38,5 °С, в общем анализе мочи выявлена лейкоцитурия до 50 клеток в поле зрения) для обследования и лечения. При опросе мама предъявляла жалобы на подъем температуры у ребенка до 38,5 °С, вялость, снижение аппетита. При осмотре: общее состояние средней степени тяжести, сознание ясное. Температура тела 38,5 °С. Вес 9 кг (ниже 2 центиля), рост 76 см (ниже 2 центиля). Подкожно-жировой слой истончен на туловище и конечностях. Кожные покровы бледные, цианоз носогубного треугольника, видимых слизистых. Видна пастозность голеней и передней брюшной стенки. Грудная клетка с признаками эмфиземы. Отмечалась одышка с участием вспомогательной мускулатуры, втяжением уступчивых мест грудной клетки. При аускультации в нижних отделах легких выслушивались единичные влажные мелко-пузырчатые хрипы. ЧД до 50 в мин. Пальпаторно верхушечный толчок смещен влево на 1,5 см кнаружи от срединно-ключичной линии. Перкуторно границы сердца расширены влево до передней подмышечной линии. Аускультативно ритм правильный, тоны сердца приглушены, систолический шум митральной недостаточности средней интенсивности на верхушке и в 5 точке. Живот мягкий, не вздут. Печень выступает из-под края реберной дуги на 1 см. Область почек визуально не изменена. Симптом поколачивания поясничной области положительный с обеих сторон.
При анализе медицинской документации установлено: на амбулаторной ЭХОКГ (в возрасте 1 месяца) расширения полостей не выявлено. На амбулаторной ЭКГ регистрируется синусовая тахикардия, отклонение электрической оси сердца (ЭОС) влево, инверсия зубца Т и снижение сегмента ST. В связи с этим направлена на консультацию к кардиологу, но данные об осмотре кардиологом в амбулаторной карте отсутствуют.
При поступлении в условиях стационара выполнено ЭХОКГ, где отмечается снижение фракции выброса (ФВ) ЛЖ до 44 %, дилатация левых отделов сердца, конечный диастолический размер (КДР) ЛЖ 35 мм, полость левого предсердия 24 мм, выраженная недостаточность митрального клапана. Гипокинезия свободной стенки ЛЖ. Выпот в полости перикарда по передней стенке 5–7 мм, по задней – 1–2 мм (рис. 1).
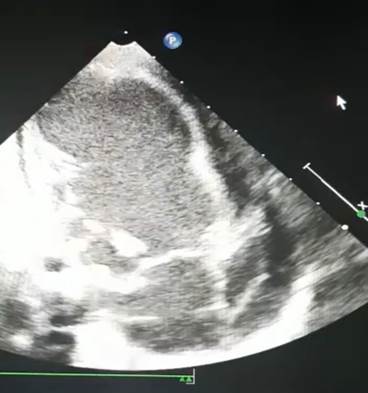
Рис. 1. ЭхоКГ: дилатация левых отделов сердца. Конечный диастолический размер левого желудочка 35 мм, фракция выброса 44 %, полость левого предсердия 24 мм, выпот в полости перикарда
На ЭКГ зарегистрировано: синусовый ритм с ЧСС 107–106 уд/мин, эпизод брадикардии с ЧСС до 65 уд/мин. Электрическая ось сердца отклонена резко влево. Блокада правой ножки, передней ветви левой ножки пучка Гиса. Сегмент ST в V2-V3 ниже изолинии на 2мм, в V4-V6 ST двухфазный (рис. 2).
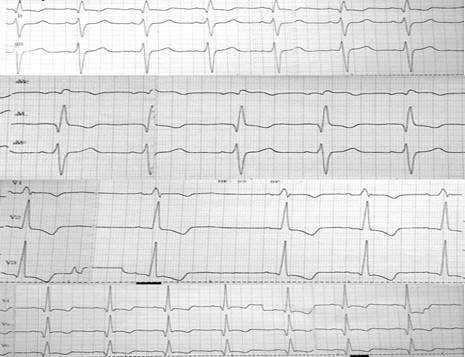
Рис. 2. ЭКГ: синусовый ритм с ЧСС 107–106 уд/мин, эпизод брадикардии с ЧСС до 65 уд/мин. Электрическая ось сердца отклонена резко влево. Блокада правой ножки, передней ветви левой ножки пучка Гиса. Сегмент ST в V2-V3 ниже изолинии на 2 мм, в I, V4-V6 ST двухфазный отрицательный. ЭКГ-признаки диастолической перегрузки левого желудочка
В биохимическом анализе крови: мочевина 20,0 ммоль/л (норма 1,8–6 ммоль/л), креатинин 0,13 ммоль/л (0,021–0,036 ммоль/л), резкое снижение фильтрационной функции 28–29 мл/мин (норма 80–120 мл/мин), мочевая кислота 414 мкмоль/л (142,8–339,2 мкмоль/л), лактатдегидрогиназа и креатинфосфокиназа в пределах нормы. Также обнаружены: маркер повреждения миокарда – тропонин I 0,052 нг/мл (норма до 0,020 нг/мл), повышение уровня натрий-уретического пептида (NT-proBNP) до 30000 пг/мл (норма до 125 пг/мл). Проведение УЗИ почек и органов брюшной полости выявило признаки гепатомегалии, реакции сосудов печени, L-образную дистопированную почку справа. На рентгенограмме органов грудной клетки выявлено усиление легочного рисунка, кардиомегалия, кардио-торакальный индекс составлял 71 % (норма до 55 %) (рис. 3).
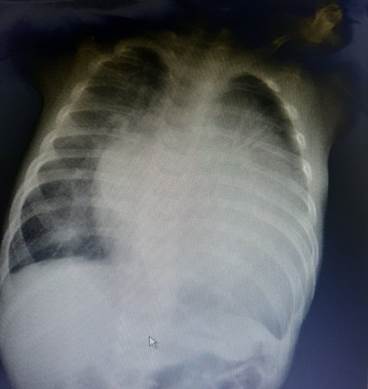
Рис. 3. Кардиомегалия, кардио-торакальный индекс 71 %
Учитывая порок развития мочевыводящей системы и выраженность нарушения функции почек, изменения со стороны сердца были расценены как вторичные. На основании данных анамнеза, объективного осмотра и результатов обследования выставлен диагноз: кардиоренальный синдром, вторичная кардиомиопатия. Нарушение проводимости – двухпучковая блокада: передней ветви левой ножки пучка Гиса и правой ножки пучка Гиса. Сердечная недостаточность (СН) III степени по Ross. Белково-энергетическая недостаточность 2 степени.
За время госпитализации получала терапию, направленную на лечение основного заболевания – инфекции мочевыводящих путей: антибактериальные препараты (цефтриаксон 0,4 г/сут в/в капельно, фуразидин по 5 мг/кг/сут, внутрь). Нормализация и стабилизация работы сердечно-сосудистой системы достигалась следующими терапевтическими действиями: снижение пред- и постнагрузки на сердце за счет уменьшения объема циркулирующей крови диуретиками (фуросемид 1 мг/кг/сут, внутримышечно), ингибиторами АПФ (эналаприл по 1,25 мг 1 р/сут, внутрь), улучшение энергетического обмена в миокарде (левокарнитин 30 % по 5 капель 3 р/сут, внутрь). В качестве жаропонижающего применялся ибупрофен в дозе 10 мг/кг, внутрь. Для профилактики тромбообразования использовались антиагреганты (дипиридамол 5 мг/кг в сутки в 3 приема, внутрь). Однако несмотря на проводимую терапию сохранялись признаки сердечной недостаточности: одышка до 60 в минуту, влажные хрипы в легких, девочка перестала спать на спине (только на высокой подушке). По ЭхоКГ отмечалось снижение ФВ до 27,5 %, увеличение КДР до 39 мм, резкая гипокинезия задней стенки левого желудочка, визуализировалось количество выпота в полости перикарда до 10 мм по передней стенке и до 4 мм по задней стенке ЛЖ, выраженная митральная недостаточность.
По тяжести состояния ребенок переведен в отделение реанимации и интенсивной терапии, где подключены инотропные негликозидные препараты – допамин в дозе 0,5 мкг/кг/мин в\в капельно, а затем сердечные гликозиды (дигоксин в поддерживающей дозе 0,01 мг/кг/сут, внутрь), увеличена доза фуросемида до 3 мг/кг/сут, подключен спиронолактон 3 мг/кг/сут. С антиагрегантной целью назначен гепарин 600 МЕ/кг/сут в/в капельно с переходом на ацетилсалициловую кислоту по 12,5 мг/сут, внутрь. В качестве метаболической терапии использовался фосфокреатин 500 мг/сут, в/в капельно. На фоне лечения состояние ребенка стабилизировалось: уменьшились одышка, цианоз. По данным ЭхоКГ отмечалась положительная динамика, так ФВ возросла до 36 %, затем до 48 %. КДР ЛЖ до 33 мм. Выпот в полости перикарда до 6 мм по передней стенке и до 2 мм – по задней.
Учитывая отставание ребенка в физическом развитии, проявления нарушения кровообращения, изменения на ЭКГ ишемического характера (инверсия зубца Т и снижение сегмента ST, которые присутствовали и на амбулаторных пленках), высокие маркеры повреждения миокарда – тропонин I 0,052 нг/мл, NT-proBNP до 30000 пг/мл, выраженную дилатацию полости и гипокинезию стенки ЛЖ с явлениями митральной недостаточности, низкую сократительную способность миокарда левого желудочка: ФВ 27,5 – 36–48 %, предположен ВПС – АОЛКА и выставлен диагноз: множественные врожденные пороки развития: ВПС – аномальное отхождение левой коронарной артерии от легочной артерии? Нарушение кровообращения 2Б степени. СН III степени по Ross. Недостаточность митрального клапана. L-образная дистопированная почка справа. Пузырно-мочеточниковый рефлюкс слева 2 степени, справа 4 степени. Краниостеноз. Белково-энергетическая недостаточность 2 степени. В дифференциальный ряд включены диагнозы: Кардит? Дилатационная кардиомиопатия? Врожденная недостаточность митрального клапана?
Результаты исследования и их обсуждение
Для уточнения диагноза и дальнейшей тактики ведения ребенок направлен для консультации в Федеральный центр сердечно-сосудистой хирургии (ФЦ ССХ) г. Пенза, где диагноз был подтвержден по ЭхоКГ: левые отделы сердца дилатированы. Левая коронарная артерия в типичном месте не лоцируется, отходит от легочной аорты чуть выше клапана ЛА. ЛА не изменена. Сократимость резко снижена. ФВ 45 %. Признаки АОЛКА от ЛА, резкое снижение систолической функции ЛЖ. В экстренном порядке рекомендовано оперативное лечение. После обследования девочка направлена в Национальный медицинский исследовательский центр им. А.Н. Бакулева (г. Москва), была назначена дата операции, но во время проведения предоперационной коронарографии под наркозом наступил летальный исход.
Заключение
Современные методы исследования позволяют выявить наличие врожденной патологии на различных этапах онтогенеза, что позволяет начать своевременное лечение. Поэтому всегда нужно помнить о распространенности сочетания пороков, в данном случае пороков сердечно-сосудистой и мочевыводящей систем, чтобы как можно раньше назначить необходимый комплекс обследований и предотвратить развитие тяжелой клинической картины, а в последующем и гибель ребенка.



