Среди причин смерти населения большинства экономически развитых стран мира сердечно-сосудистые заболевания продолжают занимать лидирующие позиции. Причем инфаркт миокарда играет значительную роль в общей структуре смертности от сердечно-сосудистых заболеваний [1].
В последнее десятилетие подходы к терапии острого инфаркта миокарда с подъемом сегмента ST (ИМпST) претерпели значительные изменения. Во многом это обусловлено активным внедрением в клиническую практику чрескожных коронарных вмешательств (ЧКВ). В Российской Федерации реализация программы создания сосудистых центров с 2008 г. и работа в рамках Федерального проекта «Борьба с сердечно-сосудистыми заболеваниями» с 2018 г. позволили значительно улучшить динамику доступности эндоваскулярной помощи пациентам с острым ИМпST [2]. Все это отразилось в сокращении частоты летальности при ИМ на госпитальном этапе [2, 3].
Несмотря на достигнутые успехи, результаты лечения пациентов с острым ИМпST на отдаленном этапе остаются недостаточно изученными. На сегодняшний день лишь отдельные исследования были посвящены оценке прогноза лечения при наблюдении продолжительностью 5 лет и более [4, 5, 6, 7]. Было показано, что, несмотря на использование современных реперфузионных стратегий и снижение летальности на госпитальном этапе, вероятность летального исхода за 5 лет наблюдения остается достаточно высокой и составляет около 20% [4]. При этом в период от 1 года до 5 лет ежегодный риск летального исхода составляет более 2% [5, 6, 7]. Учитывая эти данные, изучение потенциальных предикторов летального исхода при отдаленном наблюдении у пациентов с острым ИМпST является важной научно-исследовательской задачей.
Таким образом, целью настоящего исследования явилось определение предикторов летального исхода у пациентов с острым ИМпST по результатам 5-летнего проспективного наблюдения.
Материалы и методы исследования
В исследование были включены 194 пациента, вошедших в «Проспективный регистр чрескожных коронарных вмешательств» (свидетельство о регистрации базы данных 2020621655 от 11.09.2020 г.) [8]. Всем пациентам в период с октября 2012 г. по ноябрь 2013 г были выполнены ЧКВ по поводу острого ИМпST.
Перед ЧКВ все больные получали нагрузочную дозу антиагрегантных препаратов в соответствии с актуальными клиническими рекомендациям. Перед проведением ЧКВ у всех пациентов определяли степень коронарного тромбоза, используя шкалу TTG (TIMI Trombus Grade Score). Результаты ЧКВ оценивали по шкале TIMI для определения степени коронарного кровотока в инфаркт-связанной артерии, а также степень флуоресценции миокарда по шкале MBG. Технические особенности выполнения ЧКВ не регламентировались и оставались на усмотрение рентгенэндоваскулярного хирурга.
В случае первичных ЧКВ время ишемии миокарда рассчитывали как период между началом болевого синдрома и введением коронарного проводника в артерию, связанную с инфарктом. В случае применения фармакоинвазивной стратегии время ишемии миокарда определяли как интервал между началом болевых симптомов и введением тромболитического препарата.
На догоспитальном этапе, когда применялась фармакоинвазивная стратегия, использовали полную дозу тенектеплазы для проведения тромболитической терапии. Эффективность тромболитической терапии оценивали через 60 мин. Тромболизис считался успешным при наличии резолюции сегмента ST более 50% по данным ЭКГ. В этом случае в течение 24 часов после ТЛТ выполняли ранние рутинные ЧКВ. В альтернативном случае выполняли экстренные спасительные ЧКВ.
Ангиографическим успехом вмешательства являлись восстановление коронарного кровотока TIMI 3, миокардиальное свечение MBG 3, отсутствие эмболизации дистальных отделов основного сосуда и боковых ветвей, а также отсутствие пристеночных тромбов. Критериями развития феномена «no-reflow» по данным коронароангиографии были: степень миокардиального свечения по шкале MBG менее 3 и/или степень коронарного кровотока по шкале TIMI менее 3.
Для анализа эффективности лечения была проведена оценка нескольких ключевых показателей, включая частоту летальности, рецидив ИМ и тромбоз стента. Кроме того, производилась оценка комбинированных показателей, таких как MACСE (Major Adverse Cardiovascular and Cerebrovascular Events), который включал в себя различные сердечно-сосудистые и сосудисто-мозговые осложнения, такие как смерть, рестеноз и/или тромбоз стента, повторный нефатальный ИМ, инсульт и коронарное шунтирование.
Для оценки отдаленных результатов лечения все пациенты приглашались на очный прием. В случае невозможности проведения очного приема для получения информации о пациентах использовался следующий алгоритм: анализировались данные электронной медицинской карты для выявления повторных госпитализаций и обращений к кардиологу, осуществлялись телефонные контакты с родственниками больных. Если пациент проходил стационарное лечение в другом медицинском учреждении за время наблюдения, то во время телефонного опроса запрашивалась информация из выписного эпикриза.
Всеми пациентами было подписано информированное согласие на участие в исследовании. Протокол исследования одобрен этическим комитетом учреждения, протокол № 63 от 21.05.2012 г. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Анализ данных, полученных в ходе исследования, был проведен при помощи пакета статистических приложений (SPSS, версия 21.0 (SPSS Inc.), R4.2 (Vienna)). При нормальном распределении результаты были представлены в виде среднего значения и стандартного отклонения (M±SD), при асимметричном распределении – медианы (Ме) с интерквартильным размахом. Распределение количественных переменных определяли с помощью критерия Колмогорова–Смирнова. Различия между группами считали статистически значимыми при р<0,05. Для определения факторов риска смерти в течение периода наблюдения использовалась модель регрессии пропорциональных рисков Кокса. Анализировались 98 клинических, лабораторных и ангиографических факторов с помощью унивариантного анализа. В мультивариантную модель были включены те показатели, которые были ассоциированы с летальным исходом при унивариантном анализе. Выживаемость оценивали по методу Каплана–Мейера с использованием F-критерия Кокса и логарифмического рангового теста (log-rank test).
Результаты
Из 194 пациентов, включенных в «Проспективный регистр чрескожных коронарных вмешательств», результаты лечения за 5-летний период наблюдения были оценены у 170 (87,6%) больных. При этом у выживших пациентов результаты были оценены в ходе очного визита в 53,7% случаев. Исходная клинико-ангиографическая характеристика больных представлена в таблице 1.
Таблица 1
Исходная клинико-ангиографическая характеристика пациентов
|
Показатель
|
Абсолютное число
|
% |
|
|
Возраст, годы |
61,6 ±11,1 |
||
|
Мужской пол |
110 |
64,7 |
|
|
Курение |
69 |
40,6 |
|
|
Ожирение |
72 |
42,4 |
|
|
ИБС в анамнезе |
56 |
32,9 |
|
|
ИМ в анамнезе |
28 |
16,5 |
|
|
ЧКВ в анамнезе |
10 |
5,9 |
|
|
КШ в анамнезе |
1 |
0,6 |
|
|
Уровень глюкозы в плазме крови, ммоль/л |
8,1 [6,8;9,7] |
||
|
Сахарный диабет в анамнезе |
27 |
15,9 |
|
|
СКФ |
89,2±30,4 |
||
|
Артериальная гипертония в анамнезе |
124 |
72,9 |
|
|
Хроническая обструктивная болезнь легких |
13 |
7,6 |
|
|
Хроническая болезнь почек |
7 |
4,1 |
|
|
Острая сердечная недостаточность (по Killip) |
I |
152 |
89,4 |
|
II |
7 |
4,1 |
|
|
III |
3 |
1,8 |
|
|
IV |
8 |
4,7 |
|
|
Желудочковые нарушения ритма
|
20 |
11,8 |
|
|
Полная атриовентрикулярная блокада |
2 |
1,2 |
|
|
Фибрилляция предсердий |
18 |
10,6 |
|
|
Медиана времени от возникновения болевого синдрома до поступления в стационар, минуты |
120 [60;183,3] |
||
|
Медиана времени «дверь-баллон», минуты |
95 [65;167,5] |
||
|
Медиана времени от возникновения болевого синдрома до введения тромболитика*, минуты |
85 [53;176,3] |
||
|
Медиана общего времени ишемии миокарда, минуты |
234,5 [144,5;475,8] |
||
|
Прямая госпитализация (самообращение/служба СМП) |
149 |
87,6 |
|
|
Инфаркт-связанная артерия |
ствол ЛКА |
4 |
2,4 |
|
ПМЖА |
81 |
47,6 |
|
|
ОВ ЛКА |
13 |
7,6 |
|
|
ПКА |
65 |
38,2 |
|
|
артерии второго порядка |
9 |
5,3 |
|
|
Не инфаркт-связанное гемодинамически значимое поражение ствола ЛКА |
4 |
2,4 |
|
|
Степень коронарного тромбоза TTG 4-5 |
105 |
61,8 |
|
|
Количество баллов по шкале SYNTAX |
13 [7;19,6] |
||
|
Использование стентов с антипролиферативным покрытием |
65 |
41,1 |
|
|
Трансрадиальный доступ |
170 |
100 |
|
|
Тромболизис на догоспитальном этапе |
38 |
22,4 |
|
|
Первичное ЧКВ |
132 |
77,6 |
|
|
«Спасительное» ЧКВ* |
13 |
7,6 |
|
|
Среднее количество имплантированных стентов |
1,03±0,44 |
||
Примечание: ИМ – инфаркт миокарда; ИБС – ишемическая болезнь сердца; ЧКВ – чрескожное коронарное вмешательство; КШ – коронарное шунтирование; СМП – скорая медицинская помощь; ПКА – правая коронарная артерия; ЛКА – левая коронарная артерия; ОВ – огибающая ветвь; ПМЖА – передняя межжелудочковая артерия; * – в случае использования фармакоинвазивной стратегии
При анализе клинической характеристики было выявлено, что большинство пациентов были мужчины, средний возраст составил 61,6 года. Наблюдалась высокая распространенность факторов риска развития ИБС, таких как АГ, курение, ожирение. Тромболитическая терапия на догоспитальном этапе проводилась у каждого пятого пациента. Из них в 34% случаев проводилось «спасительное» ЧКВ, обусловленное отсутствием критериев реперфузии после проведения тромболитической терапии. При анализе ангиографической характеристики было выявлено, что степень коронарного тромбоза градации TTG 4-5 определялась более чем у половины пациентов. В большинстве случаев инфаркт-связанной являлась передняя межжелудочковая артерия. Стенты с антипролиферативным покрытием использовались менее чем в половине случаев.
Госпитальные результаты лечения, а также результаты через 1 год и 5 лет наблюдения представлены в таблице 2. Медианное значение продолжительности наблюдения составило 365 [350;365] дней и 62 [59,8;65] месяца соответственно.
Таблица 2
Результаты лечения на госпитальном этапе и результаты 1-летнего и 5-летнего наблюдения
|
Показатель |
Госпитальные результаты |
Результаты 1-летнего наблюдения |
Результаты 5-летнего наблюдения |
||||
|
Абсолютное число |
% |
Абсолютное число |
% |
Абсолютное число |
% |
||
|
Смерть от всех причин |
8 |
4,7 |
16 |
9,4 |
34 |
20 |
|
|
Смерть от сердечно-сосудистых причин |
8 |
4,7 |
15 |
8,8 |
25 |
14,7 |
|
|
Рецидив /повторный инфаркт миокарда |
4 |
2,4 |
8 |
4,7 |
16 |
9,4 |
|
|
Тромбоз стента |
1 |
0,6 |
2 |
1,2 |
3 |
1,8 |
|
|
Рестеноз в стенте |
– |
– |
6 |
3,5 |
19 |
11,2 |
|
|
Повторное чрескожное коронарное вмешательство |
1 |
0,6 |
17 |
10 |
41 |
24,1 |
|
|
Коронарное шунтирование |
– |
– |
4 |
2,4 |
7 |
4,1 |
|
|
Инсульт |
1 |
0,6 |
2 |
1,2 |
5 |
2,9 |
|
|
МАССЕ (смерть, повторный инфаркт миокарда, рестеноз и/или тромбоз стента, инсульт) |
12 |
7,1 |
29 |
17,1 |
62 |
36,4 |
|
|
Неполная реваскуляризация коронарного русла |
71 |
41,8 |
64 |
37,6 |
54 |
31,8 |
|
При анализе результатов лечения было установлено, что частота смерти от всех причин по результатам 5-летнего наблюдения увеличилась в 2 раза по сравнению с результатами 1-летнего наблюдения. Смерть наступила от сердечно-сосудистых причин в 73,5% случаев. За период наблюдения рестеноз в стенте определялся у каждого десятого пациента, которому выполнялись повторная реваскуляризация или коронарное шунтирование. У каждого третьего пациента в течение пятилетнего периода наблюдения определялось развитие основных неблагоприятных кардиоцеребральных событий (МАССЕ), к которым относились смерть, повторный инфаркт миокарда, рестеноз и/или тромбоз стента, инсульт. В то же время по результатам наблюдения реваскуляризация миокарда в полном объеме не была достигнута у 31,8% больных.
Результаты унивариантного и мультивариантного регрессионного анализа пропорциональных рисков Кокса представлены в таблице 3.
Таблица 3
Регрессионная модель пропорциональных рисков Кокса, демонстрирующая влияние переменных на смертность, по данным 5-летнего наблюдения
|
|
Унивариантный анализ
|
Мультивариантный анализ |
||
|
Показатель |
ОР (95% ДИ) |
р |
ОР (95% ДИ) |
р |
|
Возраст, лет |
1,06 (1,03–1,09) |
0,001 |
1,06 (1,03–1,10) |
0,001 |
|
Скорость клубочковой фильтрации, мл/мин/1,73 м2 |
0,99 (0,98–1,00) |
0,086 |
|
|
|
Содержание эритроцитов в плазме крови, 1012/л |
0,99 (0,98–1,00) |
0,086 |
|
|
|
Содержание гемоглобина, г/л |
0,98 (0,96–0,997) |
0,025 |
|
|
|
Прием диуретиков при поступлении |
2,68 (1,03–6,93) |
0,042 |
|
|
|
Частота сердечных сокращений при поступлении, ударов в минуту |
1,03 (1,01–1,05) |
0,001 |
|
|
|
Фракция выброса левого желудочка при выписке, % |
0,904 (0,86–0,95) |
<0,001 |
0,93 (0,87–0,99) |
0,021 |
|
Имплантация стентов с антипролиферативным покрытием |
0,50 (0,22–1,13) |
0,096 |
|
|
|
Неуспешное чрескожное коронарное вмешательство |
3,91 (1,93–7,91) |
<0,001 |
2,78 (1,16–6,71) |
0,023 |
|
Остаточное поражение по шкале Syntax, баллы |
1,03 (0,99–1,06) |
0,058 |
|
|
По результатам мультивариантного анализа предикторами летального исхода по данным 5-летнего наблюдения явились возраст, фракция выброса левого желудочка при выписке из стационара и неуспешное ЧКВ. При этом вероятность летального исхода увеличивается на 6% с увеличением возраста на каждый год; вероятность летального исхода снижается на 7% с увеличением фракции выброса левого желудочка на каждый процент; неуспешное ЧКВ ассоциировалось с увеличением риска летальности за 5 лет наблюдения в 2,78 раза.
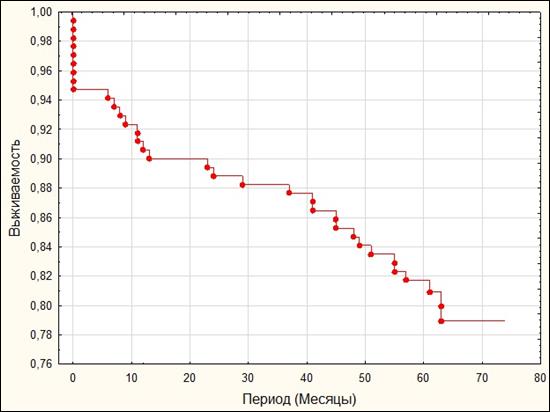 |
По результатам анализа Каплана–Мейера кумулятивная выживаемость в общей группе в конце периода наблюдения составила 79% (рис. 1). Кумулятивная выживаемость в группе пациентов возрастом менее 65 лет составила 88,6%, в то время как в группе 65 лет и старше – 63,1% (Log-Rank Test=–3,61, p<0,001) (рис. 2). Кумулятивная выживаемость в группе пациентов с сохранной ФВ ЛЖ составила 87,3%, в группе с промежуточной ФВ ЛЖ – 82,3%, в группе с низкой ФВ ЛЖ – 56,5% (рис. 3). При этом не было выявлено статистически значимых различий между группами пациентов с сохранной и промежуточной ФВ ЛЖ по показателю кумулятивной выживаемости (Log-Rank Test=–0,85, p=1,182). В то же время у пациентов с низкой ФВ показатель кумулятивной выживаемости был статистически значимо ниже в сравнении с пациентами с промежуточной ФВ (Log-Rank Test=–2,75, p=0,018) и сохраненной ФВ ЛЖ (Log-Rank Test=–3,16, p=0,005). Также следует отметить, что у пациентов с сохраненной фракцией выброса первый летальный случай был отмечен только через 11 месяцев наблюдения. Кумулятивная выживаемость пациентов после успешного ЧКВ составила 83,4%, после неуспешного ЧКВ – 55,6% (Log-Rank Test=–3,62, p<0,001) (рис. 4).
Рис. 1. Анализ Каплана–Мейера. Выживаемость в общей группе пациентов по данным 5-летнего наблюдения
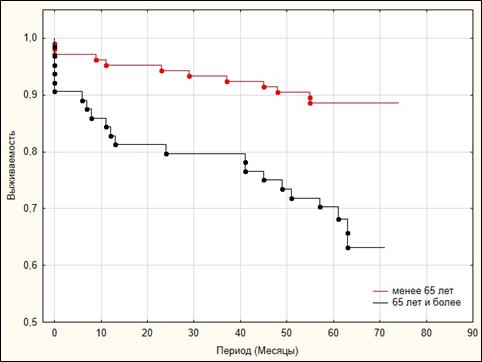 |
Рис. 2. Анализ Каплана–Мейера. Выживаемость в зависимости от возрастной группы по данным 5-летнего наблюдения
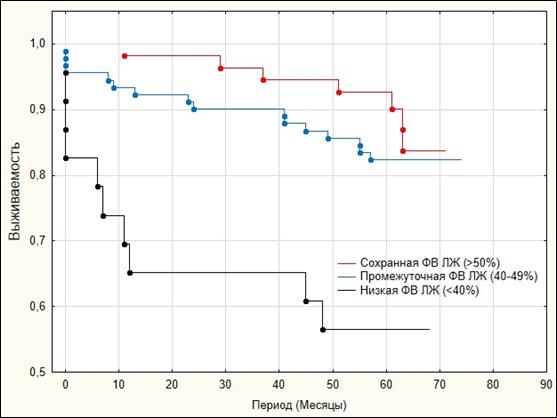 |
Рис. 3. Анализ Каплана–Мейера. Выживаемость в зависимости от фракции выброса левого желудочка при выписке по данным 5-летнего наблюдения
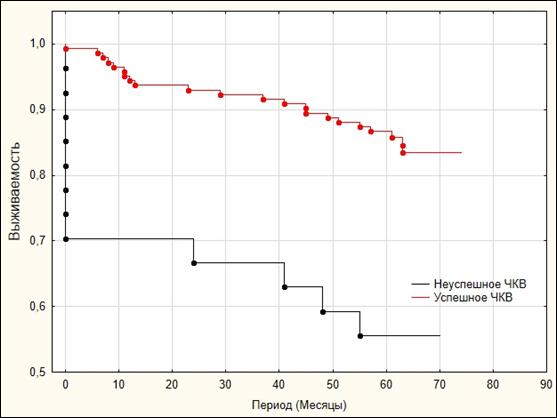 |
Рис. 4. Анализ Каплана–Мейера. Выживаемость в зависимости от достижения непосредственного ангиографического успеха ЧКВ по данным 5-летнего наблюдения
Отдельно была проанализирована динамика фракции выброса левого желудочка за период наблюдения (рис. 5). Было определено, что в группе с низкой фракцией выброса ЛЖ при выписке (<40%) ее восстановление до нормальных значений (>50%) определялось лишь в 8,7% случаев. При этом в группе пациентов с промежуточной фракцией выброса левого желудочка (40–49%) ее восстановление до нормальных значений (>50%) определялось в 76,3% случаев.
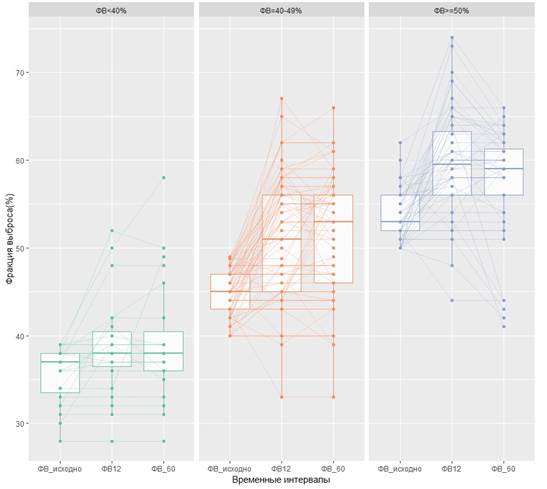
Рис. 5. Динамика фракции выброса левого желудочка за период наблюдения
Результаты исследования и их обсуждение
Результаты проведенного исследования продемонстрировали существенный тренд увеличения основных неблагоприятных кардиоцеребральных событий (МАССЕ) и смертности у пациентов с острым ИМпST в течение 5 лет наблюдения. Эти данные соотносятся с результатами, полученными в нескольких крупных обсервационных исследованиях. В частности, в исследовании Y. Yamashita и соавт. частота смертности за 5 лет была практически в 4 раза выше, чем за 30 дней (20,4% и 5,7% соответственно), и в 2 раза выше, чем за 1 год наблюдения (20,4% и 10,6% соответственно) [6]. При анализе структуры долгосрочной смертности по результатам нашего исследования был определен существенный вклад сердечно-сосудистых причин. Это также подтверждается результатами ряда проведенных ранее исследований [6, 7]. По данным исследования Klancik и соавт., 65% случаев летального исхода после перенесенного ИМпST были обусловлены сердечно-сосудистыми причинами. Больные с ИМпST имели более высокий риск сердечно-сосудистой смертности по сравнению со смертью, связанной с онкологией, другими заболеваниями и травмами [7].
В проведенных ранее исследованиях был определен ряд предикторов летального исхода по результатам отдаленного наблюдения [6, 7]. К ним относятся: возраст, сердечная недостаточность в анамнезе, почечная дисфункция, цирроз печени, сахарный диабет, неуспешное ЧКВ, класс острой сердечной недостаточности (по Killip). По данным нашего исследования, основными предикторами неблагоприятных событий в отдаленном периоде явились: возраст, неуспешное ЧКВ и значение фракции выброса левого желудочка при выписке из стационара.
Возраст как предиктор отдаленной летальности всегда следует оценивать обособленно.Пожилые пациенты чаще имеют многососудистое поражение коронарных артерий, часто с выраженной кальцификацией, что может создавать сложности для полной реваскуляризации миокарда. Эта группа больных более коморбидна, что также может оказывать влияние на отдаленные результаты. По данным современной литературы, возраст как предиктор отдаленного летального исхода встречается практически во всех исследованиях, посвященных проблеме лечения больных с острым ИМпST [9, 10].
Также по результатам нашего исследования одним из предикторов, влияющих на отдаленный прогноз лечения пациентов с ОИМпST, являлась сниженная ФВ ЛЖ при выписке из стационара. В недавно опубликованных исследованиях было также показано, что пациенты с невосстановленной ФВ ЛЖ после перенесенного инфаркта миокарда в отдаленном периоде имеют повышенный риск развития осложнений [11]. Важно подчеркнуть, что в ряде случаев сниженная ФВ ЛЖ после острого ИМпST имеет тенденцию к восстановлению. Восстановление оглушенного миокарда после реперфузии определяет показатель ФВ ЛЖ в раннюю фазу (дни, недели). При этом прирост ФВ ЛЖ в отдаленном периоде связан с ремоделированием левого желудочка, вызванным некрозом, гипертрофией, воспалением, либо развитием фиброза в зоне инфаркта [12]. Следует отметить, что в проведенных ранее исследованиях когорта пациентов, у которых в ходе лечения и реабилитации происходил прирост показателя ФВ ЛЖ, отдельно не анализировалась. Согласно данным нашего исследования, особое внимание заслуживают больные с промежуточными значениями ФВ ЛЖ при выписке (40–49%). Так, у каждого четвертого из этих пациентов за период наблюдения не определялось восстановление насосной функции сердца, а в ряде случаев было выявлено снижение показателя ФВ ЛЖ. Эти больные требуют дальнейшего изучения с целью определения и коррекции факторов риска, ассоциированных с невосстановлением ФВ ЛЖ в динамике.
Еще одним предиктором летальности в отдаленном периоде у пациентов с острым ИМпST являлось неуспешное ЧКВ. В работе Klancik и соавт. неуспешное ЧКВ также было выделено как самостоятельный предиктор сердечно-сосудистой смертности по результатам 5-летнего наблюдения [7]. Ранее нами было показано, что неуспех ЧКВ часто был обусловлен развитием феномена микроваскулярной обструкции («no-reflow») и ассоциировался с худшими госпитальными результатами лечения [13]. Среди других причин неуспешного ЧКВ следует выделить технические трудности при выполнении вмешательств (обычно связаны с проведением баллонов и стентов в зону поражения), наличие крупных остаточных пристеночных тромбов в стентированном сегменте, прогрессирование тяжести состояния с последующим летальным исходом во время проведения реваскуляризации. Роль остаточного тромба в стентированном сегменте изучалась в ряде исследований. Было показано, что наличие пристеночного тромба, несмотря на адекватный кровоток по артерии, связано с субоптимальной перфузией миокарда и неблагоприятным прогнозом [14, 15].
Необходимо отметить, что исследование имеет ряд ограничений. По нашим данным, существенный вклад в структуру основных неблагоприятных кардиоцеребральных событий (MACCE) внесла высокая частота рестеноза в ранее имплантированных стентах (11,2%). Это связано с преимущественным использованием стентов без антипролиферативного покрытия, которые в настоящее время не рекомендованы к применению. Также часть пациентов (12,4%) была потеряна для долгосрочного наблюдения. Кроме того, в проведенном исследовании авторы не анализировали методы медикаментозной терапии и степень соблюдения пациентами рекомендаций по лечению. При этом проблема низкой приверженности к медикаментозной терапии у пациентов после перенесенного инфаркта миокарда является актуальной и может значительно влиять на результаты лечения.
Заключение
Таким образом, через 5 лет наблюдения после выполненных ЧКВ по поводу острого ИМпST у пациентов определялись высокие показатели летальности и развития основных неблагоприятных кардиоцеребральных событий (МАССЕ). Высокая частота возникновения таких осложнений была обусловлена прогрессированием атеросклероза, развитием повторных инфарктов миокарда, инсультов, проведением повторной реваскуляризации коронарного русла вследствие рестеноза. Основными причинами смертельных случаев были повторные сердечно-сосудистые осложнения. Наиболее значимыми факторами, которые способствовали смертности, были возраст старше 65 лет, неуспешное ЧКВ и низкая фракция выброса левого желудочка (<40%) после проведения ЧКВ. Выживаемость в группе пациентов, достигших возраста 65 лет и более, была статистически значимо ниже в сравнении с пациентами моложе этого возраста. У пациентов с сохраненной (>50%) и промежуточной (40–49%) ФВ ЛЖ после ЧКВ показатель кумулятивной выживаемости за 5-летний период наблюдения не различался. При этом кумулятивная выживаемость была статистически значимо ниже в группе пациентов с низкой ФВ ЛЖ в сравнении с больными с сохраненной и промежуточной ФВ ЛЖ. Кумулятивная выживаемость пациентов после успешного ЧКВ была статистически значимо выше, причем уже на госпитальном этапе возникал позитивный эффект успешной реканализации инфаркт-связанной артерии, который прогрессивно увеличивался до конца периода наблюдения.
Соответствие принципам этики: от каждого пациента получено информированное согласие. Исследование одобрено локальным этическим комитетом Тюменского кардиологического научного центра (протокол № 145 от 29.01.2019 г.).



