Колоректальный рак (КРР) остается важнейшей проблемой в структуре общей онкологической заболеваемости. Во всем мире колоректальный рак занимает третье место по частоте заболеваемости среди мужчин и второе среди женщин. Так, по данным Всемирной организации здравоохранения (ВОЗ), за 2020 год среди женщин зарегистрировано 865 630 случаев, среди мужчин этот показатель составил 1 065 960. Ежегодная мировая смертность от колоректального рака приближается к 1 млн человек (за 2020 год 935 173 случаев). Как среди мужчин, так и среди женщин колоректальный рак является третьей по частоте причиной смерти от онкологического заболевания. Наиболее часто это заболевание регистрируется в развитых странах [1].
В России за 2019 год зарегистрировано 275,7 случая колоректального рака (рака ободочной, прямой кишки и ректосигмоидного соединения) на 100 000 населения. Кроме того, в этом же году на поздних стадиях (III–IV) зарегистрировано 46,9% случаев рака прямой кишки от общего числа заболевших [2].
Колоректальный рак относится к полиэтиологичным заболеваниям. К факторам риска развития точечных мутаций и, как следствие, полипов или КРР относят экзогенные, эндогенные факторы, генетическую предрасположенность, гендерные факторы, предопределенный возраст, особенности микробиома кишечника и ряд других. К основным факторам риска, которые влияют на развитие колоректального рака, относят: социально-экономическое положение стран и географическую зону проживания населения, расовую принадлежность, возраст, воспалительные заболевания кишечника, длительный анамнез курения. К факторам, наиболее вероятно способствующим развитию рака толстой кишки, можно отнести гиподинамию, избыточную массу тела и ожирение, потребление алкоголя, рацион с большим количеством красного мяса, дефицитом пищи растительного происхождения и низким содержанием микроэлементов [3].
Хронические воспалительные заболевания (ХВЗ) кишечника также играют немаловажную роль в контексте возникновения КРР. При этом риск развития онкологического процесса возрастает при манифестации в раннем подростковом возрасте и при наличии длительного анамнеза ХВЗ кишечника [4].
Особое внимание в изучении факторов риска возникновения КРР уделяется наследственной предрасположенности. Так, при наличии семейного анамнеза КРР у родственников первой линии вероятность возникновения заболевания повышается в 2–3 раза. Однако у трети пациентов, имеющих семейный анамнез, отсутствуют наследственные синдромы. К наиболее известным синдромам относят: Синдром Линча, семейный аденоматозный полипоз, синдром Пейтца–Егерса, ювенильный полипозный синдром [5]. Но только 5% случаев рака толстой кишки являются наследственными, в 30% случаев возникновение заболевания обусловлено наследственной предрасположенностью, и большинство других возникают спорадически [6].
Особенностью рака толстой кишки является множество вариантов молекулярного патогенеза заболевания. В настоящее время использование молекулярных методов в диагностике злокачественных опухолей является одним из основных направлений в исследованиях в связи с тем, что события, происходящие на уровне генома, следует считать ключевыми в возникновении и развитии злокачественных опухолей. Ключевую роль в развитии заболевания играют мутации в определенных генах. Так, условно в зависимости от возникновения мутации их можно разделить на спорадические, наследственные и семейные. Спорадические мутации составляют до 70% всех случаев колоректального рака, чаще всего причиной являются точечные мутации, которые появляются в течение жизни, не связаны с наследственными синдромами. Наиболее часто первичная мутация происходит в АРС (ген-супрессор), что обусловливает образование полипов с тенденцией к озлокачествлению за счет мутаций в генах KRAS, NRAS, TP53, DCC. Примерно 5% случаев приходится на наследственные мутации, в том числе семейный аденоматозный полипоз, характеризующийся образованием потенциально злокачественных полипов на всем протяжении толстой кишки. Основной причиной неполипозного колоректального рака является синдром Линча, связанный с мутациями в генах репарации ДНК (MSH2, MLH1, MLH6, PMS1 и PMS2). Еще 25% случаев возникновения колоректального рака относят к семейным наследственным мутациям, которые не могут быть включены ни в один вариант наследственного рака [7].
Молекулярная диагностика имеет ключевое практическое значение как в прогностическом плане, так и для определения тактики ведения пациентов. У большей части пациентов с колоректальным раком на момент постановки диагноза отмечаются запущенные стадии заболевания, 20% первично диагностированных имеют метастатический процесс. Ключевую роль в лечении метастатического колоректального рака (мКРР) играет лекарственное направление. Так, препараты на основе моноклональных антител против эпидермального фактора роста (EGFR), который в 80% случаев сверхэкспрессируется на опухолевых клетках, являются главной составляющей лекарственной терапии мКРР. К ним относятся цетуксимаб и панитумумаб (действие которых основано на блокировании внеклеточного домена тирозинкиназы EGFR), они способствуют угнетению пролиферации, а также активации апоптоза клеток опухоли [8]. Важным моментом является применение препаратов анти-EGFR при отсутствии мутаций в генах семейства RAS [9] ввиду того, что мутации в эффекторных сигнальных молекулах способствуют активации рецептор-независимого пути, приводя к резистентности терапии препаратами цетуксимаб (химерное моноклональное антитело IgG1) и панитумумаб (гуманизированное моноклональное антитело IgG2). Однако в исследованиях было показано, что клиническая польза в виде стабилизации заболевания у пациентов, получающих анти-EGFR, составляет 8–10 месяцев [10] в связи с тем, что по мере прогрессирования у большинства больных развивается лекарственная устойчивость [11], причиной которой могут служить как внешние, так и внутренние механизмы.
К внутренним механизмам можно отнести аномальную активацию онкогенных сигнальных путей, геномные изменения каскадов RAS/RAF/MEK/ERK и PI3K/AKT/mTOR. Изменение фенотипа раковых стволовых клеток способствует эпителиально-мезенхимальной трансформации опухолевой ткани и, как следствие, развитию устойчивости к терапии [12]. К внешним механизмам следует отнести изменения микроокружения опухоли. Так, анти-EGFR препараты цетуксимаб и панитумумаб способны подавлять опухолевый рост с помощью антителозависимой клеточно-опосредованной цитотоксичности, а дисфункция NK-клеток и макрофагов способствует снижению влияния препаратов на опухоль. Снижение количества эффекторных Т-клеток, повышенная экспрессия PD-L1, аномальный ангиогенез способствуют формированию устойчивости к таргетной терапии.
Влияние иммунной системы на клиническую эффективность традиционных методов лечения рака толстой кишки неоспоримо и во многом зависит от взаимодействия раковых клеток и микроокружения опухоли [13–16]. Иммунные клетки могут оказывать подавляющее действие на опухолевые клетки, а также контролировать рост опухоли в процессе иммунного надзора. Действия иммунной системы способны приводить как к полному уничтожению опухолевых клеток, так и к ускользанию от влияния иммунной системы и, как следствие, прогрессированию опухолевого процесса. Прогрессирование рака может быть вызвано также хроническим воспалением с иммунным инфильтратом, способным подавлять адаптивные иммунные реакции либо стимулировать пролиферацию опухоли, тем самым повышая выживаемость опухолевых клеток путем улучшения процессов ангиогенеза и метастазирования.
Микроокружение опухоли имеет важное значение для определения влияния иммунных клеток на клинический исход заболевания. Так, например, инфильтрация СD8+ Т-клеток связана с лучшим клиническим ответом [17]. По данным ряда авторов, такие клетки, как Th1, макрофаги M1, NK-клетки, положительно влияют на исход заболевания, в то время как присутствие макрофагов М2, MDSCs (миелоидные супрессорные клетки), Th17, В-клеток связано с худшим прогнозом и низким клиническим эффектом. В результате анализа количества и локализации опухоль-инфильтрирующих лимфоцитов (TILS) установлено влияние иммунного инфильтрата на прогрессирование опухоли. Несмотря на то что накопленные к настоящему времени данные позволяют выделить некоторые особенности иммунной инфильтрации опухолей при КРР, остается слабо изученным вклад отдельных цитокинов и других регуляторных молекул в развитие заболевания и в ответ на проводимое лечение.
W.H. Fridman с соавторами [18] проанализировали взаимосвязь между составом и функциональной нагрузкой опухолевого иммунного инфильтрата, его типом, расположением и плотностью TILs, а также их ориентацией относительно опухоли, что позволило авторам разработать представление о различном иммунном контексте (профиле) опухолей КРР. Благоприятный иммунный контекст (профиль) характеризовался инфильтрацией CD45RO+ Т-клетками памяти, CD8+ цитотоксическими Т-лимфоцитами (CTL), располагающимися преимущественно к центру опухоли и ее инвазивному краю, а также наличием Th1, M1макрофагов, преобладанием ряда цитокинов (CXCL9, CXCL10), сигнальных и цитотоксических эффекторных молекул. При неблагоприятном клиническом прогнозе развития КРР наблюдали формирование иммунного контекста (профиля), характеризующегося наличием внутриопухолевых миелоидных супрессорных клеток (MDSC), М2- макрофагов, В-клеток, связанных с выработкой провоспалительных генов, в том числе миелоидных хемокинов, иммуносупрессивных молекул и факторов комплемента [18]. По мнению авторов, микроокружение опухоли играет важную роль в инициации, инвазии и прогрессировании колоректального рака путем установления связи между раковыми клетками и другими типами клеток, в том числе иммунными [19]. Это клеточное взаимодействие опосредуется многими растворимыми факторами, в том числе цитокинами и хемокинами, сигнальными молекулами (например, факторами роста или компонентами внеклеточного матрикса).
Таким образом, к факторам, которые влияют на изменения в опухоли в ответ на проводимое лечение, относятся различное сочетание провоспалительных и противовоспалительных цитокинов, их баланс, стадия опухолевого процесса, уровень экспрессии рецепторов цитокинов, состояние активации стромальных клеток. Использование цитокинов в качестве мишени для терапии КРР остается актуальной темой для исследований, но требует более глубокого анализа широкого спектра взаимодействия цитокинов и опухолевых клеток колоректальной карциномы, что является необходимым условием для разработки точных и эффективных терапевтических методов.
Цель исследования: систематизация современных представлений об особенностях участия цитокинов, хемокинов и ряда других биологически активных молекул в развитии опухолей КРР.
Материалы и методы исследования
Для оценки информации о роли отдельных цитокинов и возможности их использования для выделения отдельных групп пациентов с разными иммунологическими характеристиками или различной вероятностью ответа на лечение нами был проведен систематический обзор публикаций в системах PubMed, Scopus (на английском языке) и eLIBRARY (на русском языке). Были найдены публикации, соответствующие критериям поиска, за период с 1995 по 2022 гг.
Критерием включения публикаций в обзор был анализ взаимодействия между колоректальной карциномой и иммунными клетками. Поиск осуществлялся по ключевым словам («колоректальная карцинома», «колоректальный рак», «цитокины», «хемокины») или отдельным группам исследуемых веществ (GM-CSF, IFN-γ, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-13, IL-15, IL-17A, IL-18, IP-10, MCP-1, MIG, MIP-1α, MIP-1β, RANTES, TNF-α).
Результаты исследования и их обсуждение
К настоящему времени накоплен определенный объем сведений, отражающих некоторые особенности влияния ряда цитокинов на течение колоректального рака.
GM-CSF – гранулоцитарный макрофагальный колониестимулирующий фактор определенно оказывает иммунонезависимое влияние на прогрессирование опухоли путем поддержания ее микроокружения, тем самым стимулируя рост образования и его метастазирование [20]. Экспрессия GM-CSF в большей степени повышена в первичных опухолях толстой кишки по сравнению со здоровой популяцией и продуцируется неопластическими эпителиальными клетками толстой кишки. Микроокружение опухоли: фибробласты, моноциты, антигенпрезентирующие клетки – также имеют на своей поверхности рецепторы к GM-CSF, что обусловливает их накопление в опухолевой ткани. Показано, что гиперэкспрессия GM-CSF, индуцируя высвобождение VEGF эпителиальными клетками толстой кишки, инициирует тем самым ангиогенез через ERK-сигнальный путь, что способствовало более быстрому образованию рака, ассоциированного с колитом [21]. Отличительной особенностью GM-CSF является способность воздействовать на дендритные клетки, результатом чего может выступать стимуляция противоопухолевого ответа, а при воздействии на макрофаги – ингибирование пролиферации клеток [22].
IFN-γ – в толстой кишке наиболее часто экспрессируется лимфоцитами, активированными дендритными клетками. Рецептор IFN-γ регистрируется практически на всех ядросодержащих клетках. IFN-γ усиливает презентацию промоутеров CD8+, Т-, NK-клеток антигенам класса I ГКГС и способствует развитию опосредованной макрофагами цитотоксичности, как следствие, стимулирует противоопухолевый иммунный ответ [23]. Показана связь между высоким уровнем IFN-γ в сыворотке крови и отсутствием метастазов в лимфатических узлах и отдаленных метастазов колоректального рака [24]. Действие IFN-γ на клетки КРР с индукцией фосфорилирования STAT1 и ингибированием сигнальных путей EGFR приводит к сдерживанию пролиферации клеток.
IL-2 – является важным цитокином, участвующим в индукции Т-клеточно-опосредованного иммунного ответа путем запуска развития и пролиферации Т-лимфоцитов, активации NK-клеток и В-лимфоцитов, а также участвует в развитии регуляторных T-клеток, продуцируется в основном CD4+ Th1 и CD8+ лимфоцитами. До настоящего времени взаимосвязь между IL-2 продуцируемыми Т-клетками и особенностями опухолевых клеток при КРР и его микроокружением до конца не известна.
IL-4 – способствует усилению пролиферации Т- и В-лимфоцитов, участвует в регуляции секреции иммуноглобулинов. Известно, что IL-4 сверхэкспрессируется при предраковых состояниях толстой кишки (гиперпластические, аденоматозные полипы и др.), а при возникновении аденокарциномы уровень IL-4 остается нормальным и способен увеличиваться при появлении метастатических очагов колоректального рака. При аномальной активации STAT6 в совокупности с IL-4 способствует активации метастатических процессов в опухоли и, как следствие, коррелирует с плохой выживаемостью пациентов с раком толстой кишки [25].
IL-6 – сверхэкспрессия интерлейкина 6 в тканях КРР, а также повышение уровня сывороточного IL-6 коррелируют с большим размером опухоли, появлением метастазов и худшим прогнозом течения заболевания. Способствовать этому может накопление MDSC в опухолевой ткани; взаимодействие IL-6 с его рецептором приводит к активации STAT3, что, в свою очередь, обусловливает стимуляцию пролиферации раковых клеток и ускорение прогрессирования опухоли [26].
IL-7 – относится к цитокинам, стимулирующим гемопоэз, участвует в пролиферации и дифференцировке пре-В и пре-Т лимфоцитов. IL-7, в отличие от других цитокинов, является тканевым интерлейкином. M. Krzystek-Korpacka et al. первыми пришли к заключению, что системное повышение концентрации IL-7 связано с метастатическим колоректальным раком, а также с локализацией опухолевого процесса, что может иметь важное значение для практики [27].
IL-8 – этот цитокин в основном действует на миелоидные клетки, усиливая их мобилизацию, способствуя тем самым прогрессированию опухоли за счет их иммуносупрессивного действия [28]. Пациенты с КРР характеризовались значительным увеличением концентрации IL-8 в опухолевой ткани по сравнению со здоровой тканью, что, по мнению исследователей, отражает участие данной молекулы в ангиогенезе опухоли и приводит к повышенному риску рецидива и плохому прогнозу дальнейшего течения заболевания. IL-8 через свой рецептор активирует AKT и MAPK сигнальные пути, способствуя экспрессии генов, ответственных за пролиферацию, инвазию и ангиогенез, результатом чего являются рост опухоли, раннее метастазирование и химиорезистентность [29].
Известно, что повышение уровня IL-10 в крови на дооперационном уровне коррелирует с более плохим прогнозом [30]. Связывание IL-10 с рецептором активирует несколько сигнальных путей, таких как STAT1, STAT3, STAT5, однако до конца не ясно, какой из этих путей активируется при колоректальном раке, что требует дальнейшего исследования [31].
IL-13 – цитокин, имеет сходные регуляторные элементы с IL-4. Показано, что повышение концентрации данных цитокинов тесно связано с онкогенезом и метастазированием [32]. Так, сверхэкспрессия IL-4 и IL-13 в опухолевом микроокружении может способствовать прогрессированию опухоли через механизмы стимуляции трансформации макрофагов к М2 активированному фенотипу.
IL-15 – представитель семейства IL-2 с выраженным воздействием на процессы активации, пролиферации и выживания клеток. Этот цитокин продуцируется стромальными, эпителиальными, миелоидными клетками (моноцитами, макрофагами, дендритными клетками), при этом противоопухолевая активность IL-15 обусловлена воздействием на цитотоксические Т- и NK-клетки. Bernhard Mlecnik с соавторами в своей работе доказал, что пациенты с КРР в комбинации с делецией IL15, которая приводит к снижению экспрессии цитокина, имеют значительно более высокий риск рецидива опухоли и худшую общую выживаемость [33]. Главным образом действие IL-15 основано на реализации противоопухолевой цитотоксичности и модуляции воспалительного микроокружения опухоли. Как и для других цитокинов, для IL-15 характерна двойственная роль в процессах взаимодействия опухоли и иммунной системы: при определенных, не вполне изученных условиях он обусловливает выраженную противоопухолевую активность цитотоксических лимфоцитов, однако при других условиях наблюдается и проопухолевая активность данного цитокина [34].
IL-17A – иммунные клетки CD4+ являются основным источником цитокина при колоректальном раке и в окружающих тканях. По данным ряда авторов, уровень IL-17A в сыворотке крови был повышен у пациентов с КРР, коррелировал с размером опухоли и циркулирующими опухолевыми клетками, а также предсказывал плохую выживаемость [35].
IL-18 – является противоопухолевым цитокином. При наличии полиморфизма А607С в гетерозиготном состоянии обусловливает повышенный риск развития КРР [36]. Некоторые мутации белков рецептора IL-18 связаны с болезнью Крона и воспалительными заболеваниями кишечника. Этот цитокин также способствует активации иммунитета, опосредованного цитотоксическими клетками, в том числе CD8+ Т-лимфоцитами и NK-клетками. Однако показано, что в результате взаимодействия цитокина с рецептором на опухолевых клетках происходит активация сигнальных путей, влияющих на их пролиферацию и дифференцировку [37].
Помимо роли отмеченных цитокинов в определении биологических свойств опухолей, их способности к метастазированию и ответе на проводимое лечение, особая роль отводится такой группе молекул, как хемокины. С функциональной точки зрения эти молекулы регулируют такие процессы, как: хемотаксис активированных иммунокомпетентных клеток, адгезия клеток к эндотелию сосудов и друг с другом, миграция опухолевых клеток и ряд других.
IP-10 – интерферон-гамма-индуцированный белок 10, также известный как хемокиновый лиганд 10 с мотивом CXC (CXCL10), обладающий различной биологической активностью в виде регуляции адгезии лимфоцитов к эндотелию, процессов хемотаксиса, ингибирования колониеобразования клетками, а также противоопухолевой активностью. Синтезируется несколькими типами клеток (моноцитами, эндотелиальными клетками и др.) в ответ на действие IFN-γ. Было показано, что CXCL10 может быть рассмотрен как независимый прогностический фактор рецидива рака. Повышенная концентрация IP-10 в сыворотке крови в совокупности с наличием отдаленных метастазов рассматривается как крайне неблагоприятный прогноз [38].
MCP-1 – является мощным хемокином и часто продуцируется опухолевыми клетками, которые считаются основным источником данной молекулы. Основная роль хемокина заключается в привлечении из крови моноцитов в область воспалительной реакции, в том числе в опухоль. Выявлено, что MCP-1 регулирует порочный круг связи между опухолевыми клетками и макрофагами, тем самым способствуя прогрессированию опухоли [39]. Туморассоциированные макрофаги (ТАМ) являются одним из основных элементов стромы опухоли. Синтезируются в основном из моноцитов крови в ответ на хемоаттрактанты, в том числе MCP-1. Тем самым хемокин влияет на количество и распределение ТАМ, косвенно воздействуя на провоспалительные и противоопухолевые процессы [40].
MIG – является лигандом хемокина CXCR3, участвует в реализации иммуновоспалительных реакций при активации IFN-γ. Важность изучения CXCR3 с его лигандами, экспрессируемыми на Т-регуляторных клетках и макрофагах при колоректальной карциноме, обусловлена доказанной стимуляцией метастатических процессов и более худшим прогнозом по сравнению с пациентами, у которых экспрессия CXCR3 не была выявлена [41].
MIP-1α – CCL3, хемокин, продуцируется в основном макрофагами, дендритными клетками, лимфоцитами, которые активируют ССR5 (хемокиновый рецептор). Основной эффект данного хемокина – провоспалительный, заключается в активации хемотаксиса и трансэндотелиальной миграции клеток. Кроме того, в ответ на CCL3 в фибробластах и макрофагах индуцируются синтез и высвобождение других провоспалительных цитокинов, таких как IL-1, IL-6 и TNF-α. Эти хемокины влияют на моноциты, Т-лимфоциты, дендритные клетки, NK-клетки и тромбоциты [42]. Они также активируют гранулоциты человека, что может привести к острому нейтрофильному воспалению.
RANTES – регулирует активацию, экспрессию и секрецию нормальных Т-клеток, относится к провоспалительным хемокинам. Взаимодействие хемокина с соответствующим рецептором способствует запуску каскадных путей (PI3K/AKT, NF-kB, ERK/MEK), что может приводить к неконтролируемой пролиферации и созданию благоприятных условий микроокружения для выживания опухолевой клетки. P.K. Baier с соавторами [43] показали, что высокие уровни хемокинов, в том числе RANTES (CXCL5), вносят больший вклад в рост опухоли и иммуносупрессию, чем в эффективный противоопухолевый иммунитет. Таким образом, возникает вопрос о необходимости проведения исследований, направленных на нейтрализацию хемокинов при колоректальном раке.
TNF-α – фактор некроза опухоли, является ключевым медиатором воспаления [44]. Исследования TNF-α показали взаимосвязь повышения концентрации в сыворотке крови со стадией колоректальной карциномы, что может быть использовано на диагностическом этапе для формирования групп риска пациентов с более плохим прогнозом течения заболевания. Также выявлена взаимосвязь положительного коррелирования прогрессирования колоректальной карциномы с увеличением концентрации фактора некроза опухоли в сыворотке крови [45].
Помимо влияния на возникновение и течение колоректального рака, иммунное микроокружение влияет на эффективность проводимого лечения, выбор которого, в свою очередь, зависит от статуса гена RAS [46].
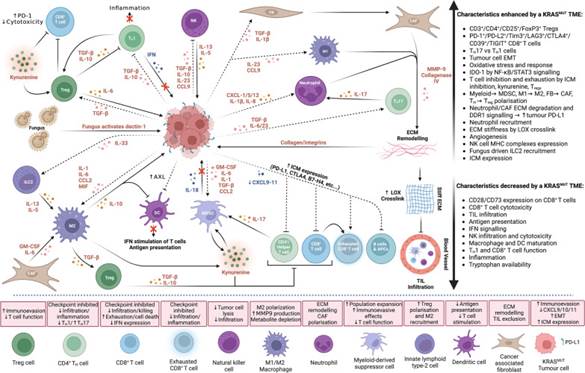
Опухолево-иммунные и иммуно-опухолевые взаимодействия в микроокружении опухоли с мутацией в гене KRAS [46]
Мутации в гене KRAS при колоректальном раке встречаются в 30–60% случаев [47]. Ускользание от иммунной системы происходит несколькими механизмами, в первую очередь это возможно за счет изменения опухолевого микроокружения путем увеличения MDSC и Treg клеток, ремоделирования стромы и индукции TGF-β, а также ассоциированных с опухолью фибробластов и дифференцировки цитокинов (VEGF, IL-6, IL-8). Интегральные современные представления относительно взаимного влияния иммунокомпетентных клеток и КРР представлены на рисунке.
Мутантный ген KRAS способен изменять опухолевое микроокружение, тем самым влияя на распределение иммунных клеток. Так, например, передача сигнала по пути KRAS, ингибирование TTP связаны с изменениями ряда цитокинов и хемокинов (IL-8, GM-CSF, CXCL5, IL-10, VEGF, PEG-2), в результате чего запускаются каскадные изменения в микроокружении в виде повышения уровня миелоидных клеток-супрессоров (MDSC) и Treg, происходят трансформация ассоциированных с раком фибробластов (CAF), повышение экспрессии эндотелиального Fas-лиганда, способного ингибировать выход CD8+ Т-клеток из кровотока. Также мутация в гене KRAS посредством угнетения функции MYC способствует увеличению передачи сигналов интерферона, что, в свою очередь, снижает продукцию иммуносупрессивных цитокинов в опухоли, а также приводит к усилению инфильтрации и активации CD8+ Т-лимфоцитов и увеличению презентации главного комплекса гистосовместимости (ГКГ) [48].
Действуя совместно, KRAS и MYC стимулируют онкогенез, а также активно изменяют опухолевое микроокружение несколькими путями. Так, например, повышенная экспрессия IL-1 и IL-6 приводит к усилению регуляции перепрограммирования иммунных клеток (IDO-1) в инфильтрирующие опухоль лимфоциты (TILs) посредством передачи сигнала по пути STAT3 [49].
Онкогенная передача сигналов KRAS способна приводить к повышенной экспрессии IL-8, IL-10, GM-CSF, CXCL1, CXCL12, CCL2 и MIF, а также к снижению уровня IL-18 с последующим изменением опухолевого микроокружения, делая его резистентным к иммунотерапии. Секреция этих иммунных факторов влияет на привлечение нейтрофилов, уменьшение воспаления с помощью Th1, ингибирование макрофагов, трансформацию М2-подобных макрофагов в опухоль-ассоциированные макрофаги (ТАМ), инфильтрацию MDSC и запуск экспрессии хемотаксического фактора [48]. Экспрессия связанных с KRAS цитокинов может вызывать изменения в механизмах врожденной иммунной системы и, как следствие, препятствует активации адаптивной иммунной системы, ухудшая ответ на проводимое лечение.
Заключение
Для полноты понимания иммунных процессов, происходящих при опухолевых заболеваниях, в частности при развитии КРР, наиболее перспективным является комплексный подход в оценке концентрации различных биологически активных соединений, вовлеченных в рассматриваемые процессы. С этой точки зрения особое внимание привлекает технология мультиплексного анализа, позволяющая в небольшом объеме биологического материала определить широкий спектр целевых молекул, отражающих состояние некоторых звеньев иммунной системы в организме онкологического больного, в том числе на фоне проведения лекарственной терапии.
В литературе встречаются разрозненные данные о влиянии тех или иных цитокинов и хемокинов на возникновение, течение, исход колоректального рака. Известно, что развитие и прогрессирование колоректального рака связаны с изменением цитокинов в сыворотке крови, но уровень значений этих иммунных факторов четко не определен.
В связи с этим назрела необходимость комплексного, системного подхода к анализу цитокинов у пациентов с колоректальным раком для выявления корреляционных связей с прогнозом течения заболевания, в том числе на фоне проводимого лекарственного лечения, включающего применение препаратов на основе моноклональных антител.



