Приоритетным направлением современной медицины является решение социально значимой проблемы здравоохранения – борьбы с заболеваемостью туберкулезом, поскольку во многих странах мира, в том числе и в России, туберкулез приводит к инвалидности и смертности трудоспособного населения. Положительная динамика улучшения эпидемиологической ситуации по туберкулезу в России в последние годы связана с усилением проведения профилактических и лечебных мероприятий [1, 2]. К основным противотуберкулезным препаратам для лечения туберкулеза (в условиях сохраненной лекарственной чувствительности возбудителя) относятся изониазид и рифампицин [3, с. 347]. Причиной недостаточно высокой эффективности противотуберкулезной терапии является побочное действие используемых лекарственных препаратов, что проявляется в нежелательных побочных реакциях [4, 5]. В первую очередь это связано с высокой гепатотоксичностью назначаемых противотуберкулезных препаратов. У 20–30% больных туберкулезом прием лекарственных препаратов этой группы вызывает патологические состояния печени [6, с. 42]. Так, применение изониазида приводит к нежелательным побочным проявлениям в виде аллергических, диспепсических, нейротоксических и гепатотоксических реакций. Биотрансформация ксенобиотика изониазида приводит к токсическому поражению печени, которое сопровождается нарушением белкового, углеводного, липидного, пигментного обменов в печени, изменением активности печеночных ферментов; гепатозу [7]. Гепатотоксичные реакции на прием изониазида связаны как с генетическими факторами, так и с сопутствующими патологиями печени.
В настоящее время с целью устранения побочных реакций и снижения гепатоксичности противотуберкулезных препаратов назначают лекарственные препараты из группы гепатопротекторов, такие как Гептрал, Гепатосан, Карсил и др. Широкий спектр терапевтической активности пектинов позволяет использовать их в качестве возможных гепатопротекторов. Это обусловлено физико-химическими свойствами пектинов и их способностью участвовать в реакциях этерификации, ацетилирования, комплексообразования, позволяя при этом не оказывать влияния на фармакологическую активность препарата [8].
Цель исследования: установление характера и выраженности токсических свойств таблеток изониазида, гранул СВ-изониазида и гранул изониазида с пектином по биохимических показателям функционального состояния печени.
Методы и материалы исследования
Опыты проводились на беспородных белых крысах-самцах массой 180–200 г в первую половину дня после 16-часового голодания. Животные содержались в стационарных условиях вивария, получая стандартный корм и воду без ограничения. Перед опытом животные подвергались двухнедельному карантину, в течение которого проводили осмотр их внешнего вида, поведения, потребления воды и пищи, периодически контролировали массу тела. Эксперимент выполнялся с учетом «Национального стандарта РФ ГОСТ Р 53434-2009 «Принципы надлежащей лабораторной практики» и приказа Минздрава России от 01.04.2016 г. № 199н «Об утверждении правил надлежащей лабораторной практики». Для исследования изготавливались гранулы субстанции изониазида с β-декстрином в соотношении 1:9 и гранулы изониазида с пектином в соотношении 1:6. В качестве препарата сравнения использовали таблетки изониазида 300 мг, АО «Фармсинтез», Россия, серия 20218.
Биохимические показатели определялись в сыворотке крови и ткани печени крыс после декапитации животных. Эвтаназия осуществлялась под хлоралгидратным наркозом (350 мг/кг), без причинения страданий, в помещении, где не содержатся другие животные, согласно правилам «Руководства по проведению доклинических исследований лекарственных средств» [9, с. 11].
Изучение детоксицирующей функции печени при введении таблеток изониазида и гранул изониазида проводилось с помощью бромсульфалеиновой пробы по методу Голла в модификации Г.В.Недошивиной [10, с.48]. Ампулированный 5%-ный раствор бромсульфалеина вводили в хвостовую вену крыс из расчета 10мг/кг массы тела после двухнедельного перорального введения металлическим зондом водных суспензий таблеток изониазида, гранул СВ-изониазида и гранул изониазида с пектином в дозах 50мг/кг и 200мг/кг (в перерасчете на чистый изониазид). Для определения экспериментальных доз изониазида использовали среднесуточную максимальную дозу препаратов на основе изониазида (300 мг/кг массы тела) с учетом коэффициента пересчета 6,5 (для крыс), а также LD50 изониазида, полученную авторами при изучении острой токсичности по методу Кербера (200мк/кг массы тела) [9, с.11–17]. Через 15 минут после введения бромсульфалеина крыс декапитировали и в сыворотке крови определяли его содержание спектрофотометрическим методом при длине волны 532нм против стандарта. В качестве контроля использовали группу интактных животных, в качестве группы сравнения – группу животных, получавших таблетки изониазида, 200 мг/кг массы тела. Также в сыворотке крови определяли активность аланинаминотрансферазы (АлАт), щелочной фосфатазы (ЩФ), концентрацию общего холестерина. В гомогенате печени исследовали содержание гликогена и общих липидов [10, с.395–424].
Обработку результатов проводили методом вариационной статистики: нормальность распределения определяли с помощью критерия Колмогорова–Смирнова, вычисляли среднее значение (М) и стандартную ошибку среднего значения (m), в качестве параметрического метода использовали критерий Стьюдента, в качестве непараметрического – U-критерий Манна–Уитни [9, с.17–27]. Различие между группами считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Результаты бромсульфалеиновой пробы у животных, получавших изониазид и его лекарственные формы, представлены в таблице 1.
Таблица 1
Изучение детоксицирующей функция печени при введении изониазида и его гранул с пектином и β-декстрином (СВ-изониазида)
|
Условие опыта |
Количество животных |
Содержание бромсульфалеина в сыворотке крови, мг% |
|
|
М |
p |
||
|
1 |
2 |
3 |
4 |
|
Интактные животные (контроль) |
10 |
0,15 |
– |
|
Животные, получавшие таблетки изониазида, 50мг/кг |
10 |
0,16 |
p1>0,05 |
|
Животные, получавшие таблетки изониазида, 200мг/кг (группа сравнения) |
10 |
1,12 |
p1<0,001 |
|
Животные, получавшие гранулы изониазида с пектином, 50мг/кг |
10 |
0,15 |
p1>0,05 |
|
Животные, получавшие гранулы изониазида с пектином, 200мг/кг |
10 |
0,53 |
p1<0,001 p2<0,001 |
|
Животные, получавшие гранулы СВ-изониазида, 50мг/кг |
10 |
0,16 |
p1>0,05 |
|
Животные, получавшие гранулы СВ-изониазида, 200мг/кг |
10 |
0,51 |
p1<0,001 р2<0,001 |
|
n – количество животных в группе; р1 – уровень статистической значимости по отношению к интактным животным; р2 – уровень статистической значимости по отношению к группе сравнения. |
|||
Как видно из приведенных данных, введение животным препаратов изониазида в дозе 50мг/кг не отразилось на экскреторной функции печени. В отличие от этого введение препаратов изониазида в дозе 200мг/кг значительно задерживало, по сравнению с контролем, содержание красителя в крови, что указывает на повреждение печени. Однако степень этой задержки оказалась более чем в два раза меньше (p<0,001) у животных, получавших гранулы изониазида с пектином и СВ-изониазида. Это позволяет заключить, что применение изониазида в форме гранул с пектином и гранул СВ-изониазида значительно снижает его гепатотоксическое действие, причем в равной степени, по сравнению с опытами, где использовались таблетки изониазида. Основные биохимические показатели цитолиза и холестаза при токсическом воздействии таблеток изониазида в сравнении с гранулами с пектином и гранул СВ-изониазида приведены в таблицах 2, 3, 4.
Таблица 2
Изучение активности аланинаминотрансферазы в крови при введении изониазида и его гранул с пектином и СВ-изониазида
|
Условия опыта |
Количество животных |
Аланинаминотрансфераза, мккатал/л |
|
|
М |
р |
||
|
Интактные животные (контроль) |
10 |
0,34 |
– |
|
Животные, получавшие таблетки изониазида, 50мг/кг |
10 |
0,33 |
р1 >0,05 |
|
Животные, получавшие таблетки изониазида, 200мг/кг (группа сравнения) |
10 |
0,45 |
р1 <0,001 |
|
Животные, получавшие гранулы изониазида с пектином, 50мг/кг |
10 |
0,33 |
р1 >0,05 |
|
Животные, получавшие гранулы изониазида с пектином, 200мг/кг |
10 |
0,40 |
р1 >0,05 р2>0,05 |
|
Животные, получавшие гранулы |
10 |
0,29 |
р1<0,05 |
|
Животные, получавшие гранулы |
10 |
0,38 |
р1>0,05 р2<0,05 |
|
n – количество животных в группе; р1 – уровень статистической значимости по отношению к интактным животным; р2 – уровень статистической значимости по отношению к группе сравнения. |
|||
Из приведенных в таблице 2 данных видно, что гранулы изониазида с пектином и СВ-изониазида, в отличие от таблеток изониазида, не вызывают цитолиз (не повреждают целостность клеток печени).
Таблица 3
Изучение активности щелочной фосфатазы крови при введении изониазида и его гранул с пектином и СВ-изониазида
|
Условия опыта |
Количество животных |
Активность щелочной фосфатазы, ммоль/л |
|
|
М |
p |
||
|
Интактные животные (контроль) |
10 |
2,13 |
– |
|
Животные, получавшие таблетки изониазида, 50мг/кг |
10 |
1,7 |
р1>0,05 |
|
Животные, получавшие таблетки изониазида, 200мг/кг (группа сравнения) |
10 |
9,32 |
р1<0,001 |
|
Животные, получавшие гранулы изониазида с пектином, 50мг/кг |
10 |
2,79 |
р1<0,05 |
|
Животные, получавшие гранулы изониазида с пектином, 200мг/кг |
10 |
10,39 |
р1<0,001 р2>0,05 |
|
Животные, получавшие гранулы |
10 |
4,38 |
р1<0,01 |
|
Животные, получавшие гранулы |
10 |
10,4 |
P1<0,001 P2>0,05 |
|
n – количество животных в группе; р1 – уровень статистической значимости по отношению к интактным животным; р2 – уровень статистической значимости по отношению к группе сравнения. |
|||
Как видно из данных, приведенных в таблице 3, активность щелочной фосфатазы в сыворотке крови крыс при введении исследуемых лекарственных форм изониазида в дозе 50мг/кг существенно не изменилась, что свидетельствует об отсутствии нарушения циркуляции желчи. Однако введение этих препаратов в высокой дозе (200мг/кг) вызвало значительное увеличение активности щелочной фосфатазы, причем примерно в равной мере в опытах как с таблетками изониазида, так и с гранулами изониазида с пектином и СВ-изониазида. Различия между показателями этих опытов оказались статистически не значимыми. Следовательно, исследование активности щелочной фосфатазы крови животных, подвергавшихся воздействию изониазида в высокой дозе (200мг/кг), не выявило в отношении холестаза защитного эффекта лекарственных форм препарата – гранул с пектином и гранул СВ-изониазида.
Наряду с активностью ферментов в качестве показателя функционального состояния печени определялся уровень холестерина в сыворотке крови (табл. 4).
Таблица 4
Изменение содержания общего холестерина в крови при введении лекарственных форм изониазида
|
Условия опыта |
Количество животных |
Холестерин, ммоль/л |
|
|
М |
р |
||
|
1 |
2 |
3 |
4 |
|
Интактные животные (контроль) |
10 |
2,35 |
– |
|
Животные, получавшие таблетки изониазида в дозе 50мг/кг |
10 |
2,42 |
р1>0,05 |
|
Животные, получавшие таблетки изониазида в дозе 200мг/кг (группа сравнения) |
10 |
6,16 |
р1<0,001 |
|
Животные, получавшие гранулы изониазида с пектином в дозе 50мг/кг |
10 |
2,12 |
р1>0,05 |
|
Животные получавшие гранулы изониазида с пектином в дозе 200мг/кг |
10 |
3,78 |
р1<0,001 р2<0,001 |
|
Животные, получавшие гранулы |
10 |
2,28 |
р1>0,05 |
|
Животные, получавшие гранулы |
10 |
3,79 |
р1<0,001 р2<0,001 |
|
n – количество животных в группе; р1 – уровень статистической значимости по отношению к интактным животным; р2 – уровень статистической значимости по отношению к группе сравнения. |
|||
Изониазид в форме гранул с пектином и гранул СВ-изониазида в меньшей степени нарушают метаболизм холестерина в печени, чем таблетки изониазида. В таблице 5 представлены результаты влияния таблеток изониазида, гранул изониазида с пектином и гранул СВ-изониазида на содержание гликогена и общих липидов в ткани печени (табл.5).
Таблица 5
Изменение содержания гликогена и общих липидов в ткани печени при введении таблеток изониазида, гранул изониазида с пектином и гранул СВ-изониазида
|
Условия опыта |
Количество животных |
Содержание гликогена, мг% |
Содержание общих липидов, мг% |
|
М |
М |
||
|
Интактные животные (контроль) |
10 |
2081,0 |
1,64 |
|
Животные, получавшие таблетки изониазида, 200мг/кг (группа сравнения) |
10 |
787,8 р1<0,001 |
137,7 р1<0,001 |
|
Животные, получавшие гранулы изониазида с пектином, 200мг/кг |
10 |
1767,6 р1>0,05 p2<0,001 |
12,3 р1<0,001 р2<0,001 |
|
Животные, получавшие гранулы СВ-изониазида, 200мг/кг |
10 |
927,0 р1<0,05 р2>0,05 |
35,0 р1<0,001 р2<0,001 |
|
n – количество животных в группе; р1 – уровень статистической значимости по отношению к интактным животным; р2 – уровень статистической значимости по отношению к группе сравнения |
|||
Как видно из представленных в таблице 5 данных, введение таблеток изониазида экспериментальным животным вызвало значительное падение в ткани печени гликогена (на 62,2%, р1<0,001) по сравнению с интактной группой. В группах животных, получавших гранулы изониазида с пектином, уменьшение содержания гликогена оказалось незначительным и статистически недостоверным (на 15%, р1>0,05) по сравнению с интактной группой и на 56% (p2<0,001) выше по сравнению с группой сравнения. В группах животных, получавших гранулы СВ-изониазида, уменьшение содержания гликогена по сравнению с группой сравнения было недостоверным (р2>0,05).
Содержание общих липидов в гомогенате печени животных, получавших таблетки изониазида в дозе 200мг/кг, увеличивалось в 80 раз; в группе, получавшей гранулы изониазида с пектином в дозе 200мг/кг, – в 7,5 раза; в группе, получавшей гранулы СВ-изониазида в дозе 200 мг/кг, – в 21 раз.
Применение гранул изониазида, особенно с пектином, в меньшей степени, чем таблеток, воздействует на содержание гликогена в гепатоцитах, что указывает на сохранение гликогенсинтезирующей функции печени. В группе, получавшей изониазид в таблетках, зафиксировано резкое увеличение содержания общих липидов в печени, что указывает на развитие жировой дистрофии. В группах животных, принимавших гранулы изониазида, особенно с пектином, отмечалось многократное снижение накопления липидов в гепатоцитах, что указывает на снижение гепатотоксичности изониазида в исследуемых композициях.
Выводы
1. Гранулы изониазида с пектином и гранулы СВ-изониазида более чем в два раза снижают нарушение детоксицирующей функции печени, чем таблетки изониазида.
2. Гранулы СВ-изониазида, особенно с пектином, вызывают меньшую жировую дистрофию печени, чем таблетки изониазида.




 m
m m
m m
m 0,29
0,29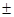 0,85
0,85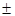 m
m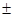 m, р
m, р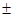 222,0
222,0