Фиброз печени – генетически запрограммированный процесс, возникающий в ответ на воздействие повреждающего агента, проявляющийся в виде избыточного накопления компонентов экстрацеллюлярного матрикса в результате активации звездчатых клеток печени. Одним из ведущих этиологических факторов развития фиброза печени является ХГС. В детском возрасте особенностью течения ХГС является медленный темп прогрессирования фибротических процессов в ткани печени [1]. При этом от 1 до 4% детей с ХГС все же имеют риск развития цирроза печени. Фиброз может возникнуть у 15% детей [1, 2]. Из-за медленного темпа прогрессирования фиброза у детей мало установленных достоверных факторов риска прогрессирования заболевания [3]. Ряд авторов связывают развитие продвинутых стадий фиброза печени у детей, инфицированных ХГС, с наличием у них сопутствующей патологии (гематологических заболеваний, ожирения, онкопатологии, коинфекции с ВИЧ, вирусного гепатита В) [4, 5].При коинфекции ВИЧ и ХГС имеет место феном агрессивного фиброгенеза ткани печени.
Большое значение в формировании фиброза печени придается способности цитокинов изменять функциональную активность фибробластов. Ряд цитокинов стимулируют продукцию компонентов экстрацеллюлярного матрикса, за исключением интерлейкина-10 (ИЛ-10) [6]. Активированные под влиянием цитокинов (ИЛ-1, ИЛ-4, ИЛ-6, ФНО-α) звездчатые клетки трансформируются в миофибробласты и начинают вырабатывать основные компоненты межклеточного матрикса, что приводит к формированию фиброза печени. Концентрация уровня ряда цитокинов может служить маркером печеночного фиброгенеза.
Поиск неизвазивных маркеров фиброза печени представляет несомненный научный интерес, так как применение биопсии как золотого стандарта диагностики фиброза и цирроза печеночной ткани часто сопряжено с возникновением серьезных осложнений.
Цель исследования – выявить особенности показателей фиброза печени и цитокинового профиля у детей с коинфекцией ВИЧ и хронического вирусного гепатита С (ХГС).
Материал и методы исследования. Исследование проведено на базе ГБУЗ «Самарский областной центр профилактики и борьбы со СПИД». За период с 2014 по 2022 годы были обследованы 57 детей. Все пациенты были распределены на две группы. I группа ― дети с коинфекцией ВИЧ и ХГС (n=28), II группа ― пациенты с моноинфекцией ХГС (n=29). Средний возраст детей I группы составил 15,5 [12,0; 17,5] года, II группы – 15,0 [13,0; 16,0] лет (р=0,091). При распределении по полу в I группе незначительно преобладали девочки – 53,6%; мальчиков соответственно 46,4% (р>0,5), тогда как во II группе отмечалось преобладание лиц мужского пола – 69%; 31% женского пола соответственно. Средний возраст на момент постановки диагноза «ВИЧ-инфекция» составил 23,8 [18,3;25,8] месяца. У 19% детей ВИЧ-инфекция выявлена до 18 месяцев жизни, методами ПЦР ДНК ВИЧ, ПЦР РНК ВИЧ, у 81% пациентов – старше 18 месяцев, методом иммунного блоттинга. Исследование иммунного статуса (CD3, СD4, CD8, СD4/CD8) осуществляли методом проточной цитометрии. Методом иммуноферментного анализа произведена оценка цитокинового профиля пациентов, определены уровни интерлейкина-6 (ИЛ-6), интерлейкина-4 (ИЛ-4), интерлейкина-10 (ИЛ-10), фактора некроза опухоли-альфа (ФНО-альфа). Осуществлен подсчет индексов фиброза APRI и FIB-4. Всем пациентам определен уровень эластичности печени методом транзиентной эластографии на аппарате «Fibroscan 502». Стадия фиброза печени оценивалась по шкале METAVIR.
Статистический анализ проводился с использованием пакета прикладных программ IBM SPSS Statistics 26 версия (USA). Данные представлены в виде средних арифметических величин (M) и стандартных отклонений (SD) при нормальном распределении, при распределении, отличном от нормального, – медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Статистически значимым различие между оцениваемыми группами считалось при p<0,05. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента, при отсутствии равенства дисперсий применялся критерий Уэлча. Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального) и коэффициента Пирсона (при нормальном распределении).
Результаты исследования и их обсуждение
Среди всех детей, вошедших в исследование, фиброз печени различной степени выраженности от F1 до F4 по METAVIR наблюдался у 16 (28%) пациентов (согласно данным, полученным при транзиентной эластографии печени). При этом у абсолютного числа детей с фиброзом печени определялась стадия F1 по METAVIR – у 13 человек. Частота фиброза печени у детей I группы составила 32,1%, у детей II группы – 24,1% (р<0,05). Медиана эластичности печени у пациентов I группы – 5,4 [4,3;5,95] кПа, у детей II группы – 4,9 [4,3;5,7] кПа (р=0,355). У 41 (72%) ребенка не было выявлено фиброза в ткани печени (стадия фиброза F0 по METAVIR).
В ходе исследования были рассчитаны несколько индексов, основанных на комбинации непрямых маркеров фиброза печени, в частности индекс FIB-4 и индекс АРRI (табл. 1).
Таблица 1
Сравнительная характеристика показателей фиброза печени у детей I и II групп
|
Показатель |
Группа I (n=28) |
Группа II (n=29) |
р |
|
Эластичность печени, кПа |
5,4 [4,3;5,95] |
4,9 [4,3;5,70] |
0,355 |
|
Индекс FIB-4 |
0,325 [0,29;0,46] |
0,384±0,161 |
0,893 |
|
Индекс APRI |
0,310 [0,25;0,45] |
0,43 [0,23;0,51] |
0,085 |
|
χ² Пирсона, df 1, достоверность при р<0,05 |
|||
Статистически значимых различий по уровню эластичности печени, индексу FIB-4 и индексу АРRI у пациентов I и II групп выявлено не было. При этом у детей I группы достоверно чаще отмечался повышенный уровень эластичности печени, свидетельствующий о наличии фиброза, по сравнению с пациентами II группы.
У пациентов I группы средний уровень индекса АРRI составил 0,310 [0,25; 0,45], II группы – 0,43 [0,23;0,51]. Повышенный уровень индекса АРRI отмечался у 14% детей I группы и 24% пациентов II группы. Абсолютно все дети, вошедшие в исследование, имели значение индекса FIB-4 менее 1,45, что соответствует критерию «отсутствие выраженного риска формирования фиброза печени».
Учитывая важную роль ряда цитокинов в активации звездчатых клеток печени и дальнейшем формировании фиброза, авторы провели оценку уровня цитокинов у детей I и II групп (табл. 2).
Таблица 2
Сравнительная характеристика уровня цитокинов (ИЛ-6, ИЛ-4, ИЛ-10, ФНО-α) у детей I и II групп
|
Показатель |
Группа I (n=28) |
Группа II (n=29) |
р |
Норма |
|
ИЛ-6 пг/мл |
3,25 [2,00;4,00] |
2,00 [2,00;3,00] |
0,003 |
0-10 |
|
ИЛ-4 пг/мл |
10,00 [3,00;10,00] |
8,00 [3,00;10,00] |
0,236 |
0-4 |
|
ИЛ-10 пг/мл |
0,00 [0,00;5,00] |
0,00 [0,00;0,00] |
0,130 |
0-31 |
|
ФНО-α пг/мл |
2,75 [2,25;4,00] |
2,50 [2,00;3,00] |
0,900 |
0 – 6 |
|
χ² Пирсона, df 1, достоверность при р<0,05 |
||||
У пациентов и I, и II группы отмечается увеличение уровня ИЛ-4 относительно референсных значений (р=0,236).
При сравнении уровня цитокинов у детей I и II групп было выявлено значимое различие по показателю ИЛ-6 (р=0,003).
Многие авторы подчеркивают, что ИЛ-6 стимулирует и поддерживает фибротические процессы в печени [7, 8].
У пациентов II группы обнаружена значимая корреляция между уровнем ИЛ-6 и наличием жирового гепатоза (р<0,001) (рисунок).
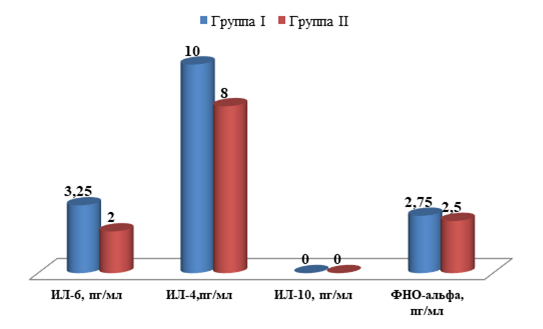
Цитокиновый профиль пациентов I и II групп
При проведении корреляционного анализа выявлена взаимосвязь уровня ИЛ-4 у пациентов II группы с гепатомегалией (р<0,001), а у пациентов I группы – с заболеваниями желудочно-кишечного тракта (р=0,019).
Важно отметить наличие умеренной тесноты прямую связь уровня ИЛ-6 с уровнем ПЦР РНК гепатита С (количественный) (р=0,506, р=0,006), а также с индексом фиброза APRI (р=0,42, р=0,0260) у пациентов I группы. Данный факт может свидетельствовать о сохраняющемся воспалении в ткани печени, вызванном ХГС. Стойкое воспаление способно активировать звездчатые клетки печени, что способствует развитию и сохранению фиброза.
Среди пациентов, вошедших в исследование, тяжелый фиброз печени был выявлен у одного подростка с коинфекцией ВИЧ/ХГС. Пациент Д., 2003 года рождения. Ребенок рожден от 3-й беременности, 1-х срочных самопроизвольных родов. Мать имела коинфекцию ВИЧ/ХГС, страдала героиновой наркоманией, не принимала антиретровирусную терапию (АРТ) во время беременности. Мальчик заражен ВИЧ и ХГС вертикальным путем. Течение ХГС характеризовалось волнообразной гиперферментемией, с минимальной степенью цитолитической активности. Среди клинических проявлений преобладали признаки астеновегетативного синдрома. Перенесенные заболевания: рецидивирующие респираторные инфекции, шейный лимфаденит с абсцедированием, острый гнойный отит, острый трахеобронхит.
В возрасте 9,5 года впервые назначена АРТ по схеме: зидовудин, ламивудин, нелфинавир (ZDV, 3TC, NLV). Смена схемы через полгода от старта на зидовудин, ламивудин, лопинавир/ритонавир (ZDV, 3TC, LPV/r). В последующем препарат лопинавир/ритонавир заменен на эфавиренз в связи со рвотой. По результатам теста на резистентность ВИЧ к АРТ был выявлен высокий уровень устойчивости к ламивудину, невирапину, эфавирензу, в связи с чем препарат эфавиренз заменен на атазанавир, бустированный ритонавиром.
До достижения 15,5 лет приверженность пациента терапии была крайне низкая, наблюдались периоды полного отказа от приема АРТ, негативное отношение к лечению, в связи с чем ни разу не было достигнуто неопределяемого уровня РНК ВИЧ.
В июне 2019 г., в возрасте 15 лет 7 месяцев, пациент госпитализирован в ФКУ «Республиканская клиническая инфекционная больница» Минздрава России с диагнозом: ВИЧ-инфекция. Стадия вторичных заболеваний 4 А, фаза прогрессирования на фоне нерегулярного приема АРТ. Рецидивирующие острые респираторные инфекции. Персистирующая генерализованная лимфаденопатия. Гепатомегалия. Хроническая герпетическая инфекция, персистирующее течение, ремиссия. Хроническая цитомегаловируная инфекция, персистирующее течение, ремиссия. Тубконтакт с матерью. Гипохромная анемия средней степени тяжести. Сопутствующий диагноз: Хронический вирусный гепатит С, 1 в генотип, минимальной степени биохимической активности, неуточненная стадия, репликативная фаза (РНК HCV+).
При поступлении на стационарное лечение у пациента были выявлены репликация ВИЧ (РНК ВИЧ – 27027 коп./мл), а также тяжелый иммунодефицит (СD4 – 10% (168 кл/мкл)). По данным клинического анализа крови у пациента выявлена гипохромная анемия средней степени тяжести (уровень гемоглобина – 79 г/л). В биохимическом анализе крови отмечались повышение уровня АЛТ (46,3 Е/л), АСТ (42,7 Е/л), соответствующее минимальной степени цитолитической активности, а также повышение уровня щелочной фосфатазы (1014,1 Е/л), что является проявлением синдрома холестаза.
По данным УЗИ органов брюшной полости паренхима печени незначительно диффузно-неоднородная, эхогенность неравномерно повышенная, выявлены обеднение сосудистого рисунка, нарушение реологических свойств желчи.
Анализ на резистентность ВИЧ показал наличие мутаций ко всем препаратам класса нуклеозидных ингибиторов обратной транскриптазы и ненуклеозидных ингибиторов обратной транскриптазы, а также устойчивость к ингибиторам протеазы (высокую к атазанавиру, нелфинавиру, низкую к лопинавиру/ритонавиру). В связи с этим произведена смена схемы лечения на дарунавир/ритонавир, ламивудин, долутегравир (DRV/r, 3TС, DTG). В результате через 3 месяца впервые достигнуто полное подавление репликации ВИЧ. Восстановление уровня CD4-лимфоцитов (795 кл/мкл) произошло только через 5 месяцев после подавления размножения ВИЧ. В последующем отмечалась высокая, стабильная приверженность пациента АРТ.
В апреле 2020 года, в возрасте 16 лет 3 месяцев, пациенту впервые определена эластичность печени методом транзиентной эластографии: медиана эластичности составила 14,5 кПа, что соответствует стадий фиброза F4 по шкале METAVIR. Определен индекс фиброза APRI – 1,78 и FIB-4 – 0,95, отмечалось повышение уровня ИЛ-4 до 10 пг/мл.
В возрасте 16,5 лет пациенту была проведена противовирусная терапия (ПВТ) ХГС препаратом глекапревир/пибрентасвир в течение 8 недель. Уровень РНК к гепатиту С (количественный) перед стартом ПВТ – 2,7×10⁶ МЕ/мл. На период ПВТ препараты дарунавир/ритонавир (DRV/r) отменены в связи с возможным возникновением нежелательных реакций при взаимодействии препаратов глекапревир/пибрентасвир и дарунавир. На всем протяжении ПВТ сохранялась подавленная вирусная нагрузка ВИЧ. По окончании курса ПВТ пациент был возвращен к прежней схемы АРТ (DRV/r, 3TС, DTG). Репликация ВГС была подавлена через 8 недель от начала ПВТ, а также через 12 недель после окончания курса ПВТ. У пациента наблюдался устойчивый вирусологический ответ в отношении вируса гепатита С в течение 2 лет, диагноз ХГС был снят.
Через 2 года после ПВТ, в возрасте 18,5 года, пациенту повторно выполнена транзиентная эластография печени: медиана эластичности составила 6,5 кПа, что соответствует стадий фиброза F1 по шкале METAVIR.
Данный клинический пример доказывает тот факт, что длительная низкая приверженность пациента АРТ, отсутствие подавления репликации ВИЧ приводят к ускорению прогрессирования фиброза печени (стадий фиброза F4 по шкале METAVIR, высокий уровень APRI – 1,78). Высокий уровень ИЛ-4 свидетельствует о поддержании воспаления в ткани печени, что также способствует формированию фиброза. Подавление репликации ВИЧ и ВГС способствовало восстановлению структуры печени, снижению стадий фиброза до F1 по шкале METAVIR. Важно отметить обратимость процессов фиброгенеза печени у детей при устранении этиологических факторов, приводящих к повреждению печеночной ткани.
Заключение. Сохранение воспалительной реакции в ткани печени влияет на прогрессирование хронического заболевания и формирование фибротических изменений. Это подтверждается повышенным уровнем ИЛ-4 у пациентов I и II группы, а также выявленной взаимосвязью ИЛ-6 с уровнем ПЦР РНК гепатита С (количественный) (р=0,506, р=0,006), а также с индексом фиброза APRI (р=0,42, р= 0,0260) у пациентов I группы. ИЛ-6 является основным медиатором воспаления и острофазовых реакций печени, необходим для блокирования апоптоза во время воспалительного процесса, его активность может влиять на прогрессирование хронического заболевания, стимулировать и поддерживать фибротические процессы в ткани печени.



