Глиальные опухоли являются наиболее распространенными первичными опухолями головного мозга, при этом в более чем 50% случаев диагностируют мультиформную глиобластому (ГБМ), которая имеет самую высокую степень злокачественности (WHO Grade IV) и наименьшую 5-летнюю выживаемость (6,8% по сравнению с пилоцетарной астроцитомой – 94,7%) [1]. Для ГБМ характерны инфильтративный рост, васкуляризация, что приводит к быстрому прогрессированию процесса. Основной инструмент в арсенале лечения глиом – оперативное вмешательство, которое для глиом высокой степени злокачественности (WHO III и IV) дополняется лучевой терапией и стандартной химиотерапией на базе темозоломида [2]. Существующие методы лечения не увеличили общую выживаемость пациентов с ГБМ, что ставит задачу поиска новых высокочувствительных и специфичных маркеров диагностики заболевания.
Открытие эндогенных некодирующих микроРНК, регулирующих экспрессию мРНК-мишеней, стало прорывом в диагностике и прогнозировании многих заболеваний. Показано, что в глиальных опухолях на различных стадиях онкогенеза уровень отдельных микроРНК претерпевает аберрантные изменения [3]. Функциональный анализ ряда микроРНК, специфичных для глиом, выявил, что они могут проявлять себя и как онкогены, и как супрессоры опухолей: установлены их связь с развитием устойчивости к химиотерапии и лучевой терапии, стимулированию неоангиогенеза и пролиферации клеток, а также участие в регулировании клеточного цикла и апоптоза [4, 5]. Доступность для определения опухолевых микроРНК в биологических жидкостях делает их привлекательными диагностическими и прогностическими маркерами [5, 6]. Профиль микроРНК также специфичен для разных стадий заболевания [7], что может использоваться в прогнозе [8, 9], диагностике и при выборе соответствующей терапии [9].
Цель исследования: валидация пяти микроРНК (hsa-miR-3180-3p, hsa-miR-342-3p, has-let-7c-5p, has-miR-21a-5p, has-miR-190b-5p, has-miR-16-5p), выявленных ранее в биоинформационном анализе данных TCGA в качестве опухоль-специфичных маркеров, путем определения их уровня в опухоли и плазме пациентов с глиомами головного мозга различной степени злокачественности для диагностики и прогноза заболевания.
Материалы и методы исследования
Работа выполнена в ФГБУ «НМИЦ онкологии» Минздрава России с 2019 по 2021 гг. Исследование одобрено этическим комитетом ФГБУ «НМИЦ онкологии» Минздрава России. Все пациенты подписали информированное согласие на участие в исследовании.
Средний возраст в выборке составил 48±12,5 года, количество мужчин 39 человек, количество женщин 41 человек. Выборка включала основную группу пациентов с глиальными опухолями головного мозга различной степени злокачественности – 20 пациентов с диффузной астроцитомой (ДА, GII, возраст 47,7±8,6 года); 20 пациентов с анапластической астроцитомой (АА, GIII, возраст 52,1±8,9 года); 20 пациентов с глиобластомой (ГБ, GIV, возраст 57,8±4,4 года); а также группу сравнения – 20 человек условно здоровых (К, возраст 46,9±6,7 года). Патоморфологический диагноз установлен на базе иммуногистохимических и молекулярно-генетических исследований. В исследование были отобраны пациенты без генетических изменений в IDH1/2 и без коделеции 1p/19q.
Материалом служили ткани глиом и условно здоровой (контрольной) ткани, депонированных в биобанке центра. Венозную кровь собирали натощак до операции с использованием пробирок 6 мл вакуумного типа с ЭДТА («Becton Dickinson International», США). Образцы крови центрифугировали при 1900g, +4°С в течение 10 минут. Верхнюю фазу отбирали для повторного центрифугирования при 16000g, +4°С в течение 10 минут. Опухолевый материал получали интраоперационно, помещали в пробирки с фиксатором IntactRNA (Евроген, Россия) и хранили до анализа при –70°С.
В предварительном биоинформационном анализе открытых баз данных [3] авторами был выделен пул из пяти микроРНК, ассоциированных с глиальными опухолями. Для определения их относительной экспрессии были разработаны специфичные праймеры (табл.1).
Таблица 1
Последовательности исследуемых микроРНК и используемых ДНК-праймеров
|
микроРНК |
Последовательность |
Последовательность праймеров |
|
hsa-miR-3180-3p |
UGGGGCGGAGCUUCCGGAGGCC |
CGCAGGGGGCGGAGCT AGGTCCAGTTTTTTTTTTTTTTTGGCCT |
|
hsa-miR-342-3p |
UCUCACACAGAAAUCGCACCCGU |
CGCAGTCTCACACAGAAATC CAGGTCCAGTTTTTTTTTTTTTTTACGGGT |
|
hsa-let-7c-5p |
UGAGGUAGUAGGUUGUAUGGUU |
CGCAGTGAGGTAGTAGGTTGTA CAGGTCCAGTTTTTTTTTTTTTTTAACCA |
|
hsa-miR-21a-5p |
UAGCACCAUCUGAAAUCGGUUA |
CGCAGTAGCACCATCTGAAA CAGGTCCAGTTTTTTTTTTTTTTTAACCGA |
|
hsa-miR-190b-5p |
UGAUAUGUUUGAUAUUGGGUUG |
CGCAGTGATATGTTTGATATTGG CAGGTCCAGTTTTTTTTTTTTTTTCAAC |
|
hsa-miR-16-5p |
UAGCAGCACGUAAAUAUUGGCG |
CGCAGTAGCAGCACGTAAATAT AGGTCCAGTTTTTTTTTTTTTTTCGCCT |
|
Универсальный праймер для обратной транскрипции |
CAGGTCCAGTTTTTTTTTTTTTTTVN |
|
Процедуры выделения фракции микроРНК, проведения обратной транскрипции, ПЦР в реальном времени, расчет показателя относительной экспрессии были подробно описаны ранее [3, 7]. Статистическая обработка данных включала определение критерия Краскела–Уоллиса, U-тест Манна–Уитни с поправкой на множественные сравнения Бонферрони–Хохберга в программной среде R 4.0.4. При p<0,05 различия признавались статистически значимыми.
Результаты исследования и их обсуждение
На основании разработанной системы для определения уровней относительной экспрессии была проведена оценка экспрессии пяти микроРНК параллельно в образцах опухоли и условно нормальной ткани 60 пациентов с глиальными опухолями разной степени злокачественности. Результаты относительной экспрессии приведены на рисунке 1. Результаты уровней экспрессии того же пула микроРНК в 60 образцах плазмы пациентов проиллюстрированы на рисунке 2.
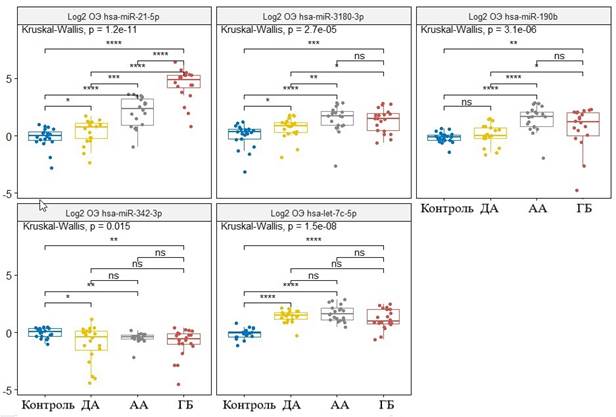
Рис. 1. Относительная экспрессия (ОЭ) микроРНК в тканях глиом различной степени злокачественности (ДА, АА и ГБ) и условно здоровой ткани (Контроль) головного мозга. * – p<0,05, ** – p<0,01, *** – p<0,001, **** – p<0,0001
Использованный пул микроРНК позволил дифференцировать опухолевую ткань от условно нормальной ткани по всем пяти маркерам. Экспрессия hsa-let-7c-5p, hsa-miR-3180-3p, hsa-miR-190b-5p и hsa-miR-21-5p в опухолях увеличивалась, тогда как экспрессия hsa-miR-342-3p достоверно снижалась в образцах опухоли. Глиомы разной степени злокачественности также различались по уровню ряда микроРНК. При этом уровень относительной экспрессии hsa-miR-21-5p нарастал с увеличением степени злокачественности глиальной опухоли. В глиобластоме зафиксирован более высокаий уровень относительной экспрессии (ОЭ) hsa-miR-3180-3p, hsa-miR-190b-5p и hsa-miR-21-5p по сравнению с диффузной астроцитомой; а также ОЭ hsa-miR-21-5p, hsa-miR-190b-5p по сравнению с анапластической астроцитомой. Диффузная астроцитома и анапластическая астроцитома различались по экспрессии hsa-miR-21-5p, hsa-miR-3180-3p, hsa-miR-190b-5p.

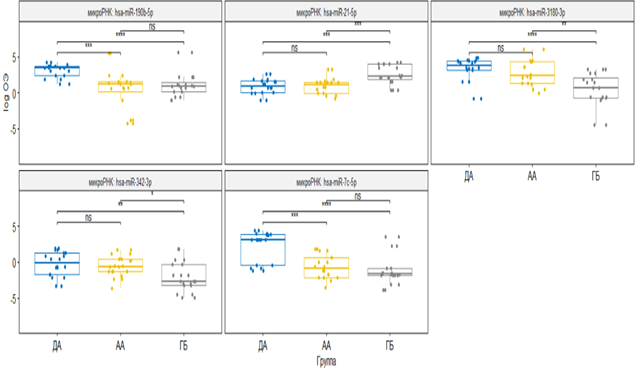
Рис. 2. Экспрессия микроРНК в плазме крови в группе глиом разной степени злокачественности. Ось y – относительная экспрессия, ось x – группы. Синим цветом отмечена группа с диффузной астроцитомой (ДА), желтым – пациенты с анапластической астроцитомой (АА), серым – с глиобластомой (ГБ). * – p<0,05, ** – p<0,01, *** – p<0,001, **** – p<0,0001
В плазме крови уровень пяти микроРНК также достоверно различался между контрольной группой и пациентами с глиальными опухолями. Достоверные отличия в уровнях относительной экспрессии между группами пациентов наблюдали для hsa-miR-342-3p и hsa-miR-21-5p. Дополнительно от других опухолевых групп можно было дифференцировать глиобластому по экспрессии hsa-miR-3180 и диффузную астроцитому по экспрессии hsa-let-7c-5p.
В исследовании авторов микроРНК в образцах тканей и плазмы демонстрировали однонаправленный характер изменений, за исключением hsa-let-7c-5p (табл. 2).
Таблица 2
Характеристика изменений относительной экспрессии в образцах плазмы и тканей пациентов с глиомами
|
МикроРНК |
Группы |
ОЭ в плазме |
ОЭ в тканях |
Корреляция |
|
|
r |
p |
||||
|
hsa-miR-21-5p |
ГБ |
4,9 |
29,6 |
0,64 |
0,0023 |
|
АА |
2,22 |
5,35 |
0,81 |
1,4E-04 |
|
|
ДА |
1,91 |
1,74 |
0,55 |
0,011 |
|
|
hsa-miR-342-3p |
ГБ |
0,16 |
0,68 |
0,79 |
4,3E-04 |
|
АА |
0,65 |
0,76 |
0,58 |
0,0076 |
|
|
ДА |
0,9 |
0,77 |
0,41 |
0,071 |
|
|
hsa-miR-3180-3p |
ГБ |
1,59 |
2,8 |
0,58 |
0,0079 |
|
АА |
5,11 |
3,3 |
0,6 |
0,0053 |
|
|
ДА |
13,68 |
1,82 |
0,45 |
0,047 |
|
|
hsa-let-7c-5p |
ГБ |
0,32 |
2,79 |
0,04 |
0,86 |
|
АА |
0,54 |
3,0 |
-0,21 |
0,37 |
|
|
ДА |
8,63 |
2,7 |
0,58 |
0,0074 |
|
|
hsa-miR-190b-5p |
ГБ |
1,84 |
2,35 |
0,43 |
0,059 |
|
АА |
2,24 |
3,2 |
0,22 |
0,35 |
|
|
ДА |
11,02 |
1,02 |
0,41 |
0,072 |
|
ОЭ – относительная экспрессия, r – корреляция Спирмена
Несмотря на выявленное достоверное увеличение экспрессии hsa-miR-190b-5p как в опухоли, так и в плазме, не была обнаружена достоверная корреляция при попарном сравнении образцов пациентов. Во всех группах глиом уровень hsa-miR-21-5p и hsa-miR-3180-3p достоверно увеличивался как в образцах плазмы, так и в опухолевой ткани. Уровень hsa-miR-342-3p снижался согласованно в опухоли и плазме, не достигнув достоверных значений только в группе ДА (р=0,071). Интересна динамика изменения ОЭ hsa-let-7c-5p, для которой отмечена повышенная экспрессия в опухоли независимо от стадии (рис. 1), однако в плазме ее уровень падал от диффузной астроцитомы к глиобластоме (рис. 2), что отразилось и на корреляции: выявлены однонаправленность экспрессии в плазме и опухоли при диффузной астроцитоме и противоположная тенденция в группах АА и ГБ.
Описание профиля экспрессии микроРНК, специфичного для глиом, свидетельствует об их участии в онкогенезе, что расширяет возможности диагностики и прогнозирования этих видов рака. В исследование авторов вошли микроРНК, продемонстрировавшие свойства супрессора опухолей (hsa-miR-342-3p) и онкогенов (hsa-miR-190b-5p, hsa-let-7c-5p, hsa-miR-21-5p, hsa-miR-3180-3p).
Отметим, что в литературе наиболее часто описывается hsa-miR-21-5p как «онкогенная» микроРНК, которая демонстрировала гиперэкспрессию в тканях глиом различной степени злокачественности [3].
В исследовании авторов как в образцах плазмы, так и в опухолевых образцах глиом отмечен повышенный уровень экспрессии hsa-miR-21-5p, нарастающий со степенью злокачественности опухоли. Нsa-miR-190b-5p и hsa-miR-3180-3p также демонстрируют повышение уровней относительной экспрессии как в образцах плазмы, так и в образцах тканей. И если в отношении hsa-miR-190b-5p установлена ее онкогенная функции [10], то для hsa-miR-3180-3p было описано целевое блокирование PI3K-AKT сигнального пути в клетках гепатоцеллюлярной карциномы (HepG2), что должно обеспечивать антипролиферативный характер активности данной микроРНК [11].
Неоднозначна трактовка роли hsa-let-7c-5p при онкологических заболеваниях, в ряде работ эта микроРНК ассоциировалась с онкосупрессорными функциями в опухолях эндометрия, гепатоклеточной карциноме и др. [12]. Напротив, в глиальных опухолях отмечалось увеличение экспрессии hsa-let-7c [13]. Интересен характер изменения относительной экспрессии hsa-let-7c в работе авторов: разнонаправленный характер экспрессии в образцах плазмы и тканей пациентов с анапластической астроцитомой и глиобластомой, но согласованный при диффузной астроцитоме.
Единственная онкосупрессорная микроРНК в исследованном пуле – hsa-miR-342-3p – продемонстрировала снижение относительной экспрессии в образцах плазмы крови, коррелировавшее с активностью микроРНК в опухолевых образцах GIV и GII. Онкосупрессорная роль hsa-miR-342-3p была доказана после открытия механизма регулирования этой микроРНК процессов роста и апоптоза через многочисленные прямые мишени [14].
В итоге выбранная панель биомаркеров продемонстрировала хорошую корреляцию экспрессии в опухоли и плазме, что может быть полезно для диагностики опухолей головного мозга с использованием жидкостной биопсии. Это минимально инвазивная процедура, посредством которой анализируют циркулирующие нуклеиновые кислоты, которые рассматриваются как материал в том числе из опухолевой ткани, следовательно, они могут представлять собой ее подлинный и репрезентативный образец. Установление профиля экспрессии микроРНК, характерного для клеток глиальных опухолей, дает альтернативную возможность точной идентификации типа и степени злокачественных изменений в глиальных клетках [6, 9]. Учитывая данные о возвращении к нормальному уровню циркулирующих микроРНК после операции и химиотерапии [15], возможно их использование в качестве биомаркеров ответа на терапию.
Выводы. Таким образом, в исследовании показано, что значимое изменение относительной экспрессии hsa-miR-21-5p, hsa-miR-342-3p, hsa-miR-3180-3p, hsa-let-7c-5p и hsa-miR-190b-5p в плазме крови когерентно с направлением изменения в ткани глиальных опухолей разной степени злокачественности, что может стать основой малоинвазивной тест-системы, дополняющей основные диагностические методы.



