Прогнозирование недержания мочи (НМ) и реабилитации пациентов с функциональными осложнениями после робот-ассистированной радикальной простатэктомии (РАРП) является актуальной проблемой онкоурологии. По данным метаанализа, частота инконтиненции после РАРП составляет от 4 до 31% через 12 месяцев после операции [1]. Известно, что радикальная простатэктомия (РПЭ) изменяет не только анатомию малого таза, но и функцию мочевого пузыря и уретры, что, в свою очередь, приводит к таким осложнениям, как НМ и дисфункция мочевого пузыря [2]. В научных исследованиях последних лет подчеркивается многофакторность развития НМ после РАРП [3], что определяет важность персонифицированного подхода к ведению пациентов данной категории. Группой исследователей разработана предиктивная модель НМ после РАРП на основании уродинамических параметров [4]. Предиктивными факторами недержания мочи после РАРП авторы считают снижение эластичности стенки мочевого пузыря, максимального давления закрытия уретры и наличие инфравезикальной обструкции [4]. Однако в прогностическую модель НМ авторы включали только уродинамические параметры, без учета клинических и онкологических факторов. Создание комплексной прогностической модели позволит более эффективно стратифицировать пациентов с локализованным раком предстательной железы (РПЖ) на группы риска НМ до оперативного лечения и применить адекватную состоянию больного программу реабилитации после РАРП, что, несомненно, будет способствовать повышению качества жизни пациентов.
Целью исследования явилось выявить предикторы недержания мочи в различные сроки после робот-ассистированной радикальной простатэктомии у больных локализованным раком предстательной железы.
Материалы и методы исследования. Исследование проведено на 65 больных локализованным РПЖ. РАРП выполняли на роботической системе Da Vinci Si четырьмя хирургами, имеющими опыт более 300 операций. Длительность операции в целом по группе составляла 174±30 мин, интраоперационная кровопотеря – 216±19 мл.
Критериями включения в исследование явились: локализованная форма РПЖ (стадии T1-T2N0M0); предоперационный уровень общего простата-специфического антигена (ПСА) менее 15 нг/мл; возраст менее 70 лет; использование в качестве лечения РАРП.
Критерии невключения: положительный хирургический край; местнораспространенные и метастатические формы РПЖ; индекс Глисона 8 и более; предшествующая гормональная, лучевая, химиотерапия; осложнения оперативного лечения; предварительные операции на органах малого таза, фаллопротезирование; неврологические заболевания, сопровождающиеся нарушением функции тазовых органов; отсутствие самостоятельного мочеиспускания (интермиттирующая катетеризация, уретральный катетер, цистостома); декомпенсированные сопутствующие заболевания.
Критерии исключения: несоблюдение пациентами сроков динамического обследования.
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России (протокол № 19 от 24.01.2020 г.). От всех больных было получено информированное согласие на проведение исследований и последующее использование полученных данных в научных целях.
В течение 12 месяцев после РАРП фиксировали как сам факт развития НМ, так и сроки наступления осложнения. Критерием недержания мочи считали использование 1 и более прокладок в сутки после удаления уретрального катетера.
В подгруппах больных в зависимости от наличия (1-я группа, n=30) или отсутствия НМ (2-я группа, n=35) через 12 месяцев после РАРП ретроспективно оценивали следующие предикторы: возраст, индекс массы тела, сопутствующие заболевания, суммарные баллы выраженности симптомов при заболеваниях предстательной железы, международный индекс эректильной функции, параметры дневника мочеиспусканий, стадия РПЖ по TNM, уровни общего и ПСА в сыворотке крови, экспрессия гена РСА3 в осадке мочи, опыт хирурга, нервсбережение, длительность катетеризации мочевого пузыря, параметры ультразвукового исследования, магнитно-резонансной томографии (размеры предстательной железы, толщина мышцы, поднимающей задний проход, толщина внутренней запирательной мышцы), функциональные изменения, выявляемые при комплексном уродинамическом исследовании, экспрессия Ki-67, a-метил-ацил-КоА-рацемазе (AMACR), р53 в опухолевой ткани.
В сыворотке крови уровень общего и свободного ПСА определяли путем иммуноферментного анализа.
Иммуногистохимическое исследование (ИГХИ) опухолевой ткани проводили в соответствии со стандартным протоколом. При этом были использованы моноклональные мышиные антитела к белку Ki-67 (1:200, Diagnostic Biosystems, Испания), моноклональные кроличьи антитела к человеческим AMACR (Alpha methylacyl-CoA-racemase) (P504S) (Dako, США), мышиные моноклональные антитела к p53 DO7 (Dako, США). Результаты ИГХИ маркеров оценивали, учитывая число позитивно окрашенных клеток на 1000 клеток в баллах: 0 баллов – отсутствие экспрессии (0–10% окрашенных клеток), 1 балл(10–25%) – слабая экспрессия, 2 балла(25–50%) – умеренная экспрессия, 3 балла(более50%) – сильная экспрессия маркера.
Уровень мРНК гена РСА3 в осадке мочи определяли методом полимеразной цепной реакции в реальном времени (ПЦР-РВ). В качестве референсного гена использовали ген калликреина человека KLK3. При ПЦР-РВ использовали готовые праймеры KLK3 и PCA3 (Applied Biosystems, FAM).
После выявления предикторов событийную вероятность развития НМ после РАРП оценивали с помощью метода Каплана–Мейера, а прогностическую значимость предикторов на развитие НМ анализировали с помощью регрессионного анализа Кокса.
Статистическую обработку полученных данных проводили с использованием программы Statistica 12,0 (StatSoft, США). Проверку на нормальность распределения величин проводили с использованием критерия Колмогорова-Смирнова. Количественные показатели были представлены в виде медианы и межквартильного диапазона. Сравнение средних двух групп осуществляли с помощью критерия Манна–Уитни. В работе использовали методы Каплана–Мейера, регрессионный анализ Кокса.
Результаты исследования и их обсуждение. Возраст 65 пациентов, включенных в исследование, колебался от 51 до 69 лет, медиана составила 65 лет, межквартильный диапазон – 59–64 года. В 1-й и 2-й группах возраст пациентов не различался (62 [57–65] года против 64 [61–66] лет, р=0,78). По стадиям РПЖ больные распределились следующим образом: в 1-й группе T1c встречалась у 2 (6,7%), T2a – у 9 (30%), T2b – у 3 (10%) и T2c – у 16 (53,3%) пациентов, а во 2-й группе T2a выявлена у 13 (37,1%), T2b – у 4 (11,4%) и T2c – у 18 (51,5%) больных. Различия распределения больных по стадиям РПЖ в двух группах отсутствовали (р=0,454). В 1-й группе индекс Глисона 6 (3+3) был выявлен у 22 (73,3%) больных, 7 (3+4) – у 6 (20%) и 7 (4+3) – у 2 (6,7%) пациентов, а во 2-й группе – у 27 (77,1%, 7 (20%) и 1 (2,9%) больного соответственно (р=0,764).
У пациентов 1-й и 2-й групп отсутствовало различие по таким изучаемым показателям, как возраст (р=0,78), индекс массы тела (28 [26–29] кг/м2 против 26 [25–28] кг/м2, р=0,223), суммарные баллы выраженности симптомов при заболеваниях предстательной железы (17 [10–20] баллов против 17 [6–19] баллов, р=0,475), международный индекс эректильной функции (16 [14–19] баллов против 18 [13–21] баллов, р=0,464), параметры дневника мочеиспусканий, стадия РПЖ по TNM (р=0,454), уровни общего (6 [4–8] нг/мл против 6 [4–9] нг/мл, р=0,385) и свободного ПСА в сыворотке крови, опыт хирурга, нервсбережение, длительность катетеризации мочевого пузыря, размер предстательной железы (41 [36–51] см3 против 46 [33–53] см3, р=0,972) и объем остаточной мочи (38 [30–42] мл против 37 [24–42] мл, р=0,493). Толщина внутренней запирательной мышцы в зависимости от развития НМ не различалась (20 мм [19–21] против 21 мм [20–22], p=0,069).
При сравнительном анализе показателей ультразвукового и уродинамического обследования в 1-й и 2-й группах статистически значимые отличия были установлены для емкости мочевого пузыря и амплитуды детрузорной гиперактивности (табл. 1).
Таблица 1
Результаты дооперационного обследования больных со статистически значимым различием в 1-й и 2-й группах
|
Показатели |
1-я группа, n=30 |
2-я группа, n=35 |
р |
|
Емкость мочевого пузыря, мл |
338 [245–388] |
370 [350–395] |
0,034 |
|
Амплитуда детрузорной гиперактивности, см вод. ст. |
36 [31–42] |
24 [21–27] |
<0,001 |
|
Толщина мышцы, поднимающей задний проход, мм |
9 [8–10] |
11 [10–12] |
<0,001 |
|
мРНК гена РСА3 в осадке мочи |
–0,47 [–0,53–0,68] |
0,34 [–0,17–0,92] |
0,015 |
При проведении магнитно-резонансной томографии в 1-й группе по сравнению со 2-й группой установлено повышение толщины мышцы, поднимающей задний проход (p<0,001).
Гиперэкспрессия РСА3 в ткани простаты строго специфична для РПЖ и его метастазов и не характерна для доброкачественных процессов в органе [5]. Причем при РПЖ РНК-продукт этого гена присутствует в моче. Диагностические возможности определения уровня мРНК гена РСА3 в моче при РПЖ известны [5], а влияние на развитие функциональных осложнений после операции не исследовалось. В работе установлено, что у больных 1-й группы по сравнению со 2-й группой дооперационная активность экспрессии гена РСА3 в осадке мочи была выше (р=0,015) (табл. 1).
При сравнении выраженности экспрессии Ki-67, AMACR, р53 в опухолевой ткани установлено, что в 1-й группе, в отличие от 2-й группы, экспрессия пролиферативных факторов Ki-67 и AMACR была выше (p<0,05) (табл. 2), а экспрессионная активность р53 не различалась (p=0,599) (табл. 2).
Таблица 2
Экспрессия онкомаркеров в опухолевой ткани у больных 1-й и 2-й групп
|
Группа |
1 балл |
2 балла |
3 балла |
р |
|||
|
Абс. ч. |
% |
Абс. ч. |
% |
Абс. ч. |
% |
||
|
Экспрессия Ki-67 |
|||||||
|
1-я группа (n=30) |
3 |
10,0 |
23 |
76,7 |
4 |
13,3 |
0,007 |
|
2-я группа (n=35) |
13 |
37,1 |
22 |
62,9 |
– |
– |
|
|
Экспрессия AMACR |
|||||||
|
1-я группа (n=30) |
1 |
3,3 |
5 |
16,7 |
24 |
80,0 |
0,034 |
|
2-я группа (n=35) |
3 |
8,6 |
15 |
42,9 |
17 |
48,5 |
|
|
Экспрессия р53 |
|||||||
|
1-я группа (n=30) |
12 |
40,0 |
16 |
53,3 |
2 |
6,7 |
0,599 |
|
2-я группа (n=35) |
12 |
34,3 |
18 |
51,4 |
5 |
14,3 |
|
Как известно, Ki-67 является маркером клеточной пролиферации и широко используется ввиду его высокой воспроизводимости и информативности [6]. Повышение активности фермента AMACR при наличии разветвленных жирных кислот усиливает клеточные свободнорадикальные процессы, что способствует повреждению ДНК клеток и опухолевому росту [7]. Ген р53 локализуется в ядрах клеток и относится к супрессорам опухолевого роста [8].
Вероятность развития НМ после РАРП в первый год после операции оценивалась с помощью метода Каплана–Мейера. НМ у больных исследуемой группы развивалось в основном в первые 7 месяцев после операции. Оценка мгновенного риска развития изучаемого осложнения позволила уточнить, что риск развития НМ повышался в 1,1 месяца и 6,8 месяца после операции (рисунок). Это позволило нам разделить сроки развития НМ на ранние (до 6 недель) и отдаленные (свыше 6 месяцев) после операции.
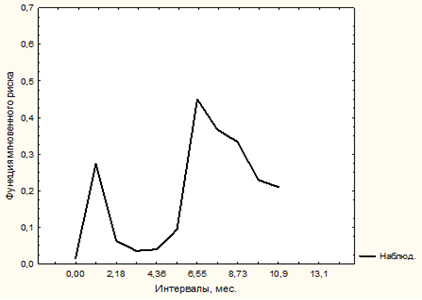
Функция мгновенного риска НМ у больных после РАРП
Влияние выявленных в результате сравнительного анализа предикторов на вероятность развития НМ в ранние и отдаленные сроки после операции анализировали с помощью регрессионного анализа Кокса (табл. 3).
Таблица 3
Результаты регрессионного анализа Кокса по влиянию предикторов на НМ в ранние и отдаленные сроки после РАРП
|
Показатели |
Ранние сроки НМ |
Отдаленные сроки НМ |
||
|
ОШ |
р |
ОШ |
р |
|
|
Емкость мочевого пузыря, мл |
1,96 |
0,021 |
1,38 |
0,174 |
|
Амплитуда детрузорной гиперактивности, см вод. ст. |
1,37 |
0,245 |
1,93 |
0,004 |
|
Толщина мышцы, поднимающей задний проход, мм |
1,43 |
0,067 |
1,79 |
0,005 |
|
мРНК гена РСА3 в осадке мочи |
1,55 |
0,045 |
1,36 |
0,173 |
|
Экспрессия Ki-67 |
1,68 |
0,039 |
1,40 |
0,205 |
|
Экспрессия AMACR |
1,61 |
0,041 |
1,27 |
0,292 |
Примечание: ОШ – отношение шансов
В результате было установлено, что такие дооперационные изменения, как снижение емкости мочевого пузыря, усиление экспрессии гена РСА3 в осадке мочи и экспрессия пролиферативных факторов Ki-67 и AMACR в опухолевой ткани, были сопряжены с развитием НМ в ранние сроки после РАРП, а высокая амплитуда детрузорной гиперактивности и снижение толщины мышцы, поднимающей задний проход, ассоциированы с развитием НМ в отдаленные сроки после операции (табл. 3). Таким образом, не только изменения функциональных и анатомических особенностей удержания мочи были связаны с развитием НМ после операции, но и активность экспрессии онкомаркеров. В ранее проведенных исследованиях было установлено, что известным предиктором развития НМ после радикальной простатэктомии выступает длительно существующая дооперационная инфравезикальная обструкция [4]. В свою очередь, выраженность и длительность инфравезикальной обструкции, очевидно, связаны с активностью пролиферации опухолевых клеток и выраженностью экспрессии онкомаркеров.
Опираясь на прогноз развития НМ после РАРП, возможно рационально выстроить тактику лечения функционального осложнения после операции. Высокий риск раннего развития НМ после операции позволяет больше склоняться в сторону хирургической коррекции нарушений удержания мочи, а риск отдаленных осложнений – в пользу комплексной консервативной реабилитации пациентов.
Выводы
1. Риск развития НМ после РАРП у больных локализованным РПЖ в ранние сроки после операции сопряжен с дооперационным снижением емкости мочевого пузыря, высокой экспрессией гена РСА3 в осадке мочи и выраженной экспрессией онкомаркеров Ki-67 и AMACR в опухолевой ткани.
2. Предикторами развития НМ в отдаленные сроки после РАРП у больных локализованным РПЖ являются высокая амплитуда детрузорной гиперактивности до операции и снижение толщины мышцы, поднимающей задний проход.



