Согласно базе данных ВОЗ из всех случаев онкологических заболеваний в мире у женщин на долю РМЖ приходится 16 %. Так, в 2018 г. в мире было зарегистрировано около 2,1 млн новых случаев заболевания РМЖ среди женщин, количество повторно диагностированных случаев заболевания выросло на 20 %, а уровень смертности на 14 % [1]. Существует ряд факторов риска, повышающих вероятность развития РМЖ, к ним относятся: возраст от 40 лет, раннее начало менструации, использование гормональных контрацептивов, поздняя беременность, ожирение, малоподвижный образ жизни, злоупотребление алкоголем и обилие жирной пищи в рационе [2]. Помимо факторов окружающей среды на развитие РМЖ оказывают влияние такие сигнальные молекулярные пути, как Notch, Hedgehog (НН), NF-kB и Wnt. Рассмотрим подробнее каждый из них.
Активацию сигнального пути Notch наблюдают как в нормальных, так и в злокачественных клетках. Данный путь является главным регулятором направления и дифференцировки клеток [3] и активируется путем связывания трансмембранного рецептора Notch с лигандом, выделенным соседней клеткой. Экспрессия Notch регулируется гипоксией и цитокинами (IL-1, IL-6 и лептином). Передача сигналов по данному пути зависит от связывания рецептора Notch и лиганда Delta/Serrate посредством эндоцитоза и процесса межклеточной коммуникации. Исследования показали, что аберрантная передача сигналов Notch индуцирует карциному молочной железы [4]. Сигнальный путь НН облегчает эмбриональное развитие и дифференцировку клеток. Семейство белков НН состоит из лигандов Sonic-SHH, Indian-IHH и Desert-DHH, которые в каноническом пути НН связываются с трансмембранным рецептором клеточной поверхности Patched (PTCH). В свободном состоянии PТСН1 ингибирует трансмембранный белок Smoothened (SMO), при связывании PTCH1 с лигандом репрессия SMO ослабляется, инициируется внутриклеточный каскад, способствующий активации семейства белков глиома-ассоциированного онкогена (GLI), которые активируют все транскрипционные эффекты сигнального пути НН [5]. Активность GLI регулируется цитоплазматическим белком SUFU, который ингибируется белком SMO. При нерегулируемой активности SMO создаются условия для индукции роста опухолевых клеток [6]. Сигнальный путь NF-κB играет решающую роль в формировании иммунного ответа, выживании опухолевых клеток и воспалении. Он подразделяется на два основных типа – канонический и альтернативный.
Активация канонического пути осуществляется провоспалительными цитокинами, PAMPs и DAMPs, которые действуют через специфические рецепторы и адаптерные молекулы. Альтернативный путь активируется подгруппой цитокинов семейства TNF, включая лимфотоксин, активатор рецептора лиганда NF-kB, лиганд CD40 и фактор активации В-клеток семейства TNF [3]. Канонический путь, согласно некоторым исследованиям, ускоряет самообновление стволовых клеток рака молочной железы. Активация альтернативного пути способствует усилению туморогенности клеток РМЖ человека. Кроме того, оба типа сигнальных путей способствуют активации сигнального пути Notch, посредством повышения уровня экспрессии мембранного белка JAG1, что приводит к расширению популяции стволовых клеток РМЖ [7].
Сигнальный путь Wnt связан с распространением опухолевых клеток, их инвазией и резистентностью к существующим противоопухолевым препаратам. Лиганды Wnt активируют различные внутриклеточные сигналы, подразделяющиеся на β-катенин-зависимый и β-катенин-независимый пути – с развитием РМЖ зачастую связывают β-катенин-зависимый Wnt путь [8]. Регуляторным фактором передачи сигналов Wnt/β-катенина является танкираза (TNKS), относящаяся к семейству белков, ответственных за поли-АДФ-риболизирование и взаимодействующая с последовательностями связывания теломерных повторов. Нокдаун TNKS ответственен за уменьшение образования опухолей и пролиферации клеток в клеточных опухолевых линиях [9]. Ввиду этого актуально изучение влияния ингибитора Wnt-пути XAV-939, который также оказывает ингибирующее действие на белки TNKS1 и TNKS2, подавляя транскрипцию β-катенина в сигнальном пути Wnt.
Цель данной работы – изучение влияния XAV-939 на паспортизированную клеточную линию РМЖ MDA-MB-453 и первичную клеточную линию ТНРМЖ в монотерапии и в комбинации с веществом сравнения – паклитакселом.
Материалы и методы исследования
Создание первичной культуры
Полученный после резекции опухоли фрагмент ткани размером около 1 см, очищенный от некроза и соединительной ткани, помещали на 1 мин в 70 % спирт для исключения вероятности контаминации. После чего измельчали ткань в ламинарном боксе на фрагменты около 1 мм, переносили их в центрифужную пробирку с 10 мл питательной среды DMEM и центрифугировали при 3000 об/мин в течение 2 мин. Удаляли супернатант и переносили преципитат во флакон со смесью питательной среды и коллагеназы. Помещали флакон в СО2 инкубатор с температурой 37 °С на 2 ч, по истечении которых отфильтровали суспензию и центрифугировали при 3000 об/мин в течение 2 мин. Удаляли супернатант, преципитат отмывали от коллагеназы стерильным DMEM с добавлением 5 % FBS и повторяли этап центрифугирования. Данную процедуру проводили дважды. Полученную суспензию клеток культивировали стандартным способом.
МТТ-тест
Для оценки жизнеспособности клеток применяли МТТ-тест, заключающийся в колориметрической оценке активности клеток по интенсивности реакции восстановления тетразолиевого красителя НАДФ-Н зависимыми оксидоредуктазными ферментами до формазана, обладающего пурпурным окрасом [10]. Посев культуры проводился согласно стандартному протоколу пересева клеточной культуры. После достижения клетками около 85 % конфлюентности снимали клетки с флакона, подсчитывали количество и высевали по 2 тыс. клеток в три 96-луночных планшета. Помещали в инкубатор на сутки, по истечении которых отбирали питательную среду, вносили в каждую ячейку по 100 мкл тестируемых веществ и снова помещали планшеты в инкубатор на 24, 48 и 72 ч в соответствии с запланированным дизайном. После инкубации клеточной линии с тестируемыми веществами удаляли среду из лунок, вносили в каждую лунку по 50 мкл рабочего раствора МТТ и инкубировали еще 4 ч в условиях СО2 инкубатора. После удаляли жидкость из лунок, добавляли по 100 мкл DMSO, перемешивали суспензию до растворения кристаллов формазана. Определяли оптическую плотность в каждой лунке при 540 нм с помощью микропланшетного ридера Infinite 200Pro.
Тестируемые вещества, клеточные линии и дизайн эксперимента
Для данной работы использовали паспортизированную культуру карциномы РМЖ MDA-MB-453 и первичную клеточную линию тройного негативного РМЖ (ТНРМЖ), полученную на базе лаборатории клеточных технологий ФГБУ «НМИЦ онкологии» Минздрава России. В качестве тестируемых веществ использовали паклитаксел, XAV-939 и комбинацию XAV-939 и паклитаксела. Каждое вещество использовали в трех различных концентрациях – 10, 20 и 30 мкМ. Для каждой клеточной линии анализировали действие тестируемых веществ в трех описанных выше концентрациях в трех временных точках длительности инкубации – 24, 48 и 72 ч. От пациентки было получено письменное согласие на передачу биологического материала. Проведение исследования было одобрено локальной этической комиссией ФГБУ «НМИЦ онкологии» Минздрава России.
Статистический анализ
Для определения нормальности распределения полученных данных использовали критерий Шапиро – Уилка. Для дальнейшего анализа данных использовали t-критерий Стьюдента – для определения различий между группами и показателей описательной статистики – среднее, ошибка среднего.
Результаты исследования и их обсуждение
В ходе данной работы была проведена оценка жизнеспособности клеток паспортизированной клеточной линии MBA-MB-453 при воздействии паклитакселом, XAV-939 и комбинацией данных веществ в концентрации 10, 20 и 30 мкМ в течение 24, 48 и 72 ч. Данные о среднем и ошибке среднего в группах представлены в процентах от контроля, который был принят за 100 %, и отображены в табл. 1.
Таблица 1
Влияние паклитаксела, XAV-939 и комбинации паклитаксела с XAV-939 при концентрациях веществ 10, 20, 30 мкМ и культивировании в течение 24, 48 и 72 ч на жизнеспособность клеток MBA-MB-453
|
24 ч |
||||
|
10 мкМ |
20 мкМ |
30 мкМ |
||
|
Паклитаксел |
Среднее (%) |
93,68 |
93,78 |
88,60 |
|
Ошибка среднего |
3,63 |
4,58 |
5,44 |
|
|
XAV-939 |
Среднее (%) |
93,05 |
89,23 |
87,28 |
|
Ошибка среднего |
4,55 |
6,30 |
5,79 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
91,39 |
89,76 |
88,28 |
|
Ошибка среднего |
5,49 |
5,91 |
7,78 |
|
|
48 ч |
||||
|
Паклитаксел |
Среднее (%) |
76,19 |
66,41 |
61,80 |
|
Ошибка среднего |
4,32 |
1,46 |
2,05 |
|
|
XAV-939 |
Среднее (%) |
93,39 |
88,49 |
85,77 |
|
Ошибка среднего |
3,14 |
5,50 |
7,11 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
73,97 |
62,31 |
51,34 |
|
Ошибка среднего |
3,27 |
2,09 |
4,82 |
|
|
72 ч |
||||
|
Паклитаксел |
Среднее (%) |
72,80 |
52,99 |
46,49 |
|
Ошибка среднего |
3,10 |
2,02 |
1,95 |
|
|
XAV-939 |
Среднее (%) |
95,44 |
91,84 |
90,03 |
|
Ошибка среднего |
4,65 |
5,50 |
4,64 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
45,76 |
34,53 |
28,80 |
|
Ошибка среднего |
1,75 |
1,98 |
2,62 |
|
При анализе данных о воздействии тестируемых веществ на клетки линии MDA-MB-453 в трех исследуемых концентрациях при культивировании в течение 24 ч статистических различий между экспериментальными группами и контролем выявлено не было.
При анализе данных о воздействии паклитаксела, XAV-939 и комбинации тестируемых веществ на клетки линии MDA-MB-453 в трех исследуемых концентрациях при культивировании 48 ч выявили статистические различия между группами с введением паклитаксела и комбинации паклитаксела с XAV-939 при сравнении с контролем в трех исследуемых концентрациях. Данные о жизнеспособности клеток MDA-MB-453 при воздействии тестируемыми веществами в концентрациях 10, 20 и 30 мкМ при культивировании в течение 48 ч представлены на рис. 1.
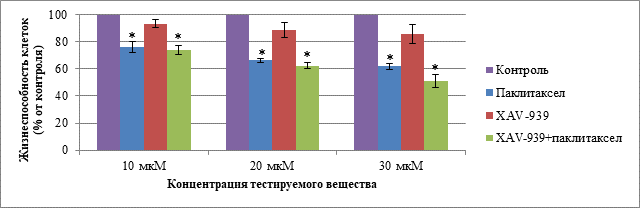
Рис. 1. Жизнеспособность клеток MDA-MB-453 в группах: «Паклитаксел», «XAV-939», «XAV-939 + паклитаксел» при концентрации веществ 10, 20 и 30 мкМ и культивировании в течение 48 ч.
Примечание. Данные представлены в виде среднего, планки погрешности отображают ошибку среднего; * – статистически значимые различия по t-критерию Стьюдента (p < 0,05)
Согласно данным, полученным при воздействии паклитаксела, XAV-939 и комбинации данных веществ на клетки линии MDA-MB-453 в концентрациях 10, 20 и 30 мкМ при культивировании в течение 72 ч, значимые отличия при сравнении с контролем были установлены для групп с введением паклитаксела и комбинации паклитаксела с XAV-939 во всех исследуемых концентрациях. Данные о жизнеспособности клеток MDA-MB-453 при воздействии тестируемыми веществами в концентрациях 10, 20 и 30 мкМ при культивировании в течение 72 ч представлены на рис. 2.
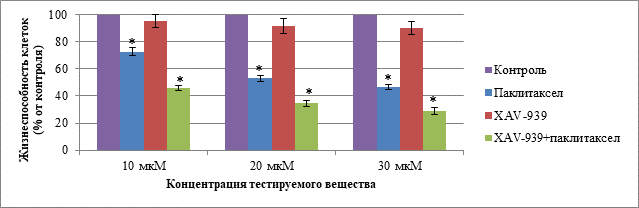
Рис. 2. Жизнеспособность клеток MDA-MB-453 в группах: «Паклитаксел», «XAV-939», «XAV-939 + паклитаксел» при концентрации веществ 10, 20 и 30 мкМ и культивировании в течение 72 ч.
Примечание. Данные представлены в виде среднего, планки погрешности отображают ошибку среднего; * – статистически значимые различия по t-критерию Стьюдента (p < 0,05).
В ходе работы была проведена оценка жизнеспособности клеток первичной линии клеток, полученных от пациентки, на базе лаборатории клеточных технологий ФГБУ «НМИЦ онкологии» Минздрава России, при воздействии паклитакселом, XAV-939 и комбинацией данных веществ в концентрации 10, 20 и 30 мкМ в течение 24, 48 и 72 ч. Данные о среднем и ошибке среднего в группах представлены в процентах от контроля, который был принят за 100 %, и отображены в табл. 2.
Таблица 2
Влияние паклитаксела, XAV-939 и комбинации паклитаксела с XAV-939 при концентрациях веществ 10, 20, 30 мкМ и культивировании в течение 24, 48 и 72 ч на жизнеспособность клеток первичной линии ТНРМЖ
|
24 ч |
||||
|
10 мкМ |
20 мкМ |
30 мкМ |
||
|
Паклитаксел |
Среднее (%) |
88,90 |
86,38 |
84,74 |
|
Ошибка среднего |
7,30 |
7,02 |
7,34 |
|
|
XAV-939 |
Среднее (%) |
87,36 |
90,49 |
84,69 |
|
Ошибка среднего |
5,93 |
5,46 |
6,96 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
83,82 |
85,41 |
83,75 |
|
Ошибка среднего |
7,78 |
7,75 |
9,79 |
|
|
48 ч |
||||
|
Паклитаксел |
Среднее (%) |
83,77 |
66,63 |
60,58 |
|
Ошибка среднего |
8,78 |
5,61 |
4,23 |
|
|
XAV-939 |
Среднее (%) |
94,26 |
86,86 |
83,37 |
|
Ошибка среднего |
4,18 |
6,10 |
9,73 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
67,68 |
55,04 |
46,41 |
|
Ошибка среднего |
3,49 |
3,09 |
3,06 |
|
|
72 ч |
||||
|
Паклитаксел |
Среднее (%) |
63,02 |
56,44 |
49,61 |
|
Ошибка среднего |
4,19 |
2,12 |
2,72 |
|
|
XAV-939 |
Среднее (%) |
92,48 |
93,03 |
88,87 |
|
Ошибка среднего |
4,79 |
5,46 |
5,49 |
|
|
XAV-939 + паклитаксел |
Среднее (%) |
40,51 |
37,95 |
26,59 |
|
Ошибка среднего |
3,52 |
4,06 |
2,68 |
|
Согласно данным о воздействии тестируемых веществ на клетки первичной линии ТНРМЖ в трех исследуемых концентрациях – 10, 20, 30 мкМ – при культивировании в течение 24 ч статистических различий между экспериментальными группами и контролем выявлено не было.
При культивировании первичной клеточной линии ТНРМЖ в течение 48 ч с тестируемыми веществами было выявлено значимое отличие от контроля в группе с введением паклитаксела при концентрациях 20 и 30 мкМ. При сравнении с контролем группы с комбинацией паклитаксела и XAV-939 значимое отличие было выявлено во всех трех концентрациях. В группе с монотерапией XAV-939 значимых отличий выявлено не было. Данные о жизнеспособности клеток первичной линии ТНРМЖ при воздействии тестируемыми веществами в концентрациях 10, 20 и 30 мкМ при культивировании в течение 48 ч представлены на рис. 3.
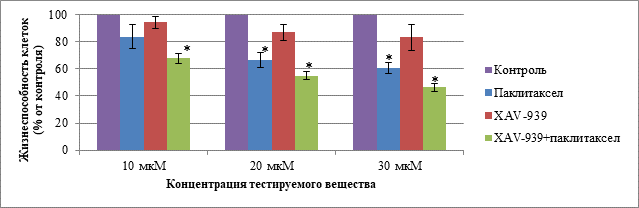
Рис. 3. Жизнеспособность клеток первичной линии ТНРМЖ в группах: «Паклитаксел», «XAV-939», «XAV-939 + паклитаксел» при концентрации веществ 10, 20 и 30 мкМ и культивировании в течение 48 ч.
Примечание. Данные представлены в виде среднего, планки погрешности отображают ошибку среднего; * – статистически значимые различия по t-критерию Стьюдента (p < 0,05)
В соответствии с данными о воздействии паклитаксела, XAV-939 и комбинации данных веществ на клетки первичной линии ТНРМЖ в концентрациях 10, 20 и 30 мкМ при культивировании в течение 72 ч были выявлены статистические различия между группами с введением паклитаксела и комбинации паклитаксела с XAV-939 при сравнении с контролем во всех исследуемых концентрациях. Данные о жизнеспособности клеток первичной линии ТНРМЖ при воздействии тестируемыми веществами в концентрациях 10, 20 и 30 мкМ при культивировании в течение 72 ч представлены на рис. 4.
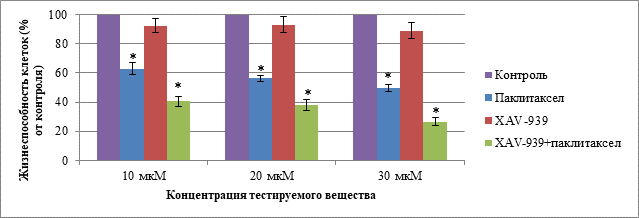
Рис. 4. Жизнеспособность клеток первичной линии ТНРМЖ в группах: «Паклитаксел», «XAV-939», «XAV-939 + паклитаксел» при концентрации веществ 10, 20 и 30 мкМ и культивировании в течение 72 ч.
Примечание. Данные представлены в виде среднего, планки погрешности отображают ошибку среднего; * – статистически значимые различия по t-критерию Стьюдента (p < 0,05)
В результате проведенной работы было выявлено отсутствие противоопухолевого эффекта XAV-939 в отношении паспортизированной клеточной линии MDA-MB-453 и первичной клеточной линии ТНРМЖ. Однако при комбинировании данного препарата со стандартной терапией в виде паклитаксела было выявлено значимое усиление эффективности данного препарата в отношении обеих клеточных линий при трех различных концентрациях препаратов (10, 20, 30 мкМ). Согласно многим международным исследованиям доказано, что сигнальный путь Wnt влияет на эмбриональное развитие и гомеостаз тканей, однако нарушение регуляции передачи сигналов оказывает значительное влияние на формирование многих типов рака, в том числе РМЖ, что обуславливает необходимость поиска способов ингибирования данного сигнального пути [9, 11]. Согласно исследованию команды ученых Чжан Л.Н. Хуан И-Х. и Чжао Л. (2019) XAV-939 оказывал ингибирующее действие на способность к пролиферации, миграции и инвазии многоядерных макрофагов ввиду торможения реакций сигнального пути Wnt/β-катенин [12]. В исследовании Сюэцинь Т. с коллегами (2021) проводилось изучение влияния субъединицы бета А ингибина (INHBA) в отношении развития РМЖ. В данной работе было определено действие сверхэкспрессируемого INHBA как онкогена при РМЖ, однако использование XAV-939 как ингибитора пути Wnt/β-катенина снижало стимулирующий эффект INHBA на пролиферацию, миграцию и инвазию клеток РМЖ [13]. Согласно исследованию команды ученых во главе с Хуан Ш-М.А. (2009) воздействие на опухолевые клетки исключительно XAV-939 не способствует эффективному ингибированию роста и метастазирования клеток РМЖ, ввиду чего необходимо применение новой стратегии лечения, например комбинирования ингибитора Wnt-пути со стандартной терапией [14]. Нашей командой на базе ИЛЦ ФГБУ «НМИЦ онкологии» Минздрава России было проведено исследование влияния XAV-939 в отношении колоректального рака человека на гетеротопической модели in vivo. В этом исследовании было выявлено наличие противоопухолевого эффекта в отношении подкожных ксенографтов исключительно при применении комбинации XAV-939 с 5-фторурацилом [15]. В соответствии с проанализированными литературными и экспериментальными данными необходимо дальнейшее изучение свойств XAV-939 как ингибитора Wnt пути на различных опухолевых моделях с исследованием его молекулярных свойств в отношении клеток РМЖ, а также влияния комбинации данного вещества с препаратами стандартной терапии на опухолевые модели.
Заключение
В заключение можно отметить, что XAV-939 в монотерапии не выявил противоопухолевой активности, однако при комбинации со стандартной терапией ввиде паклитаксела отмечали более выраженный противоопухолевый эффект чем при монотерапии стандартным препаратом во всех исследуемых концентрациях при культивировании с препаратами в течение 48 и 72 ч. Полученные данные обуславливают необходимость дальнейшего исследования комбинации данных препаратов в отношении опухолевых клеток молочной железы.



