Использование в современной эстетической медицине филлеров связано с реализацией стимуляции эффекта митотической активности фибробластов дермы с последующей активацией в них процесса неоколлагеногенеза [1, 2]. Оценка степени активации фибробластов может проводиться визуально по характеру аугментации дермы in situ, а также по объему коллагенпродуцируемого этими клетками экстрацеллюлярного матрикса с установлением для него продолжительности сохранения такого эффекта [3, 4].
В основе механизма реакции дермы на имплант обычно лежит последовательность таких фаз воспалительной реакции, как альтерация и гомеостаз, воспаление, пролиферация и ремоделирование [5, 6, 7]. Характер течения этих фаз определяется композицией биоматериала, типом полимера, его структурной организацией, размером формируемых микросфер и массой вводимого филлера [8].
Для оценки характера реконструкции экстрацеллюлярного матрикса под влиянием имплантов представляется интересным сравнительное изучение темпа синтеза коллагена в условиях нахождения в дерме каждого из трех филлеров, изготовленных на основе полимолочной кислоты: AestheFill (Южная Корея), Gana V (Южная Корея) и Repart (Россия), выбранных для исследования в качестве представляющих наибольший интерес для врачей-косметологов. Поскольку наиболее важным компонентом экстрацеллюлярного матрикса, синтезируемого в условиях введения филлера, является коллаген, а темп его синтеза определяется фазой регенерации, то изучение объема синтезируемого коллагена будет логически сопоставлено со сроком пребывания импланта в дерме.
Критической детерминантой, определяющей исход реакции дермы на имплант, являются выделяющиеся в фазу альтерации белки, которые абсорбируются имплантом с включением динамического феномена белковой адсорбции, ответная реакция определяется как эффект Roman [9]. Эти белки индуцируют формирование провизорного матрикса, в зоне которого поддерживается градиент для клеток нейтрофилов и макрофагов, а они приступают к выработке хемокинов, ферментов и цитокинов [10, 11]. Макрофаги продуцируют сигнальные молекулы, которые привлекают в зону локализации филлера фибробласты с выработкой ими коллагена внутри и вокруг импланта, а это меняет не только форму импланта, но и его функции и сигнальные возможности.
Цель исследования: сравнительная оценка объема синтезированного клетками фибробластами коллагена с выявлением зон его локализации в дерме и в импланте в зависимости от типа филлера и сроков пребывания импланта в дерме.
Материал и методы исследования
Объектом исследования послужили крысы самцы зрелого возраста массой 200–250 г (30 особей), полученные из питомника ПЛЖ «Рапполово» Ленинградской области. При проведении экспериментов соблюдали этические нормы и рекомендации по гуманному отношению к лабораторным животным в соответствии с Директивой европейского парламента и Союза 201/63/ЕС от 22 сентября 2010 года о защите животных, использующихся для научных целей, с Федеральным законом от 27.12.2018 № 498-Ф3 (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации». Содержание и дизайн исследований согласованы с Независимым этическим комитетом ФГБОУ ВО КубГМУ Минздрава России (протокол № 54 от 11.10.2017 г.). Экспериментальные животные были разделены на четыре группы. Группе 1 (9 особей) вводили препарат AestheFill (Южная Корея), группе 2 (9 особей) вводили препарат Gana V (Южная Корея), а группе 3 (9 особей) – препарат Repart (Россия). Контрольной группе (3 особи) вводили стерильный физиологический раствор. Препараты вводили субдермально в область холки в объеме 0,05 мл всем животным одновременно.
Забор материала для гистологического исследования дермы из зоны введения импланта проводился в различные сроки: 2, 4, 8, 16 и 24 недели после инъекции. Проводку и заливку материала выполняли в процессорах фирмы Tissue-Tek VIP5Jr. (Япония). Из парафиновых блоков изготавливали срезы толщиной 4–5 микрон с использованием ротационного микротома НM 340 Е (MICROM Laborgerate GmbH, Германия). Срезы окрашивали по Маллори в автоматическом мультистейнере Tissue-Tek Prisma, (Япония). Иммуногистохимическое выявление коллагена было проведено согласно протоколу производителя с использованием антител Anti-Collagen I, Anti-Collagen III. Окрашивание производили в иммуногистостейнере BenchMark XT. Для завершения окрашивания осуществляли фоновое контрастирование срезов Hematoxylin II (Roshe, Швейцария). С целью контроля окраски использовали эталоны позитивных и негативных образцов. Полученные микропрепараты подвергали визуальному исследованию в окрасках гематоксилином и эозином и по Маллори. Для получения количественных результатов применяли компьютерную морфометрию с использованием стандартизированных микрофотографий, окрашенных по Маллори в формате JPEG. Фотографирование осуществляли цифровой микрофотокамерой DCM 310 2 и микроскопа Laboval 2 производства Carl Zeiss при увеличении ×400. Общая площадь каждой микрофотографии составила 3,15 мегапикселей2. Анализ полученных изображений проводили в компьютерной программе ImageJ. Результаты измерений площади окрашенного продукта гистохимической реакции, соответствующей содержанию коллагена в зоне локализации импланта, выражали в мегапикселях2. Статистический анализ результатов исследования выполнен с применением компьютерной программы Statistica 13 Trial. Проверку характера распределения вариационных рядов производили с помощью критерия Пирсона. Во всех исследованных вариационных рядах значения As и Ex мало отличались от нуля, поэтому можно было констатировать, что распределение показателей является нормальным. Учитывая близость распределений значений к нормальному, дополнительно проводили сравнение средних величин по Стьюденту. Влияние фактора на различие значений показателей проводили с помощью однофакторного (фактор-препараты) дисперсионного анализа (по критерию Фишера р<0,001). Нулевую гипотезу отвергали при уровне статистической значимости p<0,05.
Результаты исследования и их обсуждение
Визуальная оценка темпа синтеза коллагена в препаратах, окрашенных по Маллори, показала, что начальный этап его синтеза приурочен к первой неделе введения филлера AestheFil и связан с формированием вокруг импланта капсулы. Внутри импланта выявляются коллагеновые фибриллы, а вне его коллагеновые волокна как показатель завершения фибриллогенеза формируют капсулу, изолирующую имплант от дермы хозяина (рис. 1).
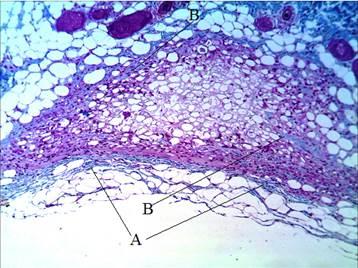
Рис.1. Распределение коллагена в зоне импланта через 1 неделю после введения филлера AestheFill. Окраска по Маллори. А – капсула вокруг импланта, В – коллагеновые фибриллы внутри импланта. Ув. х100
Ко второй неделе пребывания филлера в дерме процесс неоколлагеногенеза нарастает и смещается в сторону импланта. При введении филлера AestheFill (группа 1) наблюдается увеличение содержания коллагена вокруг импланта и в самом импланте (рис. 2).
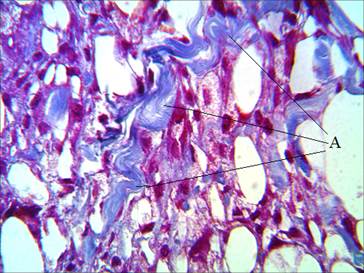
Рис. 2. Распределение коллагена в зоне импланта через 2 недели после введения филлера AestheFill. Окраска по Маллори. А – коллагеновые волокна. Ув. х600
При введении филлера Gana (группа 2) увеличение неоколлагеногенеза прослеживается в основном вокруг импланта, последний представляется достаточно плотным, фибробласты на таких участках слабо пролиферируют и не обнаруживают эффекта неоколлагеногенеза (рис. 3), а имплант мигрирует за пределы зоны дермы. Такой же эффект погружения прослеживается к концу 2-й недели и в зоне инъекции Repart (группа 3). Неоколлагеногенез смещается к периферии импланта, в самом импланте процесс затухает (рис. 4).
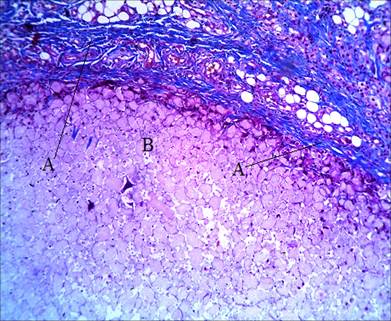
Рис. 3 Распределение коллагена в зоне импланта через 1 неделю после введения филлера Gana Окраска по Маллори. А – капсула вокруг импланта; В – имплант. Ув. х100
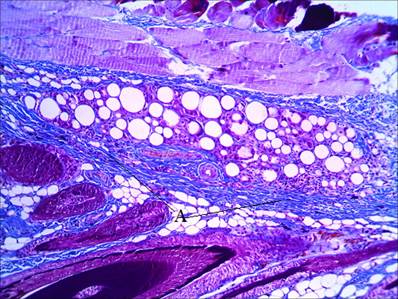
Рис. 4. Распределение коллагена в зоне импланта через 1 неделю после введения филлера Repart. Окраска по Маллори. А – капсула вокруг импланта.) Ув. х100
Пролонгирование времени пребывания импланта в дерме в срок до 1 месяца при введении AestheFill приводит к снижению объема импланта, но не к увеличению объема синтеза коллагена внутри. Для этого филлера характерно увеличение числа клеток и в зоне экстрацеллюлярного матрикса, что указывает на пролонгирование периода формирования грануляционной ткани (рис. 5).
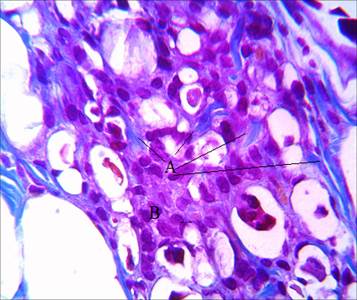
Рис. 5. Распределение коллагена в зоне импланта через 1 месяц после введения филлера. Окраска по Маллори. А – коллагеновые волокна. В – клетки экстрацеллюлярного матрикса. Ув. х600
После четырехмесячного пребывания филлеров в дерме микросферы сохраняются в виде фрагментов. Так, фрагменты филлера AestheFill смещаются на границу с подкожно-жировой клетчаткой, сохраняя единичные микросферы, окруженные коллагеновыми волокнами и обширным клеточным инфильтратом (рис. 6). В срок, соответствующий шести месяцам, морфологических изменений не наблюдается.
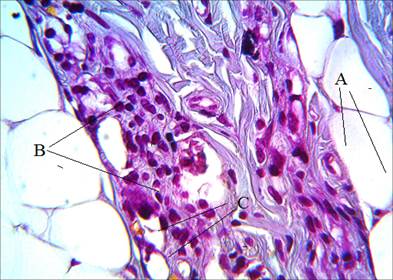
Рис. 6. Распределение коллагена в зоне импланта через 4 месяца после введения филлера AestheFill. Окраска по Маллори. А – подкожно-жировая клетчатка, B – клеточный инфильтрат, С – фрагменты филера. Ув. х600
При введении Gana в эти же сроки микросферы сохраняются, вокруг микросфер видны многоядерные клетки, формирующие структуры, напоминающие «полулуния», содержимое микросфер становится менее плотным. В зоне экстрацеллюлярного матрикса много клеток округлой формы с базофильной цитоплазмой. Спустя 4 месяца вокруг филлера Gana сохраняется плотная капсула (рис. 7), а к шести месяцам зона бывшего импланта оценивается лишь по высокому уровню содержания коллагена в дерме над ним. На поверхности единичных микросфер типируются многоядерные клетки.
Компьютерная морфометрия коллагена как одного из показателей перестройки экстрацеллюлярного матрикса показала, что в первую неделю пребывания филлера в дерме наиболее активный неоколлагеногенез характерен для Gana (2,12+0,1 мегапикселей2), во вторую неделю – для Repart (2,2+0,05 мегапикселей2), а для срока 1 месяц – AestheFill (2,3+0,08 мегапикселей2). Эти различия темпа синтеза коллагена нивелируются к сроку, соответствующему четвертому месяцу, где темп синтеза максимальный для всех видов филлеров.
При этом объем синтезированного коллагена заметно не снижается в процессе пролонгирования времени пребывания филлеров AestheFill и Repart до 6 месяцев. Не исключено, что сохранение объема коллагена в срок до шести месяцев пребывания филлеров в дерме соответствует периоду завершения ее ремоделирования (рис. 8).
При иммуногистохимическом типировании коллагенов оказалось, что дерма над имплантом реагирует на филлеры увеличением числа фибробластов, для которых характерна высокая экспрессия проколлагена. Клетки крупные, многоотростчатые, с большой территорией экзоцитоза. В зоне локализации импланта участки неоколлагеногенеза определяются типом филлера. Так, в случае AestheFill процесс активируется с первой недели его введения и проявляется локализацией коллагенов вокруг микросфер в соотношении коллагенов I и III типов 1:1. Коллаген I типа выявляется и в зоне экстрацеллюлярного матрикса.
В случае введения филлера Gana наличие коллагена регистрируется первоначально в зоне самого импланта по краю многочисленных микросфер, где присутствуют уплощенные клетки, экстрацеллюлярный матрикс обнаруживает реакцию умеренной интенсивности и местами представляется вакуолизированным. Относительно коллагена III типа наиболее высокий темп его синтеза характерен уже к первым неделям эксперимента, и в зоне импланта типируются уплощенные клетки в составе стенок микросфер.
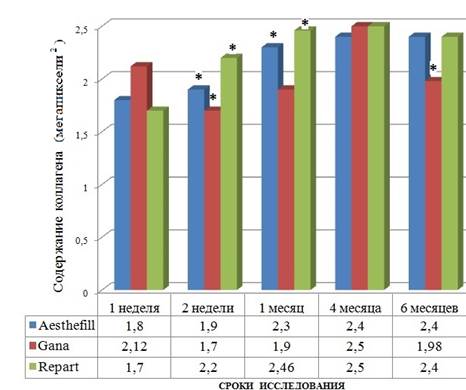
Рис. 8. Содержание коллагена в разные сроки после введения филлера.
· – достоверность отличия от предыдущего срока исследования, p<0,01
При введении филлера Repart в первые недели проколлаген типируется в составе многочисленных фибробластов, обнаруживая высокий темп экспрессии прoколлагена. Имплант в этом случае представлен в виде вакуолей различного диаметра, стенки этих вакуолей (микросфер) ограничены клетками, экспрессирующими коллаген I типа. Ассоциируя между собой, клетки формируют широкопетлистую сеть в зоне экстрацеллюлярного матрикса. При выявлении коллагена III типа его много в составе фибробластов, формирующих капсулу, при этом клетки имеют вид «клякс». С пролонгированием срока пребывания импланта в дерме реакцию на коллаген III типа сохраняют отдельные уплощенные клетки, включенные в зону экстрацеллюлярного матрикса.
Заключение
Таким образом, проведенное изучение трех различных филлеров, изготовленных на основе полимолочной кислоты, позволило выявить общие закономерности ответной реакции дермы на имплант в аспекте неоколлагеногенеза, показателем которой можно считать объем синтезируемого коллагена по результатам, полученным в условиях компьютерной морфометрии.
Показано, что для каждого филлера характерен вектор увеличения неоколлагеногенеза в срок от 1 недели до 4 месяцев с небольшими колебаниями. В период, соответствующий шестому месяцу, на фоне процесса продолжающегося ремоделирования дермы начинается падение объема синтеза коллагена. Морфометрические исследования свидетельствуют, что первая неделя характеризуется увеличением объема синтеза коллагена в случае использования филлера Gana, на второй неделе лидирует Repart. К четвертому месяцу различия между филлерами нивелируются, и темп продукции коллагена определяется как максимальный. К шестому месяцу пребывания имплантов в дерме имеют место стабилизация (или прекращение) эффекта биосинтеза коллагена в случае имплантации филлеров AestheFill и Repart и явное снижение активации фибробластов на участке с локализацией филлера Gana.
Полученные данные свидетельствуют, что первая ответная реакция дермы на имплант из полимолочной кислоты связана с увеличением объема дермы по типу его локальной гидратации с изменением ее физического статуса. Позже подключается процесс биоразложения микросфер с увеличением числа фибробластов и активации ими синтеза коллагена.



