Рак печени является четвертым по летальности онкологическим заболеванием в мире, а гепатоцеллюлярная карцинома (ГЦК) составляет 75–85% случаев рака печени [1]. В 2018 году смертность от ГЦК составила 782 000 случаев в мире, несмотря на появление многих современных методов диагностики и лечения, что составляет около 3,5% всех смертей в мире [2, 3]. В России показатель смертности составляет около 9 800 случаев в год [4]. Помимо высокой смертности, прогноз и лечение ГЦК неоптимальны, у большинства пациентов злокачественное новообразование прогрессирует в течение года после постановки диагноза [1].
В значительной мере высокая летальность обусловлена не только поздней диагностикой и распространенностью процесса, но и развивающейся, как правило, гепатоцеллюлярной недостаточностью. В России и за рубежом опубликовано значительное количество фундаментальных исследований, посвященных определенным аспектам функциональных состояний печени при различных заболеваниях [5].
Однако научные достижения последних 10–20 лет могут позволить по-новому взглянуть на функции печени при онкологической патологии. В практике врачебной деятельности важнейшее значение приобретают многофакторные методы оценки функции печени на основании клинических, биохимических, морфологических и аппаратно-инструментальных данных. Большое, иногда определяющее, значение эта информация приобретает в онкологии, поскольку ряд злокачественных новообразований печени: гепатоцеллюлярный рак, холангиокарциномы, опухоли желчевыводящих протоков, а также коморбидные заболевания – изменяют как морфологическую структуру, так и ее функции. Кроме того, печень нередко подвергается побочным токсическим влияниям целого ряда химиотерапевтических, системных и таргетных препаратов, широко применяемых в онкологии [6].
Развитие гепатотоксичности имеет место у 10–50% онкологических больных. В этих условиях особое значение приобретают методы клинической оценки функции печени, основанные на биохимических показателях (аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АлТ), щелочная фосфатаза (ЩФ), гамма-глутамилтрансфераза, общий билирубин, альбумин) [7].
Однако все большую ценность приобретают не их изолированные изменения, а интегральные показатели – индексы. В литературе известны более 20 индексов: индекс соотношения аспартатаминотрансферазы и тромбоцитов (APRI) [8]; система подсчета FIB-4 – комбинация возраста пациента, количества тромбоцитов, АСТ и АлТ [9]; индекс ALBI, рассчитываемый на основании уровня альбумина и общего билирубина плазмы крови [10]; показатель R – отношение активности АлТ (кратность к верхнему пределу нормы (ВПН)) к ЩФ (кратность к ВПН), в том числе его повторная оценка в процессе наблюдения за больным, и др. [11].
Вместе с тем, очевидно, что функциональное состояние печени регулируется на генетическом и транскриптомном уровнях [1]. При этом регуляция функций печени на молекулярном уровне недостаточно изучена, имеются лишь отдельные работы, посвященные этой проблеме [12].
Известно, что пациенты с ГЦК и неалкогольной жировой болезнью печени (НАЖБП, жировым гепатозом) имеют различные генетические профили, и эти различия могут быть применены для раннего скрининга и прогнозирования течения заболевания, оценки функционального состояния печени. Огромный потенциал в этом направлении имеет определение таких показателей, как копийность генов (CNV) и уровень транскриптов микроРНК в плазме крови больных ГЦК и НАЖБП, для дифференциальной диагностики этих двух патологий. Также важно провести ассоциативный и корреляционный анализ уровня стандартных биохимических и молекулярных маркеров.
Copy number variation (CNV) представляет собой особый тип вариабельности генетической информации, отражающий дозу гена (число его копий) и опосредованно влияющий на его транскрипционную активность [13, 14]. Уровень CNV можно определять во внеклеточной ДНК (внДНК), циркулирующей в плазме крови [15]. Также показателем, доступным для определения в плазме крови, является уровень транскриптов микроРНК. МикроРНК – это короткие некодирующие РНК, которые регулируют экспрессию генов, катализируя разрушение мРНК либо ингибируя трансляцию мРНК в белок. МикроРНК вносят значительный вклад в инициацию и развитие различных молекулярных событий, включая онкогенез, прогрессирование и метастазирование опухолей, что делает микроРНК потенциальными биомаркерами [16].
Поэтому целью исследования стал скрининг генетических (CNV) и транскриптомных (микроРНК) маркеров – регуляторов функционального состояния печени у пациентов с гепатоцеллюлярной карциномой и жировым гепатозом.
Материалы и методы исследования
Работа выполнена в ФГБУ «НМИЦ онкологии» Минздрава России за период с 2020 по 2023 гг. Проанализированы данные комплексного клинического и молекулярного обследования 50 больных гепатоцеллюлярной карциномой (по Барселонской классификации «А», «B», «C», «D») и 30 больных неалкогольной жировой болезнью печени, а также 20 доноров без патологии (группа условно здоровых доноров).
Для получения внДНК использовали кровь, взятую путем венопункции у больных ГЦК, больных неалкогольной жировой болезнью печени и у доноров без патологии (группа условно здоровых доноров). Плазму крови отделяли центрифугированием (30 минут, 2000 об/мин, t=10°С). Из плазмы выделяли внДНК фенол-хлороформным методом в модификации Д.С. Кутилина и соавторов [17]. Оценку показателя относительной копийности генов проводили методом количественной ПЦР в режиме реального времени (RT-qPCR). Разработку последовательности синтетических олигонуклеотидов (праймеров) осуществляли с помощью Primer-BLAST и базы данных GenBank (NCBI). В качестве референсного гена для нормализации полученных показателей RT-qPCR был выбран GAPDH.
Реакция амплификации проводилась на термоциклере CFX96 (Bio-Rad, США) в 20 мкл смеси, содержащей матрицу внДНК (не менее 0,5 нг), 0,2 мМ раствор dNTP, 0,4 мкМ прямого и обратного праймеров, 2,5 мМ раствор MgCl2, 1X ПЦР-буфер с интеркалирующим красителем EvaGreen и 0,1 е.а./мкл SynTaq ДНК-полимеразы [17]. Амплификация осуществлялась по следующей программе: 95°C 3 минуты, 40 циклов: 95°C 10 секунд, 55°C 30 секунд (чтение оптического сигнала по каналу FAM) и 72°C 20 секунд.
Относительную копийность (rC) рассчитывали по формуле, описанной Д.С. Кутилиным [18]:
rC = rCо/rCн = E-ΔCt(образцов от больных)/E-ΔCt(образцов от условно здоровых),
где Е ‒ эффективность ПЦР-амплификации, рассчитанная по формуле E = 10-1/k (k ‒ коэффициент уравнения прямой C(T) = k•log P0 + b, полученной в ходе линейной аппроксимации данных экспериментальных постановок ПЦР) (усредненное значение Е=1,914), а ΔCt – разница между средним геометрическим Ct(гена-мишени) и средним геометрическим Ct(референсного гена) [18].
С помощью биоинформационного алгоритма TarPmiR определяли микроРНК, таргетирующие локусы GGTLC1, CYC1, LRRC24, AK4, ALB, GOT1, GPT1, GGT1 и ALPL.
Выделение микроРНК из образцов плазмы крови проводили с использованием набора miRNeasy Serum/Plasma Kit (Qiagen, Германия) на автоматической станции выделения Qiacube Connect (Qiagen, Германия) с учетом рекомендаций производителя.
Для выявления зрелых микроРНК и малой РНК U6 использовали метод, описанный I. Balcells и соавторами [19]. Выделенную суммарную РНК использовали в реакции обратной транскрипции, которую проводили одновременно с полиаденилированием РНК, с использованием специфичных RT-праймеров. Далее проводили детекцию полученной кДНК с помощью ПЦР в реальном времени (ПЦР-РВ). Дизайн специфичных олигонуклеотидных праймеров осуществляли также с использованием алгоритма I. Balcells и соавт. [19]. Для каждой микроРНК отдельно проводили реакцию обратной транскрипции в одном повторе.
Изменение относительной экспрессии микроРНК оценивали методом ПЦР-РВ. Амплификацию проводили в 20 мкл PCR-смеси, содержащей 1x PCR-буфер, 0,25 mМ dNTPs, 2 мM MgCl2, 1 ед.акт. Taq-DNA-полимеразы, по 500 нM прямого и обратного праймеров. Полученные смеси инкубировали в амплификаторе CFX 96 (Bio-Rad Laboratories, США).
Статистическую обработку результатов выполняли в программе Statistica 10.0 (StatSoft, США). Нормальность распределения показателей оценивали с помощью критерия Колмогорова–Смирнова. Оценку различий проводили с использованием критерия Манна–Уитни для порогового уровня статистической значимости р<0,05, для учета множественного сравнения использовали поправку Бонферрони. Для оценки взаимосвязи исследуемых показателей использовали коэффициент корреляции Пирсона (r).
Результаты исследования и их обсуждение
На рисунке 1 представлена сводная информация по клинически применяемым в настоящее время маркерам у группы пациентов и здоровых доноров, отобранных в наше исследование.
Как видно из представленных на рисунке 1 данных, у пациентов с ГЦК относительно здоровых доноров статистически значимо (p<0,005) повышена активность АЛТ, АСТ, ГГТ и щелочной фосфатазы, а также снижена концентрация альбумина.
Был проведен анализ показателя копийности генов АЛТ, АСТ, ГГТ, щелочной фосфатазы, альбумина и ассоциированных с ними генов в образцах внДНК у пациентов с ГЦК, больных неалкогольной жировой болезнью печени и у доноров без патологии. У больных ГЦК было обнаружено увеличение копийности гена GGT1 (Gamma-Glutamyltransferase 1) в 2,5 раза (p<0,005), GGTLC1 (Gamma-Glutamyltransferase Light Chain 1) в 3,0 раза (p<0,05), GOT1 в 1,5 раза (p<0,05) и снижение показателя копийности гена CYC1 (Cytochrome C1) в 4,4 раза (p<0,005) относительно этого показателя в плазме крови здоровых доноров. Копийность гена LRRC24 (Leucine Rich Repeat Containing 24) была повышена в 2,0 раза (p<0,005), гена AK4 (Adenylate Kinase 4) в 3,4 раза (p<0,05), GGT1 в 1,5 раза (p<0,005), GGTLC1 в 2,2 раза (p<0,05), ALPL в 2,6 раза (p<0,05) и снижена копийность CYC1 в 2,0 раза (p<0,05) у больных жировой болезнью печени относительно здоровых доноров
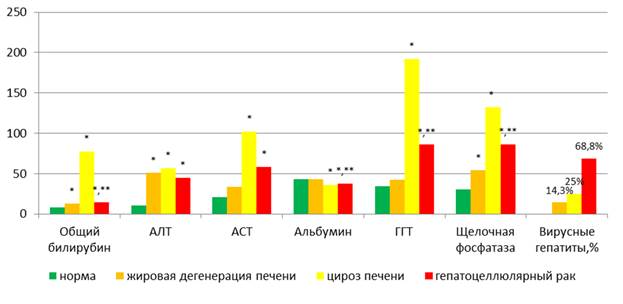
Рис. 1. Характеристика групп по биохимическим маркерам
* – статистически значимые отличия относительно условно здоровых доноров.
** – статистически значимые отличия между больными ГЦК и пациентами с неалкогольной жировой болезнью печени
Группы больных ГЦК и жировой болезнью печени отличались по копийности во внДНК 5 генов: копийность GOT1 (AST1) была выше у больных ГЦК в 1,9 раза (p<0,005), копийность AK4 была ниже у больных ГЦК в 2,1 раза (p<0,0005), копийность GGT1 была выше у больных ГЦК в 1,6 раза (p<0,05), копийность GGTLC1 была выше у больных ГЦК в 1,4 раза (p<0,05), копийность CYC1 была ниже у больных ГЦК в 2,2 раза (p<0,005) и копийность гена ALPL была ниже у больных ГЦК в 2,1 раза (p<0,005) (рис. 2).
Ген ALB кодирует самый распространенный белок в крови человека – альбумин. Этот белок участвует в регуляции коллоидно-осмотического давления плазмы крови и действует как белок-носитель для широкого спектра эндогенных молекул, включая гормоны, жирные кислоты и билирубин, а также экзогенные лекарственные средства. Кроме того, этот белок проявляет эстеразоподобную активность с широкой субстратной специфичностью.
Кодируемый препропротеин подвергается протеолитической обработке с образованием зрелого белка. Пептид, полученный из этого белка, EPI-X4, является эндогенным ингибитором хемокинового рецептора CXCR4. Наибольший уровень экспрессии данного гена наблюдается в печени.
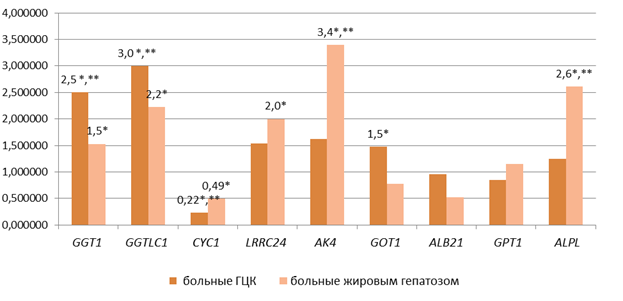
Рис. 2. Показатель копийности генов во внДНК пациентов с ГЦК и жировым гепатозом
Кодируемый препропротеин подвергается протеолитической обработке с образованием зрелого белка. Пептид, полученный из этого белка, EPI-X4, является эндогенным ингибитором хемокинового рецептора CXCR4. Наибольший уровень экспрессии данного гена наблюдается в печени. Ген ALB задействован в целом ряде клеточных сигнальных путей (Reactome pathways): метаболизм желчных кислот и желчных солей, регуляция уровня билирубина, транспорт липидов, метаболизм липопротеинов и трансмембранный транспорт малых молекул.
Ген GOT1 кодирует глутамин-оксалоуксусную трансаминазу 1 (аспартатаминотрансфераза, цитоплазматическая, АСТ), которая играет важную роль в метаболизме аминокислот, циклах мочевины и трикарбоновых кислот, участвует в синтезе глюкозы в печени.
Ген GGT1 кодирует фермент гамма-глутамилтрансферазу 1, который катализирует перенос глутамильной части глутатиона на множество аминокислот и акцепторов дипептидов. Он экспрессируется в тканях, участвующих в абсорбции и секреции, и может способствовать этиологии диабета и других нарушений обмена веществ.
Ген ALPL кодирует фермент щелочную фосфатазу, которая метаболизирует различные фосфатные соединения и играет ключевую роль в минерализации скелета и адаптивном термогенезе [20].
Ген GPT1 кодирует эндогенный фермент аланинаминотрансферазу (АЛТ, АлАт) из группы трансфераз, широко используемый в медицинской практике для лабораторной диагностики повреждений печени. Аланинаминотрансфераза синтезируется внутриклеточно, и в норме лишь небольшая часть этого фермента попадает в кровь. При повреждении печени (при гепатитах, циррозе печени) в результате цитолиза (разрушения клеток) этот фермент попадает в кровь, что выявляется лабораторными методами. Уровень этой трансаминазы может повышаться также при инфаркте миокарда и других состояниях [21].
Ген CYC1 кодирует белок Cytochrome C1 – компонент убихинол-цитохром с оксидоредуктазы, многосубъединичного трансмембранного комплекса, который является частью митохондриальной цепи переноса электронов, которая управляет окислительным фосфорилированием.
Ген AK4 кодирует фермент аденилат киназу (Adenylate Kinase 4), который участвует в поддержании гомеостаза клеточных нуклеотидов путем катализа взаимного превращения нуклеозидфосфатов, а также играет защитную роль в клеточном ответе на окислительный стресс.
Ген GGTLC1 кодирует легкую цепь гамма-глутамилтрансферазы 1 – представителя семейства гамма-глутамилтранспептидаз (ГГТ), которые играют важную роль в метаболизме глутатиона.
Межгенная сеть взаимодействий для локусов ALB, GOT1, GPT1, GGT1 и ALPL представлена на рисунке 3.
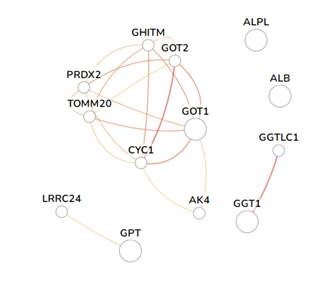
Рис. 3. Межгенная сеть взаимодействий для локусов ALB, GOT1, GPT1, GGT1 и ALPL. (Изображение получено при анализе открытых баз данных на языке R)
Гамма-глутамилтрансферазы (ГГТ) – ферменты, участвующие в обмене аминокислот. Катализируют перенос гамма-глутамилового остатка с гамма-глутамилового пептида на аминокислоту, другой пептид или, при гидролизе, на воду. Накапливается в основном в почках, печени и поджелудочной железе. В клетках локализуется в мембране, лизосомах и цитоплазме [22]. ГГТ преимущественно используется в качестве диагностического маркера заболеваний печени. Повышенная активность ГГТ в сыворотке может быть обнаружена при заболеваниях печени, желчевыводящих путей, поджелудочной железы и почек [23]. Гены GGT и GGTLC1 экспрессируются на высоких уровнях во многих различных опухолях. Известно, что они ускоряют рост опухоли и повышают устойчивость к цисплатину [24].
Ген LRRC24 кодирует трансмембранный белок, функция которого в настоящее время неизвестна. Он является членом суперсемейства белков с богатыми лейцином повторами (LRR). Было обнаружено, что LRRC24 взаимодействует с IGFBP7, известным регулятором инсулиноподобных факторов роста (IGF), который участвует в стимуляции клеточной адгезии. Также LRRC24 взаимодействует с GPT1 (рис. 3). На сегодняшний день ни одно исследование не связывало конкретно LRRC24 или ген LRRC24 с каким-либо клинически значимым случаем [25].
Для сопоставления клинических и молекулярно-генетических маркеров рассмотрим таблицу 1.
Таблица 1
Сопоставление биохимических показателей и молекулярно-генетические изменений у больных ГЦК и жировым гепатозом
|
Группа |
АЛТ |
АЛТCNV |
АСТ |
АСТCNV |
ГГТ |
ГГТCNV |
ЩФ |
ЩФCNV |
|
ГЦК
|
↑ |
– |
↑ |
↑ |
↑ |
↑ |
↑ |
– |
|
НАЖБП
|
↑ |
– |
– |
– |
– |
↑ |
↑ |
↑ |
«↑» – повышенные значения относительно нормы (контрольная группа)
«–» – нет изменений относительно нормы (контрольная группа)
АЛТCNV – показатель копийности гена АЛТ (GPT1), АСТCNV – показатель копийности гена АСТ (GOT1), ГГТCNV – показатель копийности гена ГГТ (GGT1), ЩФCNV – показатель копийности гена щелочной фосфатазы (ALPL)
Из представленных в таблице 1 и на рисунках 1 и 2 данных видно, что изменение активности фермента АЛТ не связано с изменением копийности его гена (r=0,086) у пациентов с ГЦК и НАЖБП. Изменение активности фермента АСТ у больных ГЦК ассоциировано с повышением копийности этого гена (r=0,757), при этом у пациентов с НАЖБП такой ассоциации не наблюдается (r=0,114). Изменение активности фермента ГГТ у больных ГЦК ассоциировано с повышением копийности этого гена (r=0,691), при этом у пациентов с НАЖБП такой ассоциации не наблюдается (r=–0,104). Изменение активности щелочной фосфатазы у больных ГЦК не ассоциировано с изменением копийности этого гена (r=–0,090), при этом у пациентов с НАЖБП наблюдается сильная положительная корреляция активности фермента и копийности его гена (r=0,904). В ходе исследования также не обнаружено положительной корреляции между концентрацией альбумина и копийностью его гена во внДНК пациентов. Хотя для пациентов с НАЖБП между концентрацией альбумина и копийностью гена ALB в тканях печени обнаружена положительная корреляция (r=0,574).
Также представляет интерес изучение одного из механизмов регуляции транскрипционной активности генов GGTLC1, CYC1, LRRC24, AK4, ALB, GOT1, GPT1, GGT1 и ALPL – изменение экспрессии микроРНК.
С помощью модифицированного биоинформационного алгоритма TarPmiR было определено 4643 микроРНК, таргетирующих локусы GGTLC1, CYC1, LRRC24, AK4, ALB, GOT1, GPT1, GGT1 и ALPL. Из этих микроРНК только 588 были валидированы в базе данных miRDB, в том числе 413 микроРНК, образующих наиболее прочные комплексы с соответствующими генами-мишенями (минимальная свободная энергией взаимодействия в паре микроРНК-мРНК): 30 микроРНК для гена ALB, 66 микроРНК для AK4, 12 микроРНК для ALPL, 2 микроРНК для CYC1, 35 микроРНК для гена GGT1, 47 микроРНК для гена GGTLC1, 133 микроРНК для гена GOT1, 83 микроРНК для гена GPT и 5 микроРНК для гена LRRC24 (табл. 2).
Таблица 2
Данные по микроРНК-мРНК взаимодействию, полученные с использованием алгоритма TarPmiR
|
микроРНК |
Ген |
Участок взаимодействия |
энергия связи |
|
|
1 |
hsa-miR-3180 |
ALB |
TGGGGCGGAGCTTCCGGAG#CTGTGGAAGTTCCAGTGTTCTC#.(((((((((((((((.((#)).))))))))))...))))). |
-21.0 |
|
2 |
hsa-miR-4429 |
ALB |
AAAAGCTGGGCTGAGAGGCG#GCATCTCAGCCTACCA#....(.((((((((((.((.#)).)))))))))).). |
-21.0 |
|
3 |
hsa-miR-5004-3p |
ALB |
CTTGGATTTTCCTGGGCCTCAG#CTGTAGGTTCTGTGGAAGTTCCAGT#.(((((.(((((.(((((((((#))).))))))...))))).))))). |
-21.0 |
|
4 |
hsa-miR-330-3p |
ALB |
GCAAAGCACACGGCCTGCAGAGA#TTCTGTAGGTTCTGTGG#......((((.(((((((((((.#))))))))))).)))). |
-21.2 |
|
... |
hsa-miR-1251-5p |
AK4 |
ACTCTAGCTGCCAAAGGCGCT#TGCCTTTGGAGTTTGGGAGA#.((((((((.(((((((((..#)))))))))))))..)))). |
-21.0 |
|
32 |
hsa-miR-4724-5p |
AK4 |
AACTGAACCAGGAGTGAGCTTCG#GCCCTCCTGGTAACAGTG#.((((.((((((((.(.((....#)))))))))))..)))). |
-21.0 |
|
33 |
hsa-miR-6833-5p |
AK4 |
GTGTGGAAGATGGGAGGAGAAA#TTCTCCCCATCCCCACAA#.(((((..(((((..((((((.#))))))))))).))))). |
-21.1 |
|
34 |
hsa-miR-509-3-5p |
AK4 |
TACTGCAGACGTGGCAATCATG#ATGGAGCTAGTCCATGTCTGTAGTC#.(((((((((((((........#.))))))))))))). |
-21.2 |
|
35 |
hsa-miR-34a-5p |
AK4 |
TGGCAGTGTCTTAGCTGGTTGT#CCAGCTAAATGGACAATTCTAGCCAA#((((((((((((((((((....#)))))))...)))))...)).)))). |
-21.2 |
|
36 |
hsa-miR-7110-3p |
AK4 |
TCTCTCTCCCACTTCCCTGCAG#GTAGGGAAGGAGAAAGGT#(((.(((((...((((((((..#))))))))))))).))). |
-21.4 |
|
37 |
hsa-miR-6873-5p |
AK4 |
CAGAGGGAATACAGAGGGCAAT#GCTTTCTGGTGTGTGCCCTCCTGG#(((((((.(((((((((((...#)))))))).)))...))))).)). |
-21.4 |
|
38 |
hsa-miR-1185-2-3p |
AK4 |
ATATACAGGGGGAGACTCTCAT#GGGAGTTCCCCAATTTGATCATTTTTGTGTGTG#(((((((((((((.((((((..#))))))))))).............)))))))). |
-21.5 |
|
39 |
hsa-miR-371b-5p |
AK4 |
ACTCAAAAGATGGCGGCACTTT#AAAGTGCTGCTAACTATTGAT#..((((.((.((((((((((((#)))))))))))).)).)))). |
-21.7 |
|
40 |
hsa-miR-4747-5p |
AK4 |
AGGGAAGGAGGCTTGGTCTTAG#AAGACTGAGCTTTTTCCTG#.(((((.(((((((((((((..#)))))))))))))))))). |
-21.8 |
|
41 |
hsa-miR-449a |
AK4 |
TGGCAGTGTATTGTTAGCTGGT#CCAGTGAATCCTCTGTCAATTCACTGCCAT#((((((((.((((...(((((.#)))))...........)))).)))))))). |
-21.8 |
|
... |
hsa-miR-520a-5p |
ALPL |
CTCCAGAGGGAAGTACTTTCT#GGACCCAAGAAACCAAAGTCTGCCGCCCACCTCGCTCCCCTCTGGAA#.(((((((((.(((.......#.))).))))))))). |
-21.1 |
|
98 |
hsa-miR-525-5p |
ALPL |
CTCCAGAGGGATGCACTTTCT#AGAAAGGGGACCCAAGAAACCAAAGTCTGCCGCCCACCTCGCTCCCCTCTGGAA#.(((((((((..((.......#.))..))))))))). |
-22.0 |
|
99 |
hsa-miR-4784 |
ALPL |
TGAGGAGATGCTGGGACTGA#TCCCAGTCTCATCTCCTGAC#(.((((((((((((((....#))))))...)))))))).). |
-22.1 |
|
100 |
hsa-miR-6883-5p |
ALPL |
AGGGAGGGTGTGGTATGGATGT#ACATTCTGGATCTGACCCTCCCA#.((((((((..(((..((((((#))))))...)))..)))))))). |
-24.5 |
|
101 |
hsa-miR-4487 |
ALPL |
AGAGCTGGCTGAAGGGCAG#CTGCCCTTTGGCCAA#.....((((((((((((((#)))))))))))))). |
-25.5 |
|
102 |
hsa-miR-4728-5p |
ALPL |
TGGGAGGGGAGAGGCAGCAAGCA#CTGACCCTCCCACTCCCAT#(((((((((((.(((((......#))).))))))).)))))). |
-26.8 |
|
103 |
hsa-miR-2467-3p |
ALPL |
AGCAGAGGCAGAGAGGCTCAGG#TCTGGCCTCCAGCCTTTGCTC#(((((((((.(.(((((.((((#)))))))))).))))))))). |
-28.3 |
|
108 |
hsa-miR-23a-5p |
ALPL |
GGGGTTCCTGGGGATGGGATTT#AATGCTCATGTCCCTGTCCCCAGGCCCAGCCCTC#((((((((((((((((((((..#.))))).)))))))))...)))))). |
-32.8 |
|
... |
hsa-miR-1976 |
CYC1 |
CCTCCTGCCCTCCTTGCTGT#GCCTCTCTTCATCTGGAAGAAGAGGCAAGGGGGCAGGAGA#.(((((((((.(((((((..#.)))))))))))))))). |
-32.8 |
|
110 |
hsa-miR-6774-5p |
CYC1 |
ACTTGGGCAGGAGGGACCCTGTATG#CATCCTGCCAGAACAGGCCCTCAAGCCCAAGA#.(((((((..(((((..(((((...#.))))))))))..))))))). |
-30.4 |
|
111 |
hsa-miR-1236-5p |
GGT1 |
TGAGTGACAGGGGAAATGGGGA#CCGGCTTCCCCTGTGAGCA#...((.(((((((((.(.((..#)).).)))))))))..)). |
-21.0 |
|
112 |
hsa-miR-3689a-5p |
GGT1 |
TGTGATATCATGGTTCCTGGGA#TCCAGGGACAAGATACTCACC#.((((((((...(((((((((.#)))))))))..)))).)))). |
-21.0 |
|
113 |
hsa-miR-3689b-5p |
GGT1 |
TGTGATATCATGGTTCCTGGGA#TCCAGGGACAAGATACTCACC#.((((((((...(((((((((.#)))))))))..)))).)))). |
-21.0 |
|
114 |
hsa-miR-3689e |
GGT1 |
TGTGATATCATGGTTCCTGGGA#TCCAGGGACAAGATACTCACC#.((((((((...(((((((((.#)))))))))..)))).)))). |
-21.0 |
|
145 |
hsa-miR-3194-3p |
GGT1 |
AGCTCTGCTGCTCACTGGCAGT#CCTGTGAGCAGCAGAGCA#.((((((((((((((.((....#)).)))))))))))))). |
-32.6 |
|
146 |
hsa-miR-26b-3p |
GGTLC1 |
CCTGTTCTCCATTACTTGGCT#CCAGGACGAGGAAGAGGACTTTGGGGGACAGGC#(((((((((((...(((..((#.))..))).....))))))))))). |
-21.1 |
|
147 |
hsa-miR-425-3p |
GGTLC1 |
ATCGGGAATGTCGTGTCCGCCC#GGGGGACAGGCTTCTCCTGT#..(((((..(((.(((((.(((#)))))))))))...))))). |
-21.2 |
|
148 |
hsa-miR-1275 |
GGTLC1 |
GTGGGGGAGAGGCTGTC#GGCCTGTCTCCCCA#(.((((((.(((((...#))))).))))))). |
-21.5 |
|
... |
hsa-miR-4514 |
GOT1 |
ACAGGCAGGATTGGGGAA#TCCCTAGTCCTAAGCTTT#..(((((((((((((((.#)))))))))))..)))). |
-21.0 |
|
194 |
hsa-miR-1185-2-3p |
GOT1 |
ATATACAGGGGGAGACTCTCAT#GAGTGTCTGGTCTCCCTGC#.....(((((((((((.(((..#))).)))...)))))))). |
-21.0 |
|
195 |
hsa-miR-2276-3p |
GOT1 |
TCTGCAAGTGTCAGAGGCGAGG#GACACTTGCAGGA#((((((((((((..........#)))))))))))). |
-21.0 |
|
196 |
hsa-miR-3153 |
GOT1 |
GGGGAAAGCGAGTAGGGACATTT#GTGTCCCTAGTCCTAAGCTTTG#....(((((((.(((((((((..#))))))))).))....))))). |
-21.1 |
|
197 |
hsa-miR-320c |
GOT1 |
AAAAGCTGGGTTGAGAGGGT#ATCATCTCAACCCAGA#.....(((((((((((.(((#))).))))))))))). |
-21.3 |
|
198 |
hsa-miR-1278 |
GOT1 |
TAGTACTGTGCATATCATCTAT#AGTTTTACCAAACAGTATTTACTCGTGATGTGCGTAGTGCA#..((((((((((((((((....#.)))))))))))))))). |
-21.3 |
|
... |
hsa-miR-4473 |
GPT |
CTAGTGCTCTCCGTTACAAGTA#TACTTGCTCTTGATGCCTGGCGGGGTGGGGTGGGGGGGGTGCTGGG#((((((((((((.((((.....#.)))))))))))))))). |
-21.0 |
|
327 |
hsa-miR-492 |
GPT |
AGGACCTGCGGGACAAGATTCTT#TCTCTGCAGGTCCC#.((((((((((((..........#)).)))))))))). |
-21.1 |
|
328 |
hsa-miR-5581-5p |
GPT |
AGCCTTCCAGGAGAAATGGAGA#CCTGGGAGGCTC#(((((((((((...........#))))))))))). |
-21.1 |
|
329 |
hsa-miR-3126-3p |
GPT |
CATCTGGCATCCGTCACACAGA#GTGGGGGGGGTGCTGGGC#..((((((((((.((.(((...#))).)).)))))))))). |
-21.5 |
|
330 |
hsa-miR-6875-5p |
GPT |
TGAGGGACCCAGGACAGGAGA#CCTGCCTCTCTGCAGGTCCCTA#..((((((((((((((((...#))))..)).)))..))))))). |
-21.7 |
|
331 |
hsa-miR-3116 |
GPT |
TGCCTGGAACATAGTAGGGACT#GGTCCCTAATAAAGCTGTGTGGCAG#((((....((((((((((((((#)))))))......))))))))))). |
-21.7 |
|
332 |
hsa-miR-129-1-3p |
GPT |
AAGCCCTTACCCCAAAAAGTAT#TGGGGTGGGGGG#...(((((((((((........#))))))))))). |
-22.0 |
|
333 |
hsa-miR-129-2-3p |
GPT |
AAGCCCTTACCCCAAAAAGCAT#TGGGGTGGGGGG#...(((((((((((........#))))))))))). |
-22.0 |
|
334 |
hsa-miR-3675-5p |
GPT |
TATGGGGCTTCTGTAGAGATTTC#TCTCTGCAGGTCCCTAA#..(((((..((((((((((....#)))))))))).))))). |
-22.0 |
|
... |
hsa-miR-381-5p |
LRRC24 |
AGCGAGGTTGCCCTTTGTATAT#GCCGGTGCGGCCTCGCG#.((((((((((((...((....#)).)).)))))))))). |
-21.9 |
|
410 |
hsa-miR-301b-5p |
LRRC24 |
GCTCTGACGAGGTTGCACTACT#GGTGCGGCCTCGCGCATGCT#((.....((((((((((((...#)))))))))))).....)). |
-23.2 |
|
411 |
hsa-miR-489-5p |
LRRC24 |
GGTCGTATGTGTGACGCCATTT#GGCCTCGCGCATGCTCCG#((..((((((((((.(((....#))).)))))))))).)). |
-23.3 |
|
412 |
hsa-miR-4730 |
LRRC24 |
CTGGCGGAGCCCATTCCATGCCA#GGCGCCGGAGATTGGCCGGTGCGGCCTCGCGCATGCTCCGTCAGT#(((((((((((((((((.((((.#))))..))))..)))...................)))))))))). |
-27.4 |
|
413 |
hsa-miR-6081 |
LRRC24 |
AGGAGCAGTGCCGGCCAAGGCGCC#GGCGCCGGAGATTGGCCGGTGCGGCCTCGCGCATGCTCCG#.(((((((((((((((((((((((#)))))).....)))))))))))...........)))))). |
-39.8 |
«...» – разрыв таблицы (конец фрагмента)
Из выявленных микроРНК наиболее стабильное взаимодействие с генами имели 49 (табл. 3).
Таблица 3
Перечень микроРНК, наиболее эффективно взаимодействующих с мРНК генов-мишеней
|
Ген |
микроРНК |
Энергия связи |
|
ALB |
hsa-miR-7706 |
-23.3 |
|
hsa-miR-671-5p |
-23.4 |
|
|
hsa-miR-6775-3p |
-23.5 |
|
|
hsa-miR-6849-5p |
-23.5 |
|
|
hsa-miR-4663 |
-24.1 |
|
|
hsa-miR-6775-5p |
-32.2 |
|
|
AK4 |
hsa-miR-3663-3p |
-28.2 |
|
hsa-miR-4646-5p |
-28.2 |
|
|
hsa-miR-8089 |
-29.3 |
|
|
hsa-miR-6796-5p |
-30.6 |
|
|
hsa-miR-767-3p |
-33.5 |
|
|
hsa-miR-661 |
-34.2 |
|
|
ALPL |
hsa-miR-2467-3p |
-28.3 |
|
hsa-miR-939-3p |
-28.3 |
|
|
hsa-miR-10401-5p |
-28.9 |
|
|
hsa-miR-149-3p |
-29.6 |
|
|
hsa-miR-6752-3p |
-30.9 |
|
|
hsa-miR-23a-5p |
-32.8 |
|
|
CYC1 |
hsa-miR-1976 |
-32.8 |
|
hsa-miR-6774-5p |
-30.4 |
|
|
GGT1 |
hsa-miR-135a-3p |
-28.1 |
|
hsa-miR-125a-3p |
-28.5 |
|
|
hsa-miR-6824-5p |
-30.2 |
|
|
hsa-miR-1343-5p |
-32.2 |
|
|
hsa-miR-2861 |
-32.5 |
|
|
hsa-miR-3194-3p |
-32.6 |
|
|
GGTLC1 |
hsa-miR-4298 |
-28.3 |
|
hsa-miR-5008-3p |
-29.2 |
|
|
hsa-miR-939-5p |
-31.1 |
|
|
hsa-miR-3194-3p |
-33.7 |
|
|
hsa-miR-6752-5p |
-33.9 |
|
|
hsa-miR-6824-5p |
-34.4 |
|
|
GOT1 |
hsa-miR-4767 |
-30.2 |
|
hsa-miR-6796-5p |
-30.4 |
|
|
hsa-miR-6762-5p |
-30.5 |
|
|
hsa-miR-8071 |
-32.2 |
|
|
hsa-miR-6786-5p |
-32.2 |
|
|
hsa-miR-4763-3p |
-41.2 |
|
|
GPT |
hsa-miR-4749-3p |
-33.1 |
|
hsa-miR-3162-3p |
-33.2 |
|
|
hsa-miR-6729-3p |
-33.5 |
|
|
hsa-miR-3180-5p |
-33.9 |
|
|
hsa-miR-6805-3p |
-34.3 |
|
|
hsa-miR-6806-5p |
-35.4 |
|
|
LRRC24 |
hsa-miR-381-5p |
-21.9 |
|
hsa-miR-301b-5p |
-23.2 |
|
|
hsa-miR-489-5p |
-23.3 |
|
|
hsa-miR-4730 |
-27.4 |
|
|
hsa-miR-6081 |
-39.8 |
Анализ уровня транскриптов этих 49 микроРНК мы провели на образцах плазмы крови больных ГЦК и НАЖБП. В качестве контроля использовали группу условно здоровых доноров. Результаты представлены на рисунке 4. Обнаружено статистически значимое (p<0,005) увеличение экспрессии hsa-miR-7706 в 1,8 раза и hsa-miR-6775-5p в 2,1 раза у больных НАЖБП и статистически значимое (p<0,005) снижение экспрессии hsa-miR-671-5p в 2,0 раза у больных ГЦК относительно здоровых доноров. Обнаружено увеличение экспрессии hsa-miR-6796-5p в 1,7 раза у больных НАЖБП. У больных ГЦК также выявлено снижение экспрессии hsa-miR-2467-3p, hsa-miR-939-3p и hsa-miR-10401-5p в 2,0, 2,5 и 1,7 раза, hsa-miR-6786-5p и hsa-miR-6805-3p в 2,5 и 5,0 раз относительно здоровых доноров.
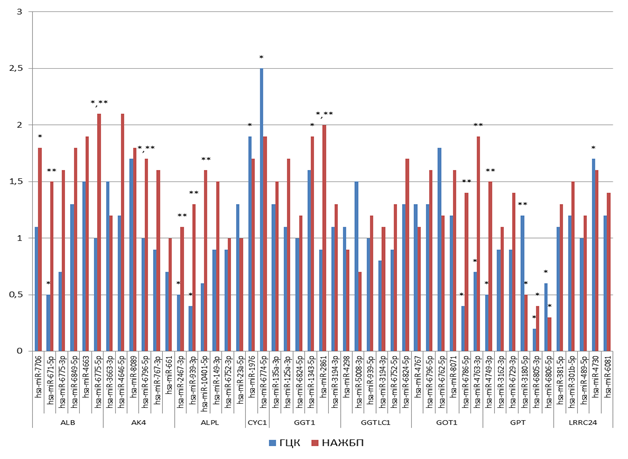
Рис. 4. Уровень экспрессии 49 микроРНК в образцах плазмы крови больных ГЦК и НАЖБП
При этом у данных пациентов наблюдается увеличение экспрессии микроРНК hsa-miR-4730, hsa-miR-1976 и hsa-miR-6774-5p в 1,7, 1,9 и 2,5 раза соответственно.
Заключение
Таким образом, проведенное комплексное исследование показателей копийности генов и экспрессии микроРНК в плазме крови и сравнение с данными биохимических обследований пациентов с ГЦК и НАЖБП позволило как установить особенности регуляции функционального состояния печени – активности ферментов АЛТ, АСТ, ГГТ и щелочной фосфатазы и концентрации альбумина, так и выявить генетические и транскриптомные маркеры этих заболеваний.



