Растущая пандемия ожирения и метаболического синдрома (МС) становится важной проблемой общественного здравоохранения цивилизованных стран. Кроме обменных нарушений, в патогенезе МС участвуют острый и хронический стресс, при которых гиперкатехоламинемия дополнительно повышает уровни глюкозы, инсулина, способствуя дальнейшему развитию инсулинорезистентности, дислипидемии, артериальной гипертензии и висцерального ожирения. Вместе с метаболическими нарушениями стресс участвует в дисфункции НЭИМ-системы, влияя на опорно-двигательный аппарат, сердечно-сосудистую систему, печень [1], способствуя развитию низкоинтенсивного воспалительного процесса в организме [2].
Терапия МС комплексная (медикаментозная и немедикаментозная), патогенетическая, направлена на коррекцию основных звеньев патогенеза, включая существенное изменение образа жизни, связана с комплаентностью к терапии. Пациенты сегодня активно применяют БАДы и нутрицевтики, которые врачи включают в комплексную терапию МС, в некоторых случаях – при ожирении с ИМТ£27 кг/м2. Согласно научным данным, в такой ситуации физическая нагрузка и диетотерапия могут быть эффективны без лекарственной поддержки [3]. В то же время, с учетом непрерывной тенденции к росту заболеваемости МС, идет поиск новых методов его патогенетической немедикаментозной коррекции.
На территории Северного Кавказа произрастает более 6 тысяч видов растений, некоторые из которых являются эндемиками и входят в Красную книгу, многие интродуцированы человеком. Богатая и разнообразная флора региона считается народным достоянием, поскольку растения – это возобновляемый источник сырья для сельского хозяйства, фармацевтики и парафармацевтики, пищевой промышленности и медицины. В медицинской практике одно растение имеет разнообразные точки приложения, что объясняется многокомпонентным набором БАВ и их вторичных метаболитов. Особенности экологии, климата, географических зон оказывают специфичное действие на обменные процессы, синтез и накопление биологически активных веществ (БАВ), определяющих биологическую эффективность, что обусловливает ценность культур (интродуцентов) того или иного региона произрастания.
Цель исследования – обоснование возможности использования известных биологически активных веществ, выделенных из некоторых лекарственных растений, перспективных к интродукции в регионах Северного Кавказа, для коррекции ожирения и метаболического синдрома.
Материалы и методы исследования
В рамках исследования проведен поиск научных данных в научных информационных базах: PubMed, Scopus, eLibrary, опубликованных за последнее десятилетие. Анализ публикаций по биологическим эффектам БАВ растений был выполнен независимо двумя исследователями в базах данных PubMed, Scopus, eLibrary, ограничен 10 годами. Поиск публикаций производили в течение мая – августа 2023 года. Для поиска использовали только статьи по направлению «медицина», для подбора публикаций по патогенетическому эффекту БАВ, кроме фильтров «метаболический синдром», «системное воспаление», «NF-kB», использовали ключевые слова, характеризующие патогенетическую активность БАВ: «клеточный стресс», «противовоспалительный эффект» и т.д. Параметрами включения лекарственного растения в раздел с определенным видом активности стали соответствие ключевому эффекту и наличие аналога/эндемика / возможного интродуцента во флоре регионов Северного Кавказа. В обзор предпочтительно включали исследования за последние 5 лет, однако, если научных данных по лекарственному эффекту в этот период не было опубликовано, включали и более ранние работы.
Результаты исследования и их обсуждение
Патофизиология МС представлена сложными механизмами, включает немодифицируемые генетические и эпигенетические факторы, образ жизни (гиподинамия, повышение калоража пищи), стрессы, которые реализуются через центральные и периферические регуляторные механизмы на клеточном уровне после формирования висцерального ожирения [4]. Все перечисленные факторы сопровождаются включением универсального сигнального пути воспаления через транкрипционный фактор NF-kB [5], который запускает основные провоспалительные реакции в ядре клетки (рисунок). БАВ растений способны воздействовать на различные уровни этого механизма, оказывая системное действие на пути активации воспалительного процесса.
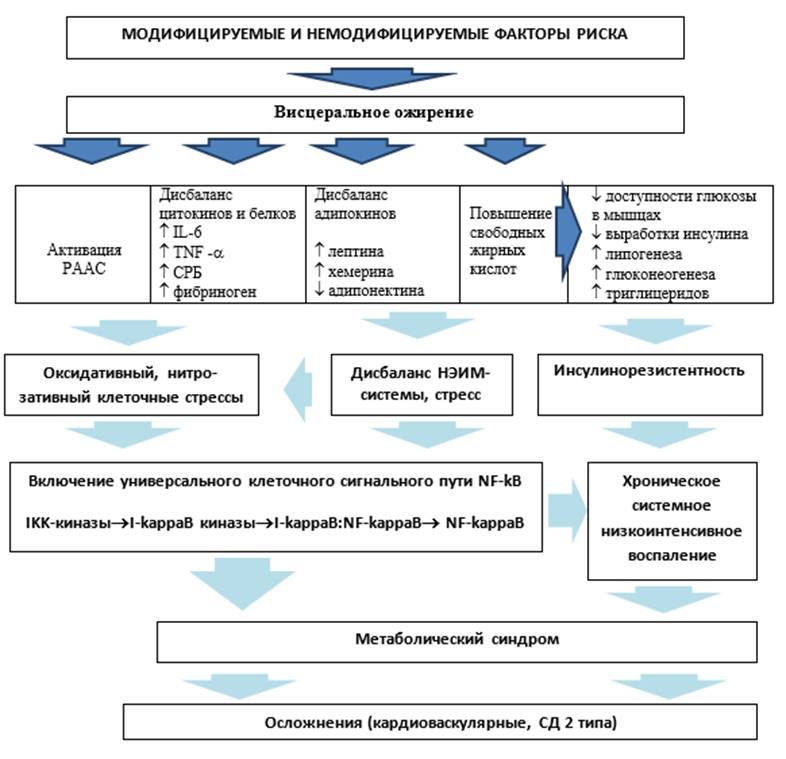
Патофизиологические механизмы метаболического синдрома[4], дополнен
Блокада клеточного стресса
Оксидативный и нитрозативные стрессы, сопровождающиеся накоплением активных форм кислорода (АФК), нитритов и NO-факторов активации неинфекционного воспаления, через запуск NF-kB вносят существенный вклад в патогенез МС. В начале века было доказано, что полифенолы растений (например, зеленого чая и красного вина) блокируют окислительный стресс [6]. Так, водорастворимые полисахаридные комплексы корневищ аира болотного (Acorus calamy L.) тормозят ПОЛ, блокируя взаимодействие с молекулами токсических веществ, оксидов, пероксидов, проявляя при этом высокую антиоксидантную активность [7], повышают резистентность мембран эритроцитов. БАВ алтея лекарственного (Althea officinalis L.) ингибируют высвобождение TNF-α, IL6 макрофагами в эксперименте на культуре эндотелия пуповинной крови, снижая окислительное повреждение [8].
Брусника (Vaccinium vitis-idaea L.) обладает самой высокой антиоксидантной активностью среди ягодных, включая ежевику, чернику, малину, клубнику и клюкву. Цианидин-3-галактозид, входящий в ее состав, является доминирующим антоцианом, обеспечивающим антиоксидантную активность, он снижает продукцию АФК, повышает экспрессию супероксиддисмутазы 2 (SOD2), глутатионпероксидазы (GPx) и каталазы в воспаленных адипоцитах [9].
Спиртовый экстракт девясила высокого (Inula helenium L.) ингибирует продукцию NO и уровень экспрессии индуцибельной синтазы оксида азота (iNOS), подавляя экспрессию IL-6 за счет содержания β-кариофиллена, последний имеет более высокую антиоксидантную активность, чем эталонная аскорбиновая кислота, и яцеозид (ингибитор продукции NO) [10].
БАВ диаскореи кавказской (Dioscorea сaucasica lypsky): сапонины диосгенин, диосцин, грациллин – тормозят окислительный стресс, модулируют кишечную микробиоту при воспалении [11, 12]. Защитный эффект изорамнетина облепихи крушиновидной (Hippophae rhamnoides L.) связан с ингибированием окс-ЛПНП-рецептора 1 и мРНК каспазы-3, снижением высвобождения NO [13].
Гиспаглабридины А и В, изофлавоны, выделенные из экстрактов солодки голой (G. Glabra), предотвращают перекисное окисление митохондриальных липидов в клетках печени крыс, вызванное Fesup3+ in vitro, ингибируют окисление ЛПНП, возможно, никотинамидадениндинуклеотидфосфат (НАДФН) оксидазы; повышают экспрессию антиоксидантных ферментов в макрофагах, снижают экспрессию молекул адгезии – молекулы межклеточной адгезии-1 (ICAM-1), молекулы адгезии сосудистых клеток-1 (VCAM-1) и Е-селектина в эндотелии, подавляют производство медиаторов воспаления (TNF-α, IL-1, NO) [14, 15].
Выраженное антиоксидантное действие хмеля обыкновенного (Humulus lupulus) обусловлено представленным в нем комплексом биологически активных веществ: α- и β-кислот, халконов (ксантогумол, изоксантогумол, дезметилксантогумол), флавонов, процианидинов и других соединений, которые угнетают индуцируемое сульфатом меди или анионом пероксинитрила окисление ЛПНП. В эксперименте доказано, что антиоксидантное действие ксантогумола выше, чем у α-токоферола [16].
Источником природных антиоксидантных соединений, аналогичных α-токоферолу, могут стать растения рода Seseli: порезник закавказский (жабрица) – Libanotis transcaucasica, флавоноиды шалфея мутовчатого – Salvia verticillata L., способные активировать ферментативную систему АОС клетки [17, 18].
Противовоспалительное действие
Представляют интерес и основные противовоспалительные механизмы растительных компонентов. На модели жировой ткани in vitro экстракт плодов брусники подавлял воспаление в TNF-активированных адипоцитах 3T3-L1, снижал экспрессию IL-6, моноцитарного хемоаттрактантного белка I (MCP-1), IL-1, TNF-α, МСР-1, ЦОГ-2, iNOS; усиливал экспрессию противовоспалительных цитокинов (IL-10, адипонектина). Было доказано, что ингибирующее действие экстракта брусники на экспрессию iNOS и образование NO более выражено, чем у будесонида – глюкокортикостероида с высоким противовоспалительным потенциалом [19].
Компоненты настоя горца мясо-красного (Змеевик большой) – Persicaria bistorta (L.) Samp. – тормозят высвобождение IL-1β, TNF-α, IL-8, положительно влияют на жизнеспособность и апоптоз здоровых клеток [].
Лиофилизированный цветочный настой лабазника обыкновенного (Таволга обыкновенная, земляной орех – F. vulgaris) богат полифенолами, относящимися к классам флавоногликозидов, фенолокислот и гидролизуемых дубильных веществ. Благодаря флавоноидам (спиреозид, астрагалин 2″-O-галлат и смесь гиперозида 2″-O-галлата и изокверцитрина 2″-O-галлата) он способен снижать выработку провоспалительных эйкозаноидов ex vivo в тромбоцитах человека, ингибировать активность ЦОГ-1 и ЦОГ-2, поглощать избыток NO, демонстрируя достоверный противовоспалительный потенциал in vitro и in vivo [21, 22].
Широким спектром противовоспалительных эффектов обладают 4 класса лигнанов лимонника китайского (Schirandra Chinensis Baill): «лигнаны Schisandra chinensis» и полифенолы экстрактов листьев черной смородины (Ríbes nígrum), что подтверждено на различных моделях воспаления [23, 24].
Некоторые БАВ солодки голой аналогично стероидному гормону (гидрокортизону) ингибируют активность фосфолипазы А2; глицирризиновая кислота in vitro подавляет активность ЦОГ и образование простагландина Е2, что тормозит воспаление в эксперименте и клинике [25]. Противовоспалительный иммунологический эффект характерен для большинства фитоадаптогенов (таких как солодка голая, элеутерококк колючий, девясил высокий, родиола розовая и др.).
Экстракт черники обыкновенной (Vaccinium myrtillus L.) оказывает противоспалительное действие за счет уменьшения количества Т-клеток, продуцирующих IFNγ; снижает экспрессию TNF-α в жировой ткани, VCAM-I и адипонектина в плазме, повышает уровень хемокинового лиганда 1 с мотивом C-X-C [CXCL1]), подавляет экспрессию IL-1β и IL-6, ферментов (iNOS, ЦОГ-2), модулирующих сигнальные пути и снижающих уровень АФК в клеточных и животных моделях [26].
Снижение всасывания жиров в кишечнике, гепато- и панкреопротекторный эффект
Одним из направлений терапии метаболических расстройств является подавление активности пищеварительных ферментов, ответственных за всасывание пищевых жиров и сахара из кишечника. Среди 30 исследованных плодов, которые нутрициология относит к «суперфуду», только брусника и красная смородина ингибировали активность липазы, глюкозидазы, α-амилазы поджелудочной железы, тот же эффект был характерен для сесквитерпеновых лактонов (СЛ) васильков (Centaure) [27, 28]. Брусника снижает накопление липидов в печени и уровень воспалительного маркера ингибитора активатора плазминогена-1 (PAI-1), опосредует положительные эффекты гомеостаза глюкозы [28].
При применении этанольного экстракта цветков девясила высокого у мышей C57BL/6J, получавших продукты с высоким содержанием жиров, были отмечены ингибирование накопления липидов в адипоцитах 3T3-L1 и печени in vitro, снижение жировой массы тела, увеличение мышечной массы [29].
Изокверцитрин девясила в исследовании in vivo на китайских мышах с диабетом 2-го типа стимулировал секрецию и биодоступность глюкагоноподобного пептида-1 (GLP-1), инсулина, понижал уровень глюкозы натощак; оказывал гепатопротекторный эффект. Алантолактон девясила повышает уровень поглощения глюкозы и является возможным препаратом для лечения резистентности к инсулину и непереносимости глюкозы, поскольку способен ингибировать воспалительный процесс, индуцированный IL-6 [30].
Гиперицин, гиперфорин и адперфорин зверобоя – травы Святого Джона (Hypericum perforatum L.) – защищают β-клетки от повреждения цитокинами, уменьшая потерю их функции при диабете и увеличивая выживаемость [31]. У крыс при высокожировой диете применение H. perforatum нормализует уровень повышенного холестерина, триглицеридов и глюкозы в крови, приводит к нормализации глюкозы и ЛПВП при стрептозотоциновом диабете [32]. Широкий спектр вторичных метаболитов H. perforatum (алкалоидов, терпенов, фенолов, галлата эпигаллокатехина) стимулирует термогенез, тормозит накопление жира, что связано со способностью ингибировать липазу поджелудочной железы [32, 33].
Коррекция дислипидемии, уровня глюкозы
Зверобой продырявленный активен и при коррекции дислипидемии; так, экстракт H. perforatum ингибировал повышение уровня Lpl полностью дифференцированных адипоцитов (фермент, который играет роль в превращении триглицеридов в жирную кислоту и глицерин) до уровня, характерного для преадипоцитов; снижал экспрессию TNF-α и IL-6, мРНК синтазы жирных кислот в адипоцитах [34].
Бетаин брусники и сесквитерпеновые лактоны васильков (Centaure) в эксперименте снижали массу печени, содержание холестерина, уровень глюкозы в крови, тормозили развитие стеатоза печени и гиперлипидемию у мышей [35, 36].
Триллин диаскореи у крыс на высокоуглеводной диете снижал уровень глюкозы в крови и гликемический индекс, что определяет его включение в функциональные пищевые продукты для облегчения постпрандиальной гипергликемии [37].
Потенциальное влияние изофлавонов клевера лугового (Trifolium pratense L.) на метаболизм липидов было доказано в экспериментах на животных и в клинике – прием компонентов красного клевера приводил к снижению общего холестерина, холестерина ЛПНП и триглицеридов, а также к умеренному, но незначительному повышению уровня ЛПВП в сыворотке крови. Основным механизмом влияния на дислипидемию является активация рецепторов, активируемых пролифератором пероксисом (PPAR), – ядерных рецепторов, которые участвуют в гомеостазе клеточных липидов [38]. Биоханин А и формононетин клевера являются двойными агонистами PPAR-альфа, которые регулируют метаболизм липидов посредством прямого контроля транскрипции генов, участвующих в проксисомальных и митохондриальных путях бета-окисления, поглощении жирных кислот и катаболизме триглицеридов [38]. Наблюдаемые эффекты, вероятно, являются результатом снижения экспрессии пропротеинконвертазы субтилизина/кексина типа 9 (PCSK9), что приводит к повышению уровня печеночных рецепторов ЛПНП и увеличивает клиренс холестерина ЛПНП из кровотока [39]. В то же время инактивация PCSK9 в эпителии кишечника снижает постпрандиальную триглицеридемию [39].
В эксперименте при кормлении крыс Fischer богатым антоцианами соком черники в течение 10 недель снижались уровни триглицеридов, холестерина, резистина и лептина в сыворотке крови, но это не влияло на высвобождение адипонектина или других адипокинов из жировой ткани [40].
Блокирование универсального клеточного механизма NF-kB
В большинстве своем БАВ растений оказывают блокирующий эффект на уровне центрального аппарата клеток. Так, СЛ васильков участвуют в регуляции NF-κB и сигнального пути митоген-активируемой протеинкиназы (MAPK) [41], снижая выработку хемокинов (MCP-1, TGF-β1, FN), ингибируют вызванную сахаром деградацию IκBα, подтверждая эффективность в качестве возможных препаратов для лечения диабетической нефропатии [42, 43].
Гидроэтанольный экстракт девясила высокого у мышей ингибирует индуцированную TNF-α активацию NF-κB и экспрессию IL-1, IL-4 и TNF-α на линии клеток человека HaCat [44]. Изокверцитрин девясила высокого, действуя на миокардиоциты, ослабляет вызванную ЛПС сердечную дисфункцию, снижает уровни TNF-α, IL6, MCP1 и iNOS in vivo и in vitro, блокируя MAPK и NF-пути κB [45]. Алантолактон девясила высокого – СЛ эвдесманолида с фрагментом α-метилен-γ-лактона – ингибирует индуцированную ЛПС продукцию NO в макрофагах лучше, чем аминогуанидин, нарушает сигнальный путь NF-κB посредством ингибирования фосфорилирования ингибирующего κB-α (IκB-α) и IKK, а также пути MAPK [45].
Изорхамнетин – флавоноид листьев, цветков и плодов облепихи крушиновидной [13, 46, 47] – регулирует NF-kB, PI3K/AKT, MAPK и другие сигнальные пути и регулируемые ими факторы; защищает сердечно-сосудистые клетки от воспаления, окислительного повреждения и апоптоза, воздействуя на сигнальные пути PI3K/AKT и NF-κB, ингибирует пролиферацию гладкомышечных клеток [48], оказывает протекторное действие на повреждение эндотелиальных клеток, вызванное H2O2 и ox-LDL [49], благодаря его противовоспалительному и антиоксидантному эффектам [50].
Прием черники снижал уровни мишеней NF-κB, таких как циркулирующий hsCRP, IL-6 и MIG; отмечены более высокие уровни кверцетина и р-кумаровой кислоты в плазме. Кроме того, полифенолы кверцетин, ресвератрол и эпикатехин подавляют активацию NF-kB в моноцитарных клетках человека, обработанных ЛПС.
Заключение
Необходимо отметить, что экстракты одного растения способны содержать десятки БАВ, которые обеспечивают в большинстве случаев синергетические эффекты, однако известны растения, например фитоадаптоген женьшень, которые содержат вещества (гинзеноиды) разнонаправленного (антагонистического) действия. В последнем случае биологический эффект веществ растения определяется исходным статусом организма, на которое идет воздействие. Те же эффекты ожидаемы и для комплексов, включающих БАВ 2 и более растений. В научных базах данных мало работ, посвященных изучению явления «синергизма» и «антагонизма» растений, а также серьезных клинических исследований, посвященных применению отдельных растительных экстрактов и их комплексов, поскольку, по мнению О.А. Бочаровой (2008–2022), необходим иммунологический контроль индивидуальной чувствительности и наступающей со временем толерантности к отдельным экстрактам, в связи с чем большинство описанных в обзоре эффектов изучены для изолированных веществ в эксперименте. Отсутствуют надежные методы стандартизации многокомпонентных смесей БАВ в экстрактах, особенно выращенных в различных климатических условиях. Большинству многокомпонентных комплексов растений присущи «политаргетные» (многоцелевые) и, как следствие, синергетические эффекты, что можно объяснить способностью отдельных веществ независимо действовать на вне- и внутриклеточные рецепторы благодаря собственному химическому строению, а также особенностями плазматических мембран клетки и субклеточных структур. Также важно понимать, что комплексы растительных БАВ оказывают эффект в соответствии с патофизиологическим статусом организма, обусловленным включением в патологическое состояние адаптивных механизмов физиологических систем, что может существенно влиять на биологические эффекты комплексов растений, и при различных патологических состояниях векторы эффектов могут отличаться.
Тем не менее, современному прогрессу в получении эффективных лечебных средств растительного происхождения способствуют значительные успехи химии и фармакологии, которые создали более совершенные аналитические методы для объективизации лечебной активности БАВ растений. В оценке эффективности растений стал важен их химический состав. Продуцируемые в растениях БАВ являются продуктами метаболизма в живом организме, поэтому значительная часть этих продуктов более естественно включается в биохимические и другие жизненные процессы, чем синтезированные лекарства, что снижает процент нежелательных эффектов при применении фитопрепаратов. Компоненты растений, перспективных для интродукции в регионах Северного Кавказа, представляют научный интерес при изучении их биологических эффектов, а также при разработке новых препаратов для немедикаментозной терапии метаболических нарушений.



