Проблема рецидивирования злокачественных опухолей является одной из основных в онкологии, т.к. при этом процессе происходит селекция резистентных к лечению клонов опухолевых клеток, что вызывает снижение чувствительности к дальнейшему химиолучевому лечению. Как стало очевидно в настоящее время, кроме хирургических причин (неполного удаления первичной опухоли), рецидивирование обусловлено рядом биологических закономерностей и связано с опухолевыми стволовыми клетками [1], а также с микроокружением, способствующим выживанию резидуальных опухолевых клеток [2]. Некоторые опухоли отличаются высокой частотой и скоростью рецидивирования также вследствие анатомо-физиологических особенностей органа, где они развиваются. В частности, органосохраняющее лечение рака мочевого пузыря в 60–80% случаев заканчивается рецидивом опухоли [3]. Высокая частота послеоперационных рецидивов наблюдается и при поверхностных опухолях без инвазии в мышечный слой, которые составляют среди злокачественных новообразований мочевого пузыря 80% случаев, а частота рецидивов заболевания при этой форме РМП даже в стадии Т2а колеблется от 56,0% до 65,5% [4].
Лечение немышечно-инвазивного рака мочевого пузыря (НМИРМП), по-видимому, должно включать и противорецидивную составляющую [5]. Прогнозирование развития раннего рецидива представляется важным для разработки и применения такого лечения. Показана значимость иммунного микроокружения для рецидивирования сарком мягких тканей [6], рака вульвы [7].
Выявление факторов раннего рецидивирования в микроокружении НМИРМП и разработка прогностических алгоритмов на их основе является актуальной научной и клинической задачей онкоурологии. Ранее авторами установлены различия популяционного состава внутриопухолевых иммунокомпетентных клеток и цитокинов [8] между рецидивирующим и нерецидивирующим в течение 6-9 мес. после операции НМИРМП, а также между опухолями высокой и низкой степени злокачественности (HG и LG).
Целью настоящей работы является применение этих данных для разработки прогностических алгоритмов раннего рецидивирования НМИРМП высокой и низкой степени злокачественности.
Материалы и методы исследования
Исследованы образцы тканей опухоли и перитуморальной зоны 51 пациента, преимущественно мужского пола (90%), средний возраст 61,6 года, с впервые выявленным немышечно-инвазивным раком мочевого пузыря (НМИРМП). Все пациенты давали письменное согласие на участие в исследовании. Во всех случаях первым этапом лечения был хирургический (ТУР - трансуретральная резекция мочевого пузыря), в ходе которого брали образцы тканей, затем выполняли адъювантную внутрипузырную химиотерапию № 6. На основании результатов гистологического исследования больные были разделены на две группы: I группа – с опухолью низкого злокачественного потенциала (Low grade - LG), n=31; II группа – с опухолью высокого злокачественного потенциала (High grade - HG), n=20. Каждые 3 месяца больные проходили контрольное обследование, в том числе цистоскопическое исследование мочевого пузыря, в результате которого через 6-9 месяцев у 24 больных (48%) был диагностирован рецидив заболевания, из них у 15 больных из I группы и у 9 больных из II группы. На основании выявления рецидивов или их отсутствия в течение данного срока наблюдения больные были разделены на подгруппы: 1 – LG без рецидива (n=16); 2 – LG с рецидивом (n=15); 3 – НG без рецидива (n=11); 4 – НG с рецидивом (n=9).
Фрагменты тканей опухоли (ОП) и перифокальной зоны (ПЗ) дезинтегрировали с помощью BD Medimachine (США), получали клеточную суспензию и супернатант. Взвесь клеток обрабатывали панелью моноклональных антител: CD3 FITC/CD16/56+ PE/CD45 PerCP-Cy5.5/CD4 PE-Cy7/CD19 APC/CD8 APC-Cy7; процентное содержание лимфоцитов различного фенотипа оценивали на проточном цитометре FacsCantoII (BD, СШA). В супернатанте определяли уровни цитокинов IL-1β, IL-6, IL-10, IL-18, TNF-α, INF-γ, IL-8 ИФА-методом с помощью тест-систем «Вектор-Бест» (Россия), учет проводили на анализаторе «Униплан» (Россия). Результаты выражали в пг/мл, пересчитанных на 1 г белка, который определяли биуретовым методом.
Статистическая оценка результатов исследования проведена с помощью логистического регрессионного анализа с определением разделительного уровня прогностического коэффициента методом ROC-анализа. Комбинацию факторов для определения риска развития рецидива выделяли с помощью множественного регрессионного анализа с пошаговым включением переменных. В работе использовали модули программы Statistica 12.0 (StatSoft, США).
Результаты исследования и их обсуждение
Обнаруженные различия показателей локального иммунитета и цитокинового состава между указанными группами и подгруппами больных, выявленные с использованием стандартных статистических методов, были описаны ранее [8]. В данной работе на основе анализа показателей локального иммунитета (содержания различных субпопуляций Т- В- и NK-клеток) в удаленных опухолях (ОП) и их перифокальных зонах (ПЗ) больных НМИРМП разработаны алгоритмы прогнозирования риска раннего рецидивирования (через 6-9 мес. после лечения), различные для LG- и HG-опухолей.
Методом множественного регрессионного анализа с пошаговым включением компонент были найдены комбинации показателей, которые максимально эффективно позволяли рассчитать прогноз развития раннего рецидива. Для больных с низкой степенью злокачественности опухолей комбинация предикторов включала содержание в перифокальной зоне опухоли DNТ-, NKT-подобных лимфоцитов, а также значение индекса CD4+/CD8+.
Формула расчета прогностического коэффициента К для определения риска развития рецидива при LG-опухолях, согласно логистическому регрессионному анализу, имела вид:
К= 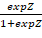 ,
,
где К – вероятность развития рецидива,
Z – коэффициент множественной линейной регрессии, равный
z = -1,14 + 0,0002*X1 + 0,19*X2 – 1,05*Х3
X1 – DNT-лимфоциты (CD3+ CD4- CD8-) в ПЗ
Х2 – NKT- подобные (CD3+CD16/56+) в ПЗ
Х3 – CD4+/CD8+ в ПЗ
При повышении в перифокальной зоне процента DNT-клеток отношение шансов развития рецидива повышалось в 1,38 раза (р=0,029), NKT-подобных клеток - в 1,91 раза (р=0,036), а при снижении CD4+/CD8+ на 65% отношение шансов рецидива повышалось на 100% (р=0,033).
Прогностическая значимость модели была высокой, поскольку критерий c2 Пирсона в целом по модели составил 24,38, а доверительная вероятность р<0,001.
Для оценки вклада каждого предиктора по отдельности в изменение вероятности наступления рецидива болезни у пациентов с низкой степенью злокачественности опухолей кроме отношения шансов рассчитывали b-стандартизированный коэффициент регрессии, а также величину F-cтатистики (табл. 1).
Таблица 1
Оценка парциального вклада предикторов в общий прогноз рецидива НМИРМП у пациентов с LG-опухолями
|
Показатель |
Отношение шансов |
b-стандартизированный коэффициент регрессии |
F-статистика |
р |
|
DNT-лимфоциты (CD3+ CD4- CD8-) в ПЗ |
1,38 |
1,56 |
3,57 |
0,029 |
|
NKT- подобные (CD3+CD16/56+) в ПЗ |
1,91 |
2,58 |
5,48 |
0,036 |
|
CD4+/CD8+ в ПЗ |
0,35 |
-1,92 |
3,14 |
0,033 |
Все представленные в таблице 1 статистические величины оценки вклада предикторов в прогноз свидетельствовали о ведущей роли среди трех показателей числа NKT-подобных клеток в ПЗ.
Методом ROC-анализа определено, что при повышении К выше 0,37 риск развития рецидива статистически значимо (р=0,004) можно определить с чувствительностью 83,3% и специфичностью 85,7%.
Для больных с высокой степенью злокачественности опухолей эффективная комбинация предикторов для прогноза включала удельное содержание IL-1b и процент CD8+ клеток в опухоли, а также процент NK-клеток в перифокальной зоне.
Формула расчета прогностического коэффициента К для определения риска развития рецидива при HG-опухолях представляла следующее математическое выражение:
К= 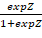 ,
,
где К – вероятность развития рецидива,
Z – коэффициент множественной линейной регрессии, равный
z = 38,18 + 0,4*X1 - 3,08*X2 – 0,56*Х3
X1 - IL-1b (пг/мл/г белка) в ОП
Х2 - CD8+ (%) в ОП
Х3 – NK-клетки (%) в ПЗ
При повышении удельного содержания IL-1b в опухоли отношение шансов развития рецидива повышалось в 1,5 раза (р=0,017); при снижении процента CD8+ в опухоли на 95% и снижении процента NK-клеток в перифокальной зоне на 43% отношение шансов рецидива повышалось в каждом случае на 100% (р<0,001).
Прогностическая значимость модели была высокой, поскольку критерий c2 Пирсона в целом по модели составил 30,24, а соответствующая доверительная вероятность р<0,001.
Оценка парциального вклада предикторов в общий прогноз рецидива НМИРМП у пациентов с НG-опухолями выявила ведущую роль в комплексной модели снижения числа лимфоцитов CD8+ в ОП (табл. 2).
Таблица 2
Оценка парциального вклада предикторов в общий прогноз рецидива НМИРМП у пациентов с НG-опухолями
|
Показатель |
Отношение шансов |
b-стандартизированный коэффициент регрессии |
F-статистика |
р |
|
IL-1b (пг/мл/г белка) в ОП |
1,5 |
1,38 |
6,74 |
0,017 |
|
CD8+ (%) в ОП |
0,05 |
-2,81 |
19,83 |
<0,001 |
|
NK-клетки (%) в ПЗ |
0,57 |
-1,93 |
13,98 |
<0,001 |
Методом ROC-анализа определено, что при повышении К выше 0,06 риск развития рецидива статистически значимо (р<0,001) можно определить с чувствительностью 100% и специфичностью 99%.
Таким образом, при использовании метода логит-регрессии был получен алгоритм прогнозирования раннего рецидива при НМИРМП, который включал только показатели клеточного иммунного микроокружения опухоли при низкой степени ее злокачественности и дополнительно локальный уровень провоспалительного цитокина IL-1b при высокой степени ее злокачественности, несмотря на то, что при обычном статистическом анализе был найден и ряд других различий исследованных факторов.
Анализ имеющихся в литературе данных о про- и противоопухолевой активности лимфоцитарных и цитокиновых факторов, вошедших в алгоритм, позволил обосновать их прогностическое значение не только математически, но и медико-биологически.
Так, в литературе приводятся различные данные о роли DN Т-лимфоцитов при злокачественных опухолях. Это Т-лимфоциты (СD3+), не экспрессирующие маркеры основных субпопуляций (СD4-СD8-). Как показано в недавнем обзоре, об их происхождении и активности существуют разные мнения: их считают субпопуляцией, избежавшей негативной селекции в тимусе, зрелыми Т-клетками, утратившими CD4- или CD8-рецепторы, дифференцированными из активированных CD8-клеток или из DР-тимоцитов [9]. В последние годы у DN Т-клеток выявлена высокая цитотоксическая активность, продукция INF-ɣ, перфорина, Fas/FasL. Они активно исследуются в качестве основы для адаптивной иммунотерапии [10]. Однако, как большинство лимфоцитарных субпопуляций, они гетерогенны, например, по экспрессии αβ или γδ TCR. В последнем случае они в виде TILs могут продуцировать высокие количества различных цитокинов, в т.ч., проонкогенных, экспрессировать ингибирующие молекулы (PD-1, CTLA-4), молекулы адгезии и хоуминга, проявляя, таким образом, не только цитотоксические, но и регуляторные свойства [11]. В норме их высокие количества содержатся в тимусе и лимфоидном аппарате желудочно-кишечного тракта, однако описано повышение их уровня в микроокружении рецидивной опухоли, например саркомы мягких тканей, что позволяет рассматривать их, скорее, как негативный фактор [6]. Возможно, их цитотоксичность подавляется рецидивной опухолью или получает преимущество одна из субпопуляций DN Т-клеток с иммуносупрессивной активностью. Вышесказанное позволяет объяснить биологическую основу, в соответствии с которой полученный прогностический алгоритм включает показатель процентного содержания DN Т-лимфоцитов в ПЗ LG НМИРМП в качестве фактора негативного прогноза (раннего рецидивирования).
NKT-подобные клетки также играют двойственную роль при онкопатологии. Эта субпопуляция гетерогенна и включает как клетки с противоопухолевой активностью, так и проонкогенные и иммуносупрессивные, значимость которых в качестве факторов негативного прогноза описана в литературе [12]. Иммуносупрессивным и проонкогенным действием обладают NKT-подобные клетки 2-го типа [13], и обнаружение их высокого содержания в ткани рецидива НМИРМП может характеризовать его более агрессивное течение, что подтверждается в данном исследовании.
В отличие от вышеописанных минорных субпопуляций лимфоцитов, прогностическая значимость эффекторов врожденной и адаптивной цитотоксичности: натуральных киллеров и CD8+ Т-клеток характеризуется в литературе как однозначно позитивная, а возрастание их уровня, в т.ч. в микроокружении - как прогностически благоприятное при различных опухолях [14]. Поэтому их включение в разработанный алгоритм в качестве не способствующих и, по-видимому, препятствующих рецидивированию, оказалось довольно предсказуемым. Что касается уровня IL-1β в опухоли высокой степени злокачественности, то его негативная прогностическая значимость в виде высокого уровня при неманифестированном рецидиве, возможно, связана с его провоспалительным, проангиогенным действием, способностью поддерживать рост опухолевых клеток и формировать проонкогенное микроокружение [15].
Разработанные модели были апробированы на 27 больных НМИРМП с LG- и 21 пациенте с НG-опухолью. Через 6-9 месяцев у 14 больных (52%) с LG-опухолью и у 13 пациентов (62%) с НG-опухолью был диагностирован рецидив заболевания. После применения модели среди 27 больных НМИРМП с LG-опухолью рецидив был установлен у 15 пациентов, а среди пациентов с НG-опухолью у 14 больных. Соотношение верно и для ошибочно верифицированных случаев рецидивов позволило определить эффективность прогноза. Среди больных НМИРМП с LG-опухолью диагностическая чувствительность составила 86%, а специфичность 77%, диагностическая точность 81%. Среди больных НМИРМП с НG-опухолью диагностическая чувствительность составила 92%, а специфичность 75%, диагностическая точность 86%. Таким образом, прогноз рецидива НМИРМП с опухолью низкого и высокого злокачественного потенциала по разработанным авторами моделям подтвердил их высокую эффективность.
Заключение
Итак, разработанные на основании исследования иммунного микроокружения НМИРМП прогностические алгоритмы для опухолей высокой и низкой степени злокачественности позволяют выбрать наиболее значимые показатели для прогноза раннего рецидивирования и получить их количественные характеристики, которые могут найти применение в онкоурологической клинике.



