Меланома кожи (МК) – одно из наиболее агрессивных злокачественных новообразований кожи, плохо поддающееся лечению и характеризующееся высокой устойчивостью к современной противоопухолевой терапии [1]. В последние годы отмечается формирование новых терапевтических подходов к лечению агрессивных опухолей, включая меланому кожи, особенно ее диссеминированные формы, которые остаются злокачественным новообразованием с крайне неблагоприятным исходом. МК характеризуется выраженными эпигенетическими изменениями, одним из которых является нарушение экспрессии микроРНК [2].
МикроРНК — малые некодирующие молекулы РНК (нкРНК) длиной 18–25 нуклеотидов, которые регулируют экспрессию генов. Согласно литературным данным, по ранее проведенным исследованиям известно, что повышенная экспрессия микроРНК miR-204-5p повышает миграционную активность клеток, вызывает усиление инвазии и, в конечном итоге, способствует метастазированию опухолевых клеток [3]. Одновременно высокие уровни miR-204-5p в опухолевых клетках МК связывают с онкосупрессорной функцией. И в то же время известно, что нарушенная экспрессия miR-204-5p ассоциирована с развитием резистентности к селективным ингибиторам BRAF – одного из ключевых онкогенов, мутации которого наблюдаются при меланоме [4]. Имеющиеся исследования показывают крайне важную роль микроРНК miR-204-5p в регуляции прогрессии опухоли, в том числе при диссеминированной форме меланомы кожи, что позволяет предположить значимость данной микроРНК в качестве возможного диагностического, прогностического маркера или в качестве терапевтической мишени при МК [5]. Учитывая эти данные, целевое воздействие на микроРНК может быть применено для регуляции процессов, связанных с канцерогенезом [6].
Целью данного исследования являлось определение путем постановки ПЦР, уровней экспрессии генов-мишеней микроРНК miR-204-5p BCL2, SIRT1 в паренхиматозных органах и опухолевом узле после введения специфического ингибитора микроРНК miR-204-5p.
Материал и методы исследования
Эксперименты с животными проводились в соответствии с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, а также в соответствии с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации». Предварительно данное исследование было одобрено локальным этическим комитетом Красноярского государственного медицинского университета (протокол № 86/2018 от 8 ноября 2018г., Красноярск, Российская Федерация).
Культивирование клеток меланомы и имплантация опухоли
Замороженные клетки мышиной меланомы B16 размораживали путем помещения их в водяную баню на 1 минуту при температуре 37°C.
Концентрация жизнеспособных клеток определялась на микроскопе МИКМЕД-2 вариант 16 (ЛОМО, Санкт-Петербург, Россия) путем окрашивания их метиленовым синим в соотношении 1:1 (20 мкл метиленового синего на 20 мкл клеточный взвеси), подсчет осуществлялся в камере Горяева.
После подсчета клеток и 2-кратной обработки инъекционного поля 70%-ным спиртом лабораторным мышам в боковую поверхность передней брюшной стенки осуществляли подкожную инъекцию клеточной взвеси в объеме 0,5 мл/600 тыс. опухолевых клеток.
Ингибирование miR-204-5p in vivo
После того как клетки меланомы сформировали значимую опухоль, животные были поделены на 3 группы случайным образом. Каждой группе вводили: контрольной группе (n=10) – 0,01 М фосфатно-буферный раствор (PBS) 100 мкл; группе отрицательного контроля (n=10) – miRCURY LNA™ miRNA Negative Inhibitor Control; опытной группе (n=10) – ингибитор miR-204-5p miRCURY LNA™ microRNA inhibitor в дозировке 25 мг/кг 1 раз в 7 суток согласно инструкции производителя. Для проведения экспериментов использовали синтетический ингибитор miRCURY LNA™ (LNA-i-204-5p) microRNA inhibitor (Qiagen AB, Sollentuna, Sweden) и miRCURY LNA™ miRNA Inhibitor Control (Qiagen AB, Sollentuna, Sweden). В качестве контроля брали стерильный PBS раствор, который вводили в объеме 0,1 мл с тем же режимом введения и в то же место.
Окончание эксперимента и выделение органов
Эксперимент заканчивали на пятнадцатый день со дня первой трансплантации клеток, умерщвление животных производили под хлороформным наркозом путем декапитации шейных позвонков. Далее производилось выделение органов и тканей животных. Выделенные органы были заморожены при температуре –80°С, оставшаяся часть была стабилизирована в растворе сульфата аммония IntactRNA («Евроген», Москва, Россия) для дальнейшего исследования.
Выделение микроРНК, постановка реакции обратной транскрипции и ПЦР в реальном времени (анализ)
Выделение тотальной РНК из тканей органов и опухоли производили в ламинарных шкафах ПЦР-бокса. Предварительно фрагменты опухолевой ткани и органов гомогенизировали до однородности с добавлением лизирующего раствора из набора, предназначенного для выделения РНК/ДНК, на основе фенол-хлороформного метода «Рибо-сорб» («Амплисенс», Россия), по инструкции производителя. Концентрацию тотальной РНК и в пробах определяли на приборе-флуориметре Qubit ® 2.0 (Invitrogen; Thermo Fisher Scientific, Singapore) с использованием готовых реагентов для определения концентрации РНК Qubit ® HS (Invitrogen; Thermo Fisher Scientific, Singapore).
Далее для постановки ПЦР в режиме реального времени с целью оценки относительных уровней экспрессии генов-мишеней проводили реакцию обратной транскрипции с использованием реагентов из готовых наборов MMLV RT («Евроген», Москва, РФ) согласно прилагаемой инструкции, для обратной транскрипции использовали коммерческие случайные свободные от нуклеотидов праймеры (№ 4427975, Applied Biosystems, Foster City, USA). В каждую пробирку с раствором тотальной РНК добавляли 1,5 мкл случайного, свободного от нуклеотидов праймера для последующего определения экспрессии мРНК, далее эту смесь нагревали в термостате в течение 2 мин при температуре 70°C, после чего охлаждали на льду в течение 5 мин. Затем к полученной смеси добавляли 5,5 мкл реакционной смеси, которая состояла из 1 мкл dNTP, 1 мкл DTT, 2 мкл 5-кратного стандартного буфера, 0,5 мкл обратной транскриптазы MMLV и 1 мкл чистой от нуклеаз H2O. Полученную взвесь помещали в термостат и прогревали при температуре 37°C в течение 50 мин для проведения реакции обратной транскрипции, затем тормозили ее путем прогрева при 70°C в течение 10 мин. Образованные растворы кДНК использовали для амплификации. Объем используемой кДНК на каждый образец составлял 2 мкл. Амплификацию к ДНК осуществляли на термоциклере StepOne (Applied Biosystems, Singapore), термоциклирование проводили по стандартно заданному алгоритму: 50°C – 2 мин, 95°C – 10 мин, затем 40 циклов 95°C – 15 секунд, 60°C – 1 мин, с детекцией в реальном времени флуоресцентного сигнала ROX. Реакционная смесь на каждую реакцию имела объем 18 мкл и состояла из 1 мкл 20х-праймеров TaqMan ™ Gene Expression Assay (№ 4331182, Applied Biosystems, США) и TaqMan ™ MicroRNA & Non-coding RNA Assay (№ 4427975 и 4440886 Applied Biosystems, USA), 8 мкл 2,5-кратной реакционной смеси для ОТ-ПЦР в присутствии ROX (Syntol, Москва, Российская Федерация), а также 9 мкл воды, свободной от нуклеаз. Эндогенными нормализующими контролями для исследования уровней экспрессии мРНК бета-актин (Actb Mm00446968_m1, No. 4331182; Applied Biosystems, USA). Данные анализировали с использованием метода ΔΔCt.
Статистический анализ
Обработку данных проводили с применением программы Statistica 7.0 (StatSoft, Tulsa, USA). После проверки на нормальность применяли непараметрические критерии. Результаты представлены как средние значения и стандартные ошибки среднего (M±m).
Результаты исследования и их обсуждение
Первоначально после введения специфического ингибитора микроРНК miR-204-5p in vivo оценивалась эффективность трансфекции посредством оценки на основе ПЦР в реальном времени уровней экспрессии микроРНК miR-204-5p и ее гомолога miR-211-5p в ткани опухоли, а также в тканях легких и печени, являющихся органами-мишенями метастазирования мышиной меланомы В16. Параллельно определялись уровни экспрессии SIRT1 и BCL2 – генов-мишеней miR-204-5p.
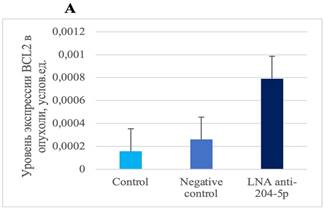
Согласно проведенному ранее биоинформатическому анализу, SIRT1 и BCL2 являются генами-мишенями miR-204-5p. Однако модуляция уровня miR-204-5p и последующего экспрессионного анализа не выявила изменений в экспрессии BCL2 и SIRT1 в ткани опухоли меланомы В16 (рис. 1).
 |
|
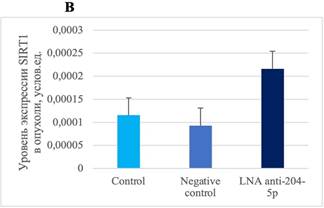 |
Рис. 1. Уровень экспрессии BCL2 и SIRT1 в клетках меланомы В16 in vivo после воздействия специфическим ингибитором miR-204-5p. А – экспрессия BCL2 (P=0,9230). B – экспрессия SIRT1 (p=0,8954)
В ткани легкого мышей, которым вводился специфический ингибитор микроРНК miR-204-5p, выявлено снижение уровней экспрессии SIRT1 по сравнению с показателями их экспрессии у животных группы негативного контроля и контроля (рис. 2).
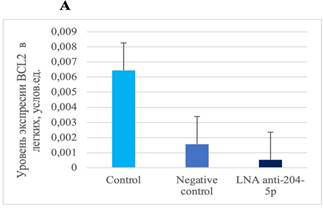
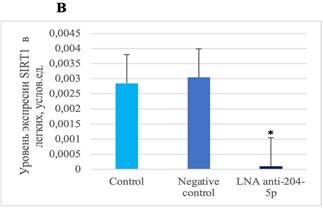
Рис. 2. А – уровень экспрессии BCL2 в легких после воздействия специфическим ингибитором miR-204-5p. B – уровень экспрессии SIRT1 ткани легкого мышей после воздействия специфическим ингибитором miR-204-5p. * p=0,0160
Определение уровней экспрессии SIRT1 и BCL2 в печени показало снижение уровня SIRT1 и BCL2 у мышей, которым проводилось введение специфического ингибитора miR-204-5p, по сравнению с показателями у группы мышей, которым осуществлялось введение негативного контроля (рис. 3).
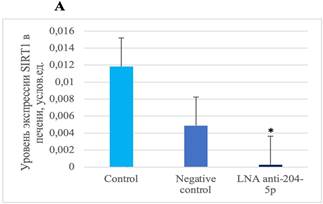
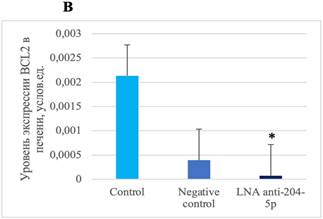
Рис. 3. Уровни SIRT1 и BCL2 в ткани печени после воздействия специфическим ингибитором miR-204-5p. А – уровень экспрессии SIRT1 * (p=0,03). В – уровень экспрессии BCL2 * (p=0,0158)
Выводы
Экспериментальное исследование, выполненное с участием мышей линии С57Bl6 с трансплантированной меланомой, которым вводился ингибитор miR-204-5p, показало, что максимальные эффекты при воздействии антисмысловыми олигонуклеотидами определяются в паренхиматозных органах. Согласно биоинформатическому и экспрессионному анализу, микроРНК miR-204-5p является регулятором BCL2 и SIRT1. В паренхиматозных органах, являющихся органами-мишенями метастазирования меланомы В16 (печени и легких), определялось изменение экспрессии BCL2 и SIRT1. Это свидетельствует, что они являются функциональными мишенями miR-204-5p в данных органах и могут быть связаны с контролем пролиферации, выживаемости, миграции опухолевых клеток и реакций иммунной системы. Стоит отметить, что снижение уровней экспрессии микроРНК miR-204-5p ведет к снижению экспрессии генов BCL2 и SIRT1 в ткани легкого, но отсутствию изменений в ткани опухоли меланомы B16, что может быть обусловлено многочисленными процессами, лежащими в основе формирования лекарственной устойчивости злокачественных новообразований, – васкулогенной мимикрией, активным выведением лекарственных веществ из опухолевых клеток, модификацией мишеневых молекул.
Дальнейшие исследования терапевтической ценности антисмысловых олигонуклеотидов, в равной степени как и таргетирования микроРНК, могут быть обусловлены возможностью применения этих подходов в экспериментальной терапии меланомы и онкологии в целом.



