Тиреоидные гормоны оказывают широкий спектр физиологических эффектов практически на все ткани и метаболические пути. Основными гормонами, вырабатываемыми щитовидной железой, являются тироксин (или тетрайодтиронин) и трийодтиронин. В клетках тиреоидные гормоны оказывают геномное действие, опосредуемое главным образом ядерными тиреоидными рецепторами, изменяющими экспрессию генов. Трийодтиронин является предпочтительным лигандом тиреоидных рецепторов, тогда как тироксин, концентрация которого в сыворотке крови в 100 раз выше, чем другого гормона щитовидной железы, подвергается экстратиреоидному превращению в трийодтиронин. Это превращение катализируется 5'-дейодиназами 1 и 2 – ферментами, активирующими тиреоидные гормоны. Регуляция дейодиназ позволяет клеточно-целенаправленно регулировать гомеостаз щитовидной железы, влияя на метаболические пути как в здоровом организме, так и при патологии [1].
Растущее число исследований выявило стимулирующий эффект тиреоидных гормонов на рост злокачественных опухолей [2, 3, 4]. В некоторых обсервационных исследованиях были получены аналогичные результаты. Например, в проспективном когортном исследовании более 10 000 участников, проведенном Sr. Khan et al. (2016), было показано, что более высокие уровни свободного тироксина были связаны с более высоким общим риском развития солидного рака (скорректированный ОР 1,42) [5]. Ассоциация была несколько ослаблена за счет пациентов, принимавших препараты, влияющие на щитовидную железу. Такое влияние обусловлено тем, что тиреоидные гормоны, специфически воздействуя на мембранные и ядерные рецепторы, приводят к активации различных канцерогенных сигнальных путей, тем самым стимулируя рост клеток, ангиогенез и ингибируя апоптоз. Например, трийодтиронин через тиреоидные рецепторы может активировать проканцерогенный сигнальный путь фосфатидилинозитол-3 киназы (PI3K), усиливая транскрипцию целевых генов и экспрессию гипоксииндуцируемого фактора, индуцируемого гипоксией, – 1-альфа (HIF-1α) [6]. Среда, адаптированная к гипоксии с активацией ангиогенеза, имеет решающее значение для роста опухолевых клеток, инвазии и метастазирования.
Различные экспериментальные модели на грызунах интенсивно используются для исследования как гипотиреоза [7], так и гипертиреоза [8, 9]. Аутоиммунный гипертиреоз моделируют путем инъекции аденовируса или плазмиды, связанных с рецептором тиреотропного гормона. Неаутоиммунные формы гипертиреоза в основном вызываются добавками искусственного тироксина, который вводится с питьевой водой в виде растворенного левотироксина или путем внутрибрюшинных инъекций [10]. Показано, что у мышей линии C57BL/6NTac, которым внутрибрюшинно вводили левотироксин в дозе 1 мкг/г массы тела в течение шести недель, наблюдался гипертиреоз [11]. Примечательно, что внутрибрюшинные инъекции левотироксина не следует делать с интервалом более 48 часов. В противном случае может возникнуть транзиторный гипотиреоз, который может быть связан с ингибированием гипофизарно-тиреоидной оси [11]. Тем не менее, гипертиреоз, вызванный экзогенным тироксином, является временным, а не постоянным, и его нельзя отделить от непрерывного приема гормонов щитовидной железы. Протоколы индукции гипертиреоза у мышей сильно различаются и в основном включают краткосрочное введение тиреоидных гормонов.
Важным аспектом моделирования опухолевого процесса и тиреоидной дисфункции является использование животных обоего пола, так как известны половые особенности тиреоидного гомеостаза и насыщенности ткани опухоли тиреоидными гормонами в динамике экспериментального опухолевого процесса [12]. Кроме этого, Эндокринное общество подчеркивает важность такой переменной, как пол животного, и необходимость учитывать его в фундаментальной науке и в клинических исследованиях [13].
Цели исследования: создание экспериментальной модели роста карциномы легких Льюиса (LLC) на фоне гипертиреоза и оценка влияния этой патологии на развитие злокачественной опухоли у мышей обоего пола.
Материал и методы исследования. Экспериментальную модель развития злокачественной опухоли в условиях гипертиреоза создавали, используя самок (n=20) и самцов (n=20) мышей линии C57BL/6, полученных из ФГБУН «Научный центр биомедицинских технологий ФМБА» (филиал «Андреевка», Московская область). Для моделирования состояния гипертиреоза животным внутрибрюшинно вводили лиотиронин натрия (Тиромель, Турция), в дозе 20 мкг на 100 г массы мыши в 0,5 мл физиологического раствора ежедневно 1 раз в сутки в течение всего эксперимента. В сыворотке крови животных определяли содержание тиреотропного гормона (ТТГ) и общих форм тиреоидных гормонов: трийодтиронина и тироксина – радиоиммунным методом с помощью стандартных наборов (Immunotech, Чехия). При получении стойкого гипертиреоза в течение 3 дней от начала введения (увеличение уровня трийодтиронина в сыворотке 5,0±2,2 нмоль/л против 1,74±0,17 нмоль/л в интактной группе) животным по стандартной методике перевивали LLC в дозе 2 млн клеток в 0,5 мл физиологического раствора (основная группа, n=24). Для этого, соблюдая все условия асептики, фиксировали мышь спиной кверху, предварительно сбрив шерсть и обработав кожу 5%-ным спиртовым раствором йода, и вводили опухолевую взвесь подкожно в обработанную кожную складку. При извлечении иглы место введения плотно прижимали ватным тампоном, смоченным в 70%-ном спирте с небольшим добавлением йода, на 1 минуту, чтобы исключить вытекание вводимой взвеси. Все манипуляции с животными производили в стерильном боксе. Инструменты, посуду, руки дезинфицировали общепринятым способом. Контролем служили мыши обоего пола с подкожной перевивкой LLC (n=16) в той же дозе и объеме, что и у животных из основной группы, но без введения экзогенного трийодтиронина. Животных декапитировали в предтерминальном состоянии. Работу осуществляли в соответствии с директивой 2010/63/ЕИ и приказом Минздрава России от 19 июня 2003 г. № 267 «Об утверждении правил лабораторной практики». Дизайн экспериментального исследования был одобрен комиссией по биоэтике ФГБУ «НМИЦ онкологии» Минздрава России (Протокол № 2/212 от 19.01.2023 г.).
Статистическую обработку полученных результатов проводили в программе STATISTICA 10.0 (StatSoft Inc., США). Проверку ряда на нормальность распределения оценивали с помощью критерия Шапиро–Уилка. Значимость различий средних независимых выборок оценивали с помощью параметрического критерия Стьюдента при равенстве дисперсий и непараметрического критерия Манна–Уитни, когда дисперсии были не равны, при количестве сравниваемых групп не более двух. Статистически значимыми считали различия при р<0,05.
Результаты исследования и их обсуждение. Результаты изучения содержания гормонов щитовидной железы в сыворотке крови экспериментальных животных представлены в таблице 1.
Таблица 1
Уровень гормонов щитовидной железы в сыворотке крови мышей обоего пола с LLC
|
Гормоны Группы |
ТТГ (мМЕ/л) |
Т4 (нмоль/л) |
Т3 (нмоль/л) |
|
самки |
|||
|
Опухоль LLC (контроль) |
0,063±0,003 |
47,1±3,2 |
1,70±0,09 |
|
Экзогенный Т3 + LLC (основная группа) |
0,003±0,000* |
58,9±4,1* |
2,67±0,03* |
|
самцы |
|||
|
Опухоль LLC (контроль) |
0,090±0,001 |
42,5±2,5 |
1,4±0,07 |
|
Экзогенный Т3 + LLC (основная группа) |
0,053±0,005* |
59,3±1,7* |
2,83±0,03* |
Примечание: Исследование проведено на момент эвтаназии. * – статистически значимые различия по сравнению с группой животных с опухолью LLC и эутиреозом соответствующего пола, р<0,05. Т4 – тироксин, Т3 – трийодтиронин, ТТГ – тиреотропный гормон, LLC – карцинома легкого Льюиса.
У самок мышей с LLC, получавших экзогенный трийодтиронин, установлено повышение в крови уровня тироксина в 1,3 раза (p<0,05), трийодтиронина в 1,6 раза (p<0,05) и снижение ТТГ в 21,0 раза по сравнению с показателями у мышей с ростом опухолей на фоне эутиреоза (табл. 1). У самцов мышей с LLC, получавших экзогенный трийодтиронин, установлено повышение уровня тироксина в 1,4 раза (p<0,05), трийодтиронина в 2,0 раза и снижение ТТГ в 1,7 раза (p<0,05) по сравнению с показателями у животных только с опухолью (табл. 1). Животные с гипертиреозом на фоне повышенного потребления еды теряли в весе, зарегистрировано ухудшение внешнего вида кожи и волосяного покрова. Шерсть была тусклая, собиралась клочьями, отмечалось ее повышенное выпадение (рис. 1, 2).

Рис. 1. Слева самец с LLC на фоне гипертиреоза, справа самец с LLC на фоне эутиреоза
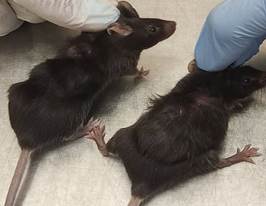
Рис. 2. Слева самка с LLC на фоне эутиреоза, справа самка с LLC на фоне гипертиреоза
Особенности роста опухолей у мышей LLC обоего пола на фоне гипертиреоза по сравнению с ростом опухолей на фоне эутиреоза представлены в таблице 2.
Таблица 2
Особенности злокачественного процесса у мышей обоего пола с LLC
|
Экспериментальные группы
Показатель |
Самцы |
Самки |
||
|
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
|
|
Выход опухолей |
на 4-е сутки |
на 3-и сутки |
||
|
У 6 из 8 (у 75%) |
У 12 из 12 (у 100%) |
У 7 из 8 (у 88%) |
У 11 из 12 (у 92%) |
|
|
Внешние некрозы |
на 13-е сутки |
на 18-е сутки |
||
|
у всех мышей в виде кровавой корки сверху, площадь большая |
у всех мышей в виде проплешин на опухолях (сбоку, где узкая часть) |
у 4 из 8 |
у 10 из 12 |
|
|
Форма опухолей |
округлая |
подковообразная |
округлая |
уплощенная |
|
Продолжительность жизни мышей |
34,9±0,5 |
27,7±0,2* |
32,8±0,1 |
27,2±0,4* |
|
Метастазы в легких (на момент эвтаназии) |
единичные |
множественные |
умеренное количество |
множественные |
Примечание: * – статистически значимые различия по сравнению с показателями у животных контрольной группы (с LLC), p<0,05. Т3 – трийодтиронин, LLC – карцинома легкого Льюиса.
Результаты наблюдения показали более активный рост подкожных опухолевых узлов у самок контрольной группы (рост опухоли на фоне эутиреоза) на начальном этапе – 5-е сутки от момента перевивки: объем опухолей у самок превышал объем опухолей у самцов в 10,5 раза (табл. 3). Однако начиная уже с 7-х суток и до 28-х суток включительно объем подкожных опухолей у самцов контрольной группы становился больше, чем у самок: на 7-е сутки в 2,0 раза, на 11-е сутки в 10,8 раза, на 14-е сутки в 5,5 раза, на 18-е сутки в 4,7 раза, на 21-е сутки в 3,6 раза, на 25-е сутки в 2,6 раза, на 28-е сутки в 1,5 раза (р<0,05) (табл. 3). Динамика объема опухоли в основной группе (рост опухоли на фоне гипертиреоза) свидетельствовала об активации злокачественного процесса под влиянием гипертиреоза на всех этапах исследования и у самцов, и у самок мышей. На всех этапах злокачественного роста у мышей обоего пола с LLC и избытком трийодтиронина объем опухолей был статистически значимо больше: у самцов – на 5-е сутки в 3,9 раза, на 7-е сутки в 1,4 раза, на 11-е сутки в 1,5 раза, на 14-е сутки в 1,4 раза, на 18-е и 21-е сутки в 1,3 раза, на 25-е сутки в 2,1 раза, на 28-е сутки в 1,7 раза; у самок – на 7-е сутки в 1,1 раза, на 11-е сутки в 3,6 раза, на 14-е сутки в 2,1 раза, на 18-е и 21-е сутки в 2,2 раза, на 25-е сутки в 2,4 раза, на 28-е сутки в 1,7 раза (табл. 3). Следовательно, в период с 11-е по 21-е сутки после перевивки у самок с гипертиреозом наблюдалось более быстрое увеличение объема опухолей по сравнению с контролем, чем у самцов. Возможно, причина этой особенности связана с бóльшими объемами опухолей у самцов. Некрозы кожи над опухолями визуализировались у всех самцов основной и контрольной группы уже через 2 недели от момента перевивки опухолевого материала, у самок – на 5 дней позже и не у всех животных: у 50% самок контрольной группы и у 83% самок основной группы (табл. 2).
Таблица 3
Динамика объема подкожных опухолевых узлов (см3) у мышей обоего пола с LLC
|
Экспериментальные группы
Сутки после перевивки опухоли |
Самцы |
Самки |
||
|
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
|
|
5-е сутки |
0,02±0,007 |
0,09±0,05* |
0,21±0,08 |
0,15±0,05 |
|
7-е сутки |
0,30±0,07 |
0,42±0,11* |
0,15±0,06 |
0,19±0,03* |
|
11-е сутки |
3,35±0,60 |
5,10±0,30* |
0,31±0,08 |
1,13±0,25* |
|
14-е сутки |
4,60±0,66 |
6,26±0,30* |
0,83±0,19 |
1,70±0,39* |
|
18-е сутки |
4,97±0,51 |
6,51±0,50* |
1,05±0,25 |
2,26±0,36* |
|
21-е сутки |
9,37±1,09 |
12,42±0,57* |
2,58±1,10 |
5,69±0,60* |
|
25-е сутки |
6,74±0,62 |
13,88±0,42* |
2,57±0,42 |
6,24±0,61* |
|
28-е сутки |
9,50±1,68 |
15,87±0,34* |
6,44±1,09 |
10,91±0,95* |
|
32-е сутки |
11,48±0,54 |
– |
9,23±0,71 |
– |
Примечание * – статистически значимые различия по сравнению с эутиреоидными животными соответствующего пола, р<0,05
Заключение. Созданная экспериментальная модель влияния гипертиреоза на развитие злокачественной опухоли – карциномы легкого Льюиса у мышей линии C57Bl/6 обоего пола – вызывает стимуляцию роста подкожных опухолей, усиление метастазирования в легкие и уменьшение продолжительности жизни животных, то есть увеличение злокачественного потенциала опухолей. Разработанная модель дает возможность изучать патогенетические механизмы развития злокачественной опухоли на фоне гипертиреоза как коморбидной патологии, а также проводить поиск эффективных воздействий на опухоль. Причем у самок течение злокачественного процесса на фоне гипертиреоза имеет отличные от самцов особенности, что требует дальнейших исследований.



