Несмотря на значительное количество работ, посвященных профилактике спаечного процесса в послеоперационном периоде, данная проблема пока еще далека от полного решения и требует дальнейшего изучения [1, 2]. Спаечный процесс после внутриполостного хирургического вмешательства может приводить к различным серьезным осложнениям, таким как спаечная кишечная непроходимость, удлинение времени повторной операции, а в гинекологии – приводить к бесплодию и гидросальпинксу [3]. Поэтому в оперативной гинекологии большое внимание уделяется профилактике образования спаек [4, 5], так как при бесплодии, вызванном спаечным процессом, единственным методом восстановления репродуктивной функции является экстракорпоральное оплодотворение [6]. Для профилактики спаечного процесса в послеоперационном периоде на данный момент времени применяют различные барьерные методы (мезогель, полаксомер и др.) [7, 8, 9], фармакологические методы –нестероидные и стероидные противовоспалительные препараты, фибринолитические вещества, иммуномодуляторы, противоопухолевые препараты и клеточные технологии [10, 11]. В настоящий момент глубокое изучение патофизиологииспаечного процесса показало многофакторность природы и участие клеточных и молекулярных модуляторов адгезии, что позволяет разрабатывать новые виды превентивного влияния на спайкообразование [12, 13, 14]. До настоящего времени отсутствует единое мнение о реакции локальных лимфоидных элементов при формировании перитонеальных спаек, не определена значимость тканевых иммунологических изменений в избыточном адгезиогенезе при воспалительных заболеваниях и после оперативных вмешательств на органах малого таза [15].
Цель исследования – оценить эффект Дерината®в модуляции реакций иммунокомпетентных клеток париетальной брюшины и периметрия при спаечном процессе в малом тазу у крыс в эксперименте.
Материал и методы исследования. Поисковый эксперимент проводился на 90 лабораторных животных – белых нелинейных крысах средней массой 280±30 г, содержащихся в обычных условиях вивария Медицинской академии им. С.И. Георгиевского. Исследования на животных проводились в соответствии с правилами проведения работ и содержания животных (приказ Минздрава РФ от 01.04.2016 г.№199н «Об утверждении правил надлежащей лабораторной практики»), а также с международными правилами «Guide for the Care and Use of Laboratory Animals, 2011» при свободном доступе к комбинированному корму и воде. Исследование одобрено локальным этическим комитетом ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского». Нами были сформированы три группы по 30 животных в каждой: 1-я группа – контрольная, которая послужила нормой для изучаемых показателей; 2-я группа – крысам моделировали спаечный процесс в малом тазу и животные не получали какого-либо лечения; 3-я группа – животным с моделью послеоперационного спаечного процесса в тазу на протяжении 10 суток Деринат® 1,5% («Техномедсервис», Россия) вводился внутримышечно в объеме 1,0 мл. В качестве средства для наркоза на всех инвазивных этапах эксперимента использовали калипсола 5% в дозе 0,01 мл («Гедеон Рихтер», Венгрия) в сочетании с ксилазином 2% в дозе 0,01 мл («Алфасан Интернэшнл БВ», Нидерланды). Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы) и угнетению роговичного рефлекса. Спаечный процесс в малом тазу моделировали у крыс под наркозом путем перевязки рогов матки с двух сторон из расчета на 100 г массы тела животного. Забор спаек производили на 28-е сутки после моделирования спаечного процесса, т.е. в фазу зрелых сращений.
Иммуногистохимическое исследование ткани спаек проводили по стандартизованной методике с использованием серийных парафиновых срезов толщиной 3–5 мкм, помещенных на адгезивные стекла, покрытые полизином (Menzel-Glaser, Германия), и реактивов компании DAKO с моноклональными мышиными антителами CD4 (Clone 4B12 Ready-to-Use), CD8 (Clone C8/144B Ready-to-Use), CD56 (Clone L26 Ready-to-Use), CD 138/syndecan-1 (Clone MI15 Ready-to-Use), и системы визуализации Novocastra Novolink TM на основе компактного полимера Novolink Compact Polymer™ (Leica, Германия) на иммуногистостейнере Bond Max (Leica, Германия). В стандартную методику входило использование негативного и позитивного контроля.
Морфометрическое исследование включало измерение количества позитивно окрашенных клеток в 10 произвольно выбранных полях зрения при увеличении 400 при иммуногистохимическом окрашивании с лимфоцитарными маркерами CD4, CD8, CD56, CD138 с помощью программы Software DP-SOFT и последующую статистическую обработку.
Просмотр и фотографирование микропрепаратов осуществляли цифровой камерой OLYMPUS C 5050Z, установленной на микроскопе «Olympus CX-41».
Статистическая обработка данных выполнена с помощью пакета прикладных программ «Statistica for Windows» v. 7.0, Stat SoftInc. Проверку данных на нормальность распределения осуществляли с помощью критериев Shapiro–Wilk.
Оценку величин, подлежащих анализу, проводили путем расчета среднего арифметического признака (X) и его стандартного отклонения (SD). Сравнение между группами проводили непараметрическими методами с использованием критерия Манна–Уитни. Статистически значимыми считались отличия при р<0,05 (95%-й уровень значимости) и при р<0,01 (99%-й уровень значимости).
Результаты исследования и их обсуждение. У животных контрольной группы в париетальной брюшине (ПБ) обнаружили незначительное количество клеток с экспрессией маркеров CD4+ (1,20 в поле зрения), CD8+ (4,00 в поле зрения) и CD138+ (5,90 в поле зрения), располагающихся рядом с сосудами гемомикроциркуляторного русла и мезотелием. CD138+ (syndecan-1) – высокоспецифичный маркер плазматических клеток, мембранный протеогликан, функционирующий как рецептор для внеклеточного матрикса, а также представлен на поверхности эндотелиальных клеток. Клетки, экспрессирующие CD138+, присутствуют в ПБ, являясь источником фонового уровня сывороточного IgM (0,6–3,7 г/л).
Учитывая, что CD8+ является трансмембранным белком, ко-рецептором Т-лимфоцитов и экспрессируется на Т-лимфоцитах-супрессорах, логичным видится наличие клеток с таким иммунофенотипом в париетальной брюшине, где они могут контролировать (тормозить) выработку антител (различных классов) вследствие задержки пролиферации и дифференцировки В-лимфоцитов в плазмоциты. Доминирование экспрессии CD8+ над таковой CD4+ (4,00/1,20) в контрольной группе свидетельствует об отсутствии антигенной нагрузки и торможении реакций клеточного и гуморального иммунитета.
В периметрии (ПМ) животных контрольной группы не было обнаружено положительно-окрашенных клеток изучаемого иммунофенотипа, кроме единичных клеток, экспрессирующих CD138+(среднее количество клеток в поле зрения составило 5,9), которые, вероятнее всего, формируют эффекторное звено иммунной памяти.
После оперативного вмешательства у животных в париетальной брюшине выявили увеличение численности клеток, позитивно экспрессирующих CD4+ и CD138+, появление CD56+-клеток (табл. 1), вследствие чего по численности позитивно меченых клеток экспрессируемые маркеры расположились в ряд: CD138+> CD8+> CD4+> CD56+. Двукратный прирост CD4+ клеток (вероятно,Th1) на фоне незначительно сниженной численности CD8+ клеток по сравнению с контролем в данном случае может сопровождаться стимулирующим влиянием на фибробласты и фибриллогенез, способствующие спайкообразованию. В париетальной брюшине у крыс на фоне появления единичных клеток, позитивно экспрессирующих CD56+, обнаружили увеличение численности CD138-клеток до 10,00 в поле зрения и CD4+-клеток до 2,55 в поле зрения, что свидетельствует об активации гуморального звена иммунных реакций. Увеличение количества CD138+ по сравнению с контролем может отражать повышенную миграцию в соединительные ткани плазматических клеток, покинувших лимфоидные фолликулы, которые часто появляются в результате дифференцировки В-2-клеток по экстрафолликулярному пути.
Таблица 1
Иммунофенотипическая характеристика распределения лимфоидных клеток в париетальной брюшине после оперативного вмешательства и лечения Деринатом®
|
Фенотип клеток
|
Средние значения количества клеток в поле зрения, М, X ±SD |
U-критерий Манна–Уитни |
Уровень статистической значимости |
|
|
Без лечения
|
Лечение Деринатом®
|
|||
|
CD4+ |
2,55±0,15 |
9,55±0,12 |
290 |
p=0,008 |
|
CD8+ |
3,55±0,13 |
2,55±0,13 |
594 |
p=0,133 |
|
CD56+ |
1,80±0,14 |
5,20±0,10 |
742 |
p=0,505 |
|
CD138+ |
10,00±0,16 |
13,00±0,11 |
311 |
p=0,036 |
В группе животных, получавших Деринат® в послеоперационном периоде, по сравнению с контролем значимо возросли популяции CD4+-клеток (в 7,95 раза), CD56+-клеток (5,20 в поле зрения) и CD138+-клеток (в 2,2 раза) (табл. 2), количественный ряд клеток, экспрессирующих исследованные маркеры, принимал вид: CD138+> CD4+> CD56+> CD8+. Данные изменения клеточного состава париетальнойбрюшины следует трактовать как активацию клеточного и гуморального иммунитета.
Таблица 2
Иммунофенотипическая характеристика распределения лимфоидных клеток в периметрии после оперативного вмешательства и лечения Деринатом®
|
Фенотип клеток
|
Средние значения количества клеток в поле зрения, М, X ±SD |
U-критерий Манна–Уитни |
Уровень статистической значимости |
|
|
Без лечения
|
Лечение Деринатом®
|
|||
|
CD4+ |
2,75±0,11 |
8,00±0,14 |
173 |
p=0,008 |
|
CD8+ |
2,20±0,10 |
1,70±0,18 |
619 |
p=0,861 |
|
CD56+ |
2,10±0,13 |
4,10±0,12 |
307 |
p=0,022 |
|
CD138+ |
8,90±0,12 |
11,25±0,15 |
226 |
p=0,007 |
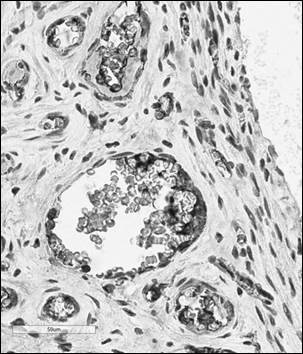
В периметрии прооперированных животных по численности позитивно меченых клеток экспрессируемые маркеры принимали вид: CD138+> CD4+> CD8+> CD56+, были отмеченыувеличение численности клеток, позитивно экспрессирующих CD4+ и CD138+, появление CD56+-клеток (табл. 1,2, рис. 1).
|
а
|
|
б
|
|
в
|
|
г
|
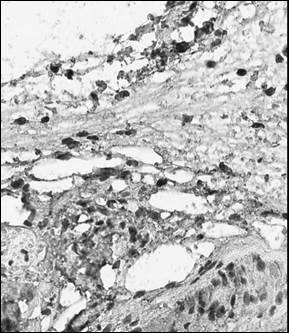
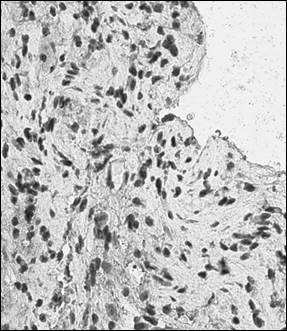
Рис. 1. Иммуногистохимический анализ парафиновых срезов париетальной брюшины (а, б) и периметрия крысы (в, г) с использованием антител к CD4+ (а, в, ×400), CD138+ (б, г, ×400) после лечения Деринатом®
В периметрии у крыс на фоне появления единичных клеток, позитивно экспрессирующих CD56+, обнаружили увеличение средней численности CD138+-клеток до 8,90 в поле зрения и CD4+-клеток до 2,55 в поле зрения, что свидетельствует об активации гуморального звена иммунных реакций. Количественный ряд клеток, экспрессирующих исследованные маркеры, принимал вид: CD138+> CD4+> CD8+> CD56+. При этом популяция CD8+ статистически не значимо отличалась от таковой до операции. В группе животных, получавших Деринат® в послеоперационном периоде, в ПБ по сравнению с контролем значимо возросли популяции CD4+-клеток (в 7,95 раза), CD56+-клеток (5,20 в поле зрения) и CD138+-клеток (в 2,2 раза) (рис. 2). По численности позитивно меченых клеток экспрессируемые маркеры принимали вид: CD138+> CD56+> CD4+> CD8+. Для периметрия было характерно аналогичное распределение клеток в количественном ряду: CD138+> CD56+> CD4+> CD8+, что было обусловлено увеличением численности CD138+-клеток (11,25 в поле зрения), CD4+-клеток (в 6,67 раза по сравнению с контролем) и CD56+-клеток (в 2 раза по сравнению с таковыми без лечения Деринатом®). Данные изменения клеточного состава ПБ следует трактовать как активацию клеточного и гуморального иммунитета, сходную с таковой в париетальной брюшине.
|
a
|
|
б
|
|
в
|
||
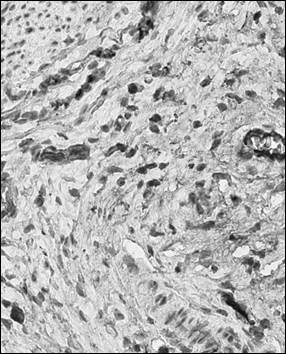
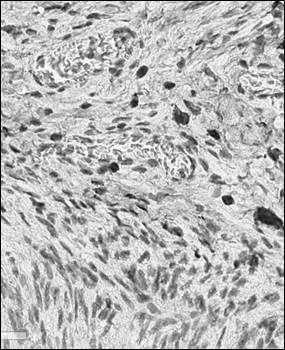
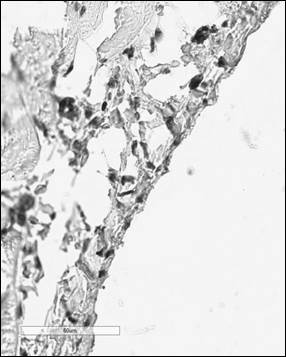
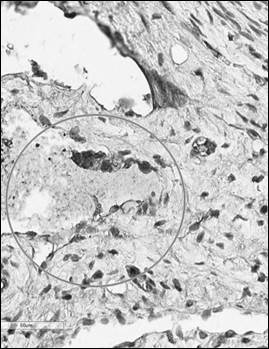
Рис. 2. Иммуногистохимический анализ парафиновых срезов париетальной брюшины с использованием антител к CD56+ у крысы в контроле (а), после операции (б) и в периметрии крыс после лечения Деринатом® (в), ×400
Обращает на себя внимание сходная реакция различных фенотипов иммунокомпетентных клеток в париетальной брюшине и периметрии при использовании Дерината® в послеоперационном периоде. В обоих случаях наибольшая степень прироста отмечалась в численности CD4+.Судя по возрастающей динамике количества CD56+ и CD138+, можно предположить доминирование Th2 фенотипа CD4+, который секретирует интерлейкины 4, 5, 10, 13 и таким способом регулирует пролиферацию и дифференцировку лимфоцитов иных фенотипов. Интерлейкин 10 продуцируется не только Т-хелперами 1-го и 2-го типа (Th1 и Th2), но также макрофагами и цитотоксическими клетками (CD56+), оказывая выраженный иммуносупрессивный эффект, снижая пролиферативную активность Т-клеток и функциональную активность моноцитов/макрофагов. Иммуносупрессивный эффект цитокина, очевидно, компенсирует снижение численности клеток CD8+ фенотипа у крыс обеих экспериментальных групп по сравнению с контролем. При этом роль фактора, стимулирующего дифференцировку CD56+, может выполнять интерлейкин 10, что проявляется значимым приростом клеток данного фенотипа у крыс, леченных Деринатом® в послеоперационном периоде. Отражением смещения дифференцировки CD4+ в направлении Th2 может служить увеличение популяции CD138+-клеток, кофактором пролиферации которых является секретируемый Th2-клеткми интерлейкин 4. CD138+ – плазматические клетки, образующиеся либо в ответ на TI-антигены (потомки В-1-клеток), либо в результате дифференцировки В-2-клеток по экстрафолликулярному пути. Последние способны развиваться под действием клеточных факторов микроокружения (аутоагрессивные клоны Т-лимфоцитов, экспрессирующие CD40, или Th2, секретирующие интерлейкины 4 и 5).
Заключение. Таким образом, судя по экспрессии иммуноцитохимических маркеров, в контрольной группе крыс имеются различия клеточного состава лейкоцитов в париетальной брюшине и периметрии. После оперативного вмешательства спаечный процесс вызывает изменение в соотношении субпопуляций лейкоцитов в области поражения в сторону увеличения числа CD4+, CD56+ и CD138+-клеток в большей степени в париетальной брюшине, чем в периметрии. Применение Дерината® оказывает иммуномодулирующий эффект путем перераспределения численности различных фенотипов иммунокомпетентных клеток в соединительных тканях малого таза, что может быть обусловлено изменением секреции регуляторных цитокинов 4 и 10. Установление роли различных фенотипов лимфоцитов соединительнотканных послеоперационных спаек в регуляции локального иммунного статуса путем секреции цитокинов требует проведения дальнейших исследований.