Острый панкреатит (ОП) остается одним из самых распространенных ургентных хирургических заболеваний в специализированных стационарах, и доля пациентов с этой патологией с каждым годом только возрастает. У 70–75% больных ОП имеет алкогольно-алиментарную этиологию. Большинство случаев ОП, примерно 80%, протекает в легкой форме, но у каждого пятого пациента диагностируется некроз поджелудочной железы, сопряженный с риском развития соматических системных осложнений и синдрома полиорганной недостаточности [1-3]. При инфицировании перипанкреатических объемных образований у больных панкреонекрозом (ПН) фатальный исход фиксируется у 50–80% пациентов [4-7]. Но и при асептическом течении ПН из-за развития органных и полиорганных дисфункций летальность может достигать 20–30% наблюдений.
Ключевая роль в развитии органной дисфункции, по мнению многих исследователей, принадлежит синдрому системного воспалительного ответа (ССВО). На фоне выброса в кровь большого количества провоспалительных цитокинов происходит нарушение системы гемостаза, что сопровождается снижением перфузии не только поджелудочной железы, но и других органов, повышением риска тромбоэмболических осложнений [8-10]. Направлениями снижения выраженности ССВО являются снижение травматичности или отказ от хирургического вмешательства. Доказано, что максимальная отсрочка и использование малоинвазивных технологий снижают риск осложненного течения ПН, что благоприятно отражается как на исходе лечения, так и на длительности госпитализации больных [11-13].
Для снижения риска развития системных осложнений предлагаются различные варианты консервативной терапии и эндоскопической коррекции желчной и панкреатической гипертензии. Но до настоящего времени нет единого подхода к целесообразности и срокам выполнения стентирования главного панкреатического протока (ГПП) для снижения риска органных дисфункций [14].
Цель исследования заключалась в установлении связи раннего стентирования главного панкреатического протока с осложненным течением алкогольно-алиментарного панкреонекроза (ААПН).
Материал и методы исследования
На базах кафедры анестезиологии и реаниматологии, трансфузиологии и скорой медицинской помощи Института НМФО ФГБОУ ВО ВолгГМУ Минздрава РФ проведено сравнительное когортное исследование. Была изучена архивная медицинская документация с января 2019 года по декабрь 2023 года, при анализе которой были выявлены 423 пациента с алкогольно-алиментарным панкреонекрозом.
Первоначально были определены критерии включения и критерии исключения. Критерии включения:
– алкогольно-алиментарный панкреонекроз;
– возраст больных более 18 лет.
Критерии исключения:
– интоксикационный шок;
– летальный исход в первые 10 суток госпитализации;
– перевод больного в другие лечебные учреждения.
Из исследования были исключены девять пациентов. У пяти больных был диагностирован интоксикационный шок, два пациента были переведены в другое лечебное учреждение, летальный исход в первые 10 дней госпитализации зафиксирован у двух пациентов. При окончательном анализе были проанализированы результаты лечения 414 больных ААПН.
В основную группу (n=96) были включены больные, которым в течение первых 72 часов госпитализации было выполнено стентирование ГПП, а в контрольную группу (n=318) – пациенты, у которых этот метод эндоскопической коррекции панкреатической гипертензии не использовался.
Первичной конечной точкой считали развитие соматического системного осложнения (острого повреждения почек (ОПП), острого респираторного дистресс-синдрома (ОРДС), синдрома кишечной недостаточности (СКН) или синдрома полиорганной недостаточности (СПОН)) в первую фазу панкреонекроза, которое определяли с учетом соответствующих клинических рекомендаций.
Статистический анализ полученных результатов проводили с использованием программы IBM SPSS Statistics 26. При проверке соответствия количественных переменных распределению Гаусса применяли критерий Колмогорова–Смирнова. Для описательной статистики вычисляли процентное соотношение и среднее значение со стандартным отклонением (М(SD)). При сравнении основной и контрольной групп использовали t-критерий Стьюдента для количественных значений и χ2 Пирсона для качественных переменных. Бинарный логистический регрессионный анализ применяли для вычисления модели прогнозирования шанса развития СПОН. ROC-анализ применяли для оценки чувствительности и специфичности теста и его валидности. Различие сравниваемых групп считали статистически значимым при p≤0,05.
Принцип проведения этого исследования соответствовал этическим принципам Хельсинкской декларации Всемирной медицинской ассоциации (2008 г.) и соглашения по Надлежащей клинической практике (ICH GCP). Исследование было одобрено локальным этическим комитетом ФГБОУ ВО ВолгГМУ (протокол № 003-2019, экспертное заключение № 003/8).
Результаты исследования и их обсуждение
Прежде всего, была определена сопоставимость групп, для чего был проведен сравнительный анализ изученных переменных пациентов основной и контрольной групп.
По всем исследованным переменным группы сравнения были сопоставимы, что исключало систематическую ошибку. Статистически значимого различия не выявлено по возрасту (p=0,052) и полу (p=0,054), характеру сопутствующей патологии (p=0,087–0,844) и лабораторным показателям (p=0,114–0,723) (табл. 1).
Таблица 1
Сравнительный анализ переменных пациентов групп исследования
|
Показатель |
Число больных, n=414 |
χ2 Пирсона / t-критерий Стьюдента |
||
|
ОГ, n=96 |
КГ, n=318 |
Значение |
p |
|
|
Возраст, лет M±SD |
52,4±12,1 |
48,4±18,7 |
1,950 |
0,052 |
|
Женщина, n (%) |
27 (28,1) |
126 (39,6) |
3,705 |
0,054 |
|
Мужчина, n (%) |
69 (71,9) |
192 (60,4) |
||
|
Индекс массы тела, кг/м2 M±SD |
25,6±3,3 |
25,7±4,6 |
-0,089 |
0,929 |
|
SOFA, у.е. M±SD |
10,2±2,9 |
10,3±3,2 |
-0,493 |
0,622 |
|
Ишемическая болезнь сердца, n (%) |
28 (29,2) |
98 (30,8) |
0,095 |
0,758 |
|
Постинфарктный кардиосклероз, n (%) |
5 (5,2) |
15 (4,7) |
0,039 |
0,844 |
|
Гипертоническая болезнь, n (%) |
48 (50,0) |
134 (42,1) |
1,850 |
0,174 |
|
Сахарный диабет 2-го типа, n (%) |
8 (8,3) |
32 (10,1) |
0,253 |
0,615 |
|
ХОБЛ, n (%) |
11 (11,5) |
44 (13,8) |
0,362 |
0,547 |
|
Ожирение, n (%) |
3 (3,1) |
29 (9,1) |
2,922 |
0,087 |
|
Желтуха, n (%) |
37 (38,5) |
111 (34,9) |
0,424 |
0,515 |
|
Лабораторные показатели: |
||||
|
Гемоглобин, г/л M±SD |
140,6±22,1 |
135,9±21,2 |
1,585 |
0,114 |
|
Лейкоциты, ×109 M±SD |
12,6±4,7 |
12,3±5,3 |
0,431 |
0,667 |
|
Тромбоциты, ×109 M±SD |
221,1±72,2 |
232,3±90,1 |
-0,547 |
0,585 |
|
Мочевина, ммоль/л M±SD |
7,1±3,4 |
6,9±3,4 |
0,431 |
0,667 |
|
Креатинин, мкмоль/л M±SD |
79,3±16,6 |
80,9±42,4 |
-0,355 |
0,723 |
|
Билирубин, мкмоль/л M±SD |
34,7±5,1 |
33,0±3,4 |
0,440 |
0,660 |
|
ФНО-α, пг/мл M±SD |
14,8±4,1 |
13,2±2,2 |
1,106 |
0,269 |
|
С-реактивный белок, мг/л M±SD |
23,1±11,2 |
23,2±18,1 |
-0,031 |
0,975 |
Примечание: ОГ – основная группа; КГ – контрольная группа; SOFA– тяжесть состояния пациента; ХОБЛ – хроническая обструктивная болезнь легких; ФНО-α – фактор некроза опухоли альфа.
Влияние раннего стентирования ГПП на частоту развития системных осложнений показано на рисунке 1.
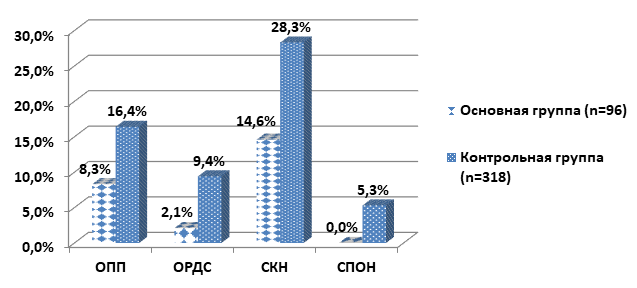
Рис. 1. Частота развития системных осложнений у пациентов основной и контрольной групп
У пациентов после раннего стентирования ГПП по сравнению с больными контрольной группы значительно реже диагностировали ОПП (8,3% vs 16,4%; χ2=3,826, p=0,050), ОРДС (2,1% vs 9,4%; χ2=5,586, p=0,019), СКН (14,6% vs 28,3%; χ2=7,378, p=0,007) и СПОН (0,0% vs 5,3%; χ2=5,352, p=0,021) в первые две недели заболевания.
Для определения зависимости вероятности развития ОПП, ОРДС и СКН от раннего стентирования ГПП был проведен бинарный логистический регрессионный анализ. Доказано, что раннее стентирование ГПП снижало шансы развития ОПП в 2,2 раза (Exp (B) = 0,446), ОРДС – в 3,4 раза (Exp (B) = 0,292) и СКН – в 2,5 раза (Exp (B)=0,397). Данные модели были статистически значимыми (p<0,05).
Но наиболее тяжелым осложнением первой фазы ПН был синдром полиорганной недостаточности. Зависимость частоты развития СПОН от эндоскопической тактики, возраста и пола пациента показана в таблице 2.
Таблица 2
Зависимость частоты развития СПОН от эндоскопической тактики, возраста и пола пациента (логистический регрессионный анализ)
|
Модель |
Сводка для модели |
|||||||
|
|
χ2 |
p |
R2 Нэйджелкерка |
|||||
|
|
46,862 |
<0,001 |
0,369 |
|||||
|
|
Переменные в уравнении |
|||||||
|
|
B |
SD |
Вальд |
p |
Exp(B) |
95% ДИ |
||
|
Возраст |
0,094 |
0,021 |
19,588 |
0,000 |
1,098 |
1,05–1,15 |
||
|
Пол |
–0,891 |
0,551 |
2,611 |
0,106 |
0,410 |
0,14–1,21 |
||
|
Стентирование ГПП |
–17,888 |
3785,105 |
0,000 |
0,996 |
0,000 |
0,000 |
||
|
Константа |
–7,347 |
1,716 |
18,331 |
0,000 |
0,001 |
|
||
Примечание: R2a – R-квадрат Кокса и Снелла; R2b – R-квадрат Нэйджелкерка.
Чтобы определить вероятность развития СПОН, необходимо воспользоваться формулой:
p = 1 / (1 + e-z) * 100%, где z = –7,347 + В*0,094 – Пол*0,891 – СГПП*17,888 (p – вероятность развития ГСО, В – возраст (годы), Пол – пол пациента (мужчина = 1, женщина = 0), СГПП – стентирование главного панкреатического протока (да = 1, нет = 0).
Представленная модель была статистически значимой, и, исходя из значений коэффициента детерминации Нэйджелкерка, она определяла 36,9% дисперсии шанса развития синдрома полиорганной недостаточности. Исходя из значения экспоненты регрессионных коэффициентов (Exp(B)), увеличение возраста на 1 год и мужской пол повышали шансы развития СПОН в 1,1 раза и в 2,4 раза соответственно. После раннего стентирования ГПП не было ни одного случая развития СПОН. Также были определены специфичность (88,4%) и чувствительность (82,4%) модели.
С помощью ROC-анализ была определена взаимосвязь между прогностической вероятностью и реальной частотой развития СПОН у пациентов данной выборки (рис. 2).
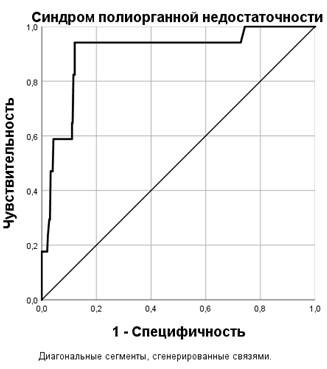
Рис. 2. ROC-кривая взаимосвязи между расчетным шансом и реальной частотой развития СПОН у больных общей выборки
Площадь под ROC-кривой, соответствующей взаимосвязи реальной частоты развития и расчетного шанса развития СПОН по предложенной формуле, составила 0,903±0,04 (95% ДИ 0,822–0,983, p<0,001). Полученный результат был статистически значимым (p<0,001). Для вычисления порогового значения расчетного шанса развития СПОН была определена точка отсечения, которая соответствовала уровню в 9,1%. Если у пациента определялся расчетный риск развития СПОН выше 9,1%, то у него прогнозировался высокий риск развития этого осложнения. Определены высокая чувствительность (94,1) и специфичность (87,9%) данного теста.
По результатам нашего исследования значимое снижение частоты развития ОПП, ОРДС, СКН и СПОН было связано с меньшей выраженностью ССВО у больных основной группы после стентирования ГПП. Если при поступлении в стационар уровень ФНО-α и С-реактивного белка был соизмерим (14,8±4,1 vs 13,2±2,2 пг/мл (p=0,269) и 23,1±11,2 vs 23,2±18,1 мг/л (p=0,975) соответственно), то через трое суток у пациентов контрольной группы он был достоверно выше (28,3±4,9 vs 13,8±8,5 пг/мл (t=5,202; p<0,001) и 51,1±9,8 vs 31,2±8,7 мг/л (t=3,725; p<0,001) соответственно).
Сравнительный анализ длительности госпитализации и летальности групп сравнения показан в таблице 3.
Таблица 3
Сравнительный анализ длительности госпитализации и летальности групп сравнения
|
Показатель |
Число больных, n=414 |
χ2 Пирсона / t-критерий Стьюдента |
||
|
ОГ, n=96 |
КГ, n=318 |
Значение |
p |
|
|
Койко-день, суток M±SD |
18,7±11,8 |
30,8±9,2 |
–3,973 |
<0,001 |
|
Койко-час ПИТ, часов M±SD |
89,3±68,0 |
152,4±76,4 |
–2,738 |
0,007 |
|
Летальный исход, n (%) |
1 (1,0) |
47 (14,8) |
13,578 |
<0,001 |
Примечание: ПИТ – палата интенсивной терапии.
Стентирование ГПП в течение первых 72 часов госпитализации способствовало достоверному снижению длительности госпитализации в стационаре (с 30,8±9,2 до 18,7±11,8 суток, p<0,001) и в палатах интенсивной терапии (со 152,4±76,4 до 89,3±68,0 часов, p=0,007). Также в основной группе выявлено статистически значимое снижение летальности (с 14,8% до 1,0% случаев, p<0,001).
До настоящего времени обсуждаются целесообразность и сроки выполнения эндоскопических транспапиллярных вмешательств (ЭТПВ) у пациентов с ААПН. Многие зарубежные исследователи акцентируют внимание на увеличение потребности в расходных материалах и зависимости результатов применения ЭТПВ от опыта врача-эндоскописта [1, 4].
В данном исследовании авторами было установлено, что раннее (в течение 72 часов госпитализации) выполнение стентирования ГПП значимо снижало риск развития ОПП (в 2,2 раза), ОРДС (в 3,4 раза) и СКН (в 2,5 раза). После раннего стентирования ГПП у пациентов основной группы не было ни одного случая развития СПОН.
При этом этот профилактический эффект, на взгляд авторов данной работы, был связан со снижением выраженности синдрома системного воспалительного ответа, на что указывала динамика провоспалительных цитокинов (ФНО-α и С-реактивного белка) в основной и контрольной группах. Аналогичные результаты получены и другими исследователями. Так, М.Д. Дибиров и соавторы доказали, что стентирование ГПП значимо снижало частоту развития основных осложнений и смертность у больных ПН по сравнению с консервативной тактикой лечения [12].
Также активно обсуждаются и сроки проведения стентирования ГПП [11]. Так, H.Karjula и соавторы рекомендуют раннее его выполнение, а M. Arvanitakis и соавторы не обнаружили значимого различия между ранним и отсроченным применением этого метода коррекции панкреатической гипертензии [4, 7]. Но, как было установлено авторами в данном исследовании, стентирование ГПП для устранения панкреатической гипертензии необходимо выполнять как можно раньше, до формирования окончательной зоны некроза поджелудочной железы.
Вывод. Раннее стентирование главного панкреатического протока у больных с алкогольно-алиментарным панкреонекрозом значимо снижает шансы развития соматических системных осложнений, длительность госпитализации и летальность.



