Саркома мягких тканей (СМТ) – это злокачественная опухоль, которая образуется из клеток соединительной ткани, является очень редким биологически гетерогенным новообразованием. Доля СМТ в структуре всех онкологических заболеваний составляет около 1% [1]. СМТ может локализоваться в разных частях организма, но в 60–70% случаев опухолевые поражения развиваются в конечностях [2]. При этом установлено более 50 различных гистологических подтипов с различными биологическими и генетическими характеристиками, что затрудняет применение единого метода лечения, в том числе и химиотерапевтических препаратов [3]. Было выявлено, что в 6–10% случаев мягкотканные саркомы являются местнораспространенными [4].
Благодаря современным технологиям удалось увеличить выживаемость больных с СМТ высокой степени злокачественности до 75%. В настоящие время органосохранное лечение выполняется в 85% случаев у взрослых и в 95% случаев у детей [5]. Тем не менее после радикального проведения удаления солидных СМТ выявляются метастазы вследствие миграции опухолевых клеток в 80% случаев через лимфатическую систему и в 20% – через кровеносную систему [6]. Метастатические формы заболевания характеризуются неблагоприятным прогнозом и в большинстве случаев являются причиной смерти.
Для понимания механизма, управляющего ростом злокачественных новообразований, необходимы адекватные экспериментальные модели с характеристиками, позволяющими в дальнейшем их использовать в доклинических исследованиях [7]. Важно отметить, что такие модели имитируют ряд важных патофизиологических процессов, происходящих при росте опухоли. Более адекватной считается ксенотрансплантатная модель, которую получают как в результате инъекции суспензии опухолевых клеток человека, так и с помощью ксенотрансплантации фрагмента опухоли пациента (Patient Derived Xenograft – PDX) иммунодефицитным мышам. Доклинические исследования на подобных тест-системах наиболее предпочтительны, так как PDX наиболее точно, по сравнению с традиционными опухолевыми моделями, воспроизводят биологические характеристики и терапевтический ответ человеческих опухолей, что позволяет оптимизировать дальнейшие клинические исследования по изучению новых химиопрепаратов [2; 8; 9].
Таким образом, создание ортотопических PDX-моделей является важной научно-практической задачей. Такие модели позволяют изучать звенья онкогенеза, выявлять молекулярные маркеры-мишени и профили экспрессии генов, а также изучать влияние на опухоль микроокружения.
Цель исследования – создание ортотопической PDX-модели саркомы мягких тканей человека c прорастанием в кость.
Материалы и методы исследования
Работа была выполнена в Испытательном лабораторном центре ФГБУ «НМИЦ онкологии» Минздрава России города Ростова-на-Дону.
Для выполнения поставленной цели использовали опухолевый фрагмент, который был взят от пациента М., 67 лет, с диагнозом «саркома мягких тканей правого бедра с прорастанием в бедренную кость». От пациента было получено письменное согласие на передачу биологического материала. Гистологическое исследование фрагмента опухоли пациента: недифференцированная плеоморфная саркома с инфильтративным ростом. В опухоли отмечалось отложение атипичного остеоида, структур экстраоссальной остеосаркомы высокой степени злокачественности. Для трансплантации опухолевого фрагмента производился забор послеоперационного материала в пробирку с 20 мл раствора Хенкса для транспортировки (раствор Хенкса (HBSS, Hank's Balanced Salt Solution) + 1% пенициллина/стрептомицина + 1% амфотерицина). Полученные образцы доставлялись в SPF-зону вивария, где производилась подготовка к трансплантации – удаление транспортной среды с последующим промыванием в 5 мл стерильного раствора Хенкса.
Исследование проводилось на 18 иммунодефицитных самцах мышей линии Balb/c Nude. Возраст животных составил 6-7 недель. Животные для проведения исследования поступили из питомника лабораторных животных ИБХ РАН г.Пущино (Московская обл.). Мышей содержали в SPF-виварии (SPF – specific-pathogen-free) ФГБУ «НМИЦ онкологии» Минздрава России, в индивидуально вентилируемых клетках при температуре 21–25°С, в условиях смены освещенности день/ночь 12 ч, ограничений в корме и воде не было. Манипуляции с животными проводились в соответствии с правилами Европейской конвенции о защите позвоночных животных, используемых для исследовательских и других научных целей (Страсбург, 1986) и одобрены биоэтической комиссией ФГБУ «НМИЦ онкологии» Минздрава России (регистрационный № 11/210).
После хирургических манипуляций выполняли клинический осмотр животных 2 раза в неделю: фиксировали вес и оценивали общее состояние.
Все животные были разделены на 3 группы: 1-я группа была контрольная; мышам 2-й группы выполняли повреждение надкостницы и инъекцию опухолевых клеток в рану; мышам 3-й группы в рану надкостницы помещали опухолевый фрагмент (табл.).
Характеристика групп животных, используемых в эксперименте
|
№ группы |
Кол-во животных в группе |
Способ введения опухолевого материала |
Кол-во приживления опухолевого материала |
Создание дефекта тела бедренной кости |
Проведение КТ |
Гистологическое исследование |
|
1 |
6 |
- |
- |
- |
+ |
+ |
|
2 |
6 |
Инъекция опухолевых клеток |
0/6 |
+ |
+ |
+ |
|
3 |
6 |
Имплантация опухолевого фрагмента |
5/6 |
+ |
+ |
+ |
По истечении 48 суток проводилась некропсия с забором биологического материала (бедренная кость) и последующей морфологической оценкой.
Создание ортотопической PDX-модели саркомы мягких тканей, с прорастанием в кость
Хирургические манипуляции проводились под общим наркозом ветеринарными препаратами «Ксила» в дозе 20 мг/кг, «Золелил-100» в дозе 50 мг/кг массы тела. На первом этапе ортотопическую PDX-модель пытались создать путем введения взвеси опухолевых клеток в бедренную кость мыши. Использовали фрагмент опухоли пациента, который измельчали в тканевом гомогенизаторе BD Medimachine, и получали клеточную суспензию. Для создания дефекта кости предварительно было выполнено рассечение кожи и мышц бедра параллельно бедренной кости и при помощи высокоскоростной дрели Medtronic (США) нарушена ее целостность. Повреждение надкостницы диафиза бедренной кости составило в длину ≈5 мм и в глубину ≈1 мм. Затем в костный дефект вводили суспензию опухолевых клеток в концентрации 5×106 клеток/мл, при этом смешивали в равных пропорциях 1:1 с Matrigel (экстракт базальной мембраны, Corning), общий объем составлял 100 мкл. После окончания манипуляций хирургическую рану ушивали послойно непрерывным обвивным швом.
На втором этапе ортотопическую PDX-модель пытались получить путем имплантации фрагмента опухоли человека. Для этого брали опухоль от пациента, делили на фрагменты и помещали на место костного дефекта. Размер опухолевого фрагмента составлял ≈4×1×1 мм. Дефект кости создавали по такому же принципу, как и на первом этапе. Фрагмент опухоли фиксировали одним узлом лигатуры и ушивали хирургическую рану. Основные хирургические приемы представлены на рисунке 1.
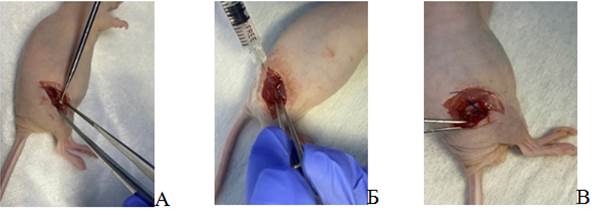
Рис. 1. А – повреждение тела бедренной кости; Б – введение опухолевой суспензии с матригелем в область дефекта тела бедренной кости; В – имплантация фрагмента саркомы мягких тканей человека в область дефекта тела бедренной кости
Микрокомпьютерная томография
Для визуализации in vivo использовали микрокомпьютерную томографию на устройстве Quantum GX2 microКT (Perkin Elmer, США), которую выполняли на 48-е сутки после повреждения бедренной кости и трансплантации опухолевого материала. Параметры сканирования были следующие: напряжение трубки – 90 кВ, ток трубки – 80 мкА, поле зрения – 45 мм, размер пикселя – 90 мкм, время сканирования – 4 мин., угол поворота – 360°, общее количество проекционных изображений – 512, режим сканирования – высокое разрешение. Перед каждым проведением сканирования мышей анестезировали с использованием системы ингаляционного наркоза RAS-4 (Perkin Elmer, США) с 2% раствором изофлурана. После сбора данных изображения в формате DICOM были реконструированы в 3D-модели с использованием программного обеспечения для просмотра проекций и трехмерной реконструкции Quantum GX2 4.0.
Гистологическое исследование
Для гистологического исследования выделенный биологический материал (бедренную кость) мышей фиксировали в 10% формалине. Выполняли удаление солей Ca2+ из образцов для их размягчения декальцинирующим раствором и проводку в вакуумном гистологическом процессоре Leica ASP6025 S (Германия). Далее осуществляли заливку образца в модульной системе (Tes 99 Medite, Германия) в парафин. Следующим этапом проводили резку при помощи ротационного микротома Leica RM 2255 (Германия) толщиной примерно 4 мкм. Полученные гистологические образцы окрашивали гематоксилином и эозином (Tissue-Tek Film Automated Coverslipper) и исследовали под микроскопом.
Результаты исследования и их обсуждение
На 48-е сутки после проведенных хирургических манипуляций у группы животных с инъекцией опухолевых клеток в бедренную кость роста опухолевых узлов обнаружено не было. При этом в группе животных с имплантацией опухолевого фрагмента приживление было отмечено у 5 из 6 животных (83,3%) (рис. 2).
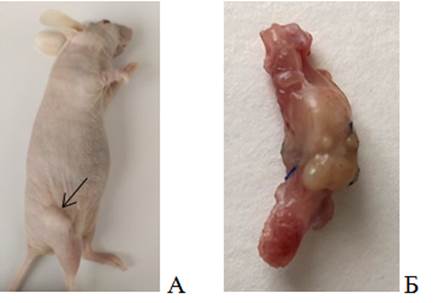
Рис. 2. PDX-модель саркомы мягких тканей (48-е сутки): А – мышь линии Balb/ c Nude с опухолевым узлом СМТ человека на бедре (стрелка); Б – бедренная кость мыши линии Balb/c Nude с опухолевым узлом СМТ
При сканировании на микро-КТ интактных животных получили детальное 3D-изображение костей нижней конечности, среди которых объектом изучения являлась бедренная кость (рис. 3А). На гистологическом препарате бедренной кости мыши показаны участки интактного кортикального слоя бедренной кости, состоящие из компактного вещества с плотной наружной поверхностью. Наблюдалось значительное количество костных балок с неповрежденным костным мозгом (рис. 3Б). В данном исследовании интактная кость являлась объектом сравнения с экспериментальными группами.
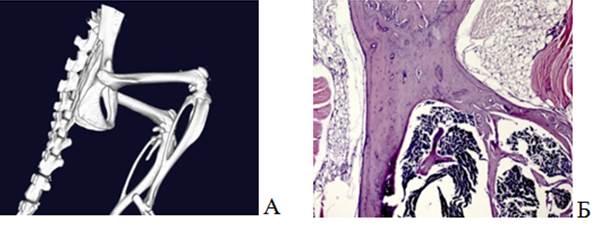
Рис. 3. Визуализация бедренной кости интактной мыши линии Balb/c Nude (группа 1): А – 3D-модель костей таза и нижних конечностей; Б – гистологический препарат бедренной кости. Окраска гематоксилином и эозином. Ув.х50
В группе 2 на 48-е сутки после инъекции опухолевых клеток СМТ человека в бедренную кость мыши на микро-КТ, а также и на гистологическом препарате тела бедренной кости роста опухолевых клеток не было обнаружено. На 3D-модели была продемонстрирована анатомия бедренной кости, сходная с интактной мышью. Таким образом, целостность кости на 48-е сутки после повреждения была полностью восстановлена практически без видимых нарушений (рис. 4А).
На гистологическом препарате отмечалась целостность кортикального слоя кости, что расценивалось как завершение регенерации костной ткани (рис. 4Б). Также на препарате видно нарушение костной структуры, но опухолевых клеток обнаружено не было. Отмечается гиперклеточный костный мозг с мегакариоцитами, эритроидным ростком, расширенный Гаверсов канал с выраженной гиперплазией костного мозга, расположенного в нём.
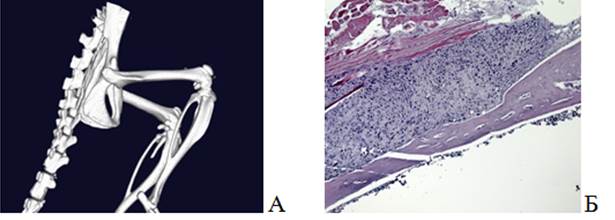
Рис. 4. Визуализация бедренной кости мыши (группа 2): А – 3D-модель костей таза и нижних конечностей; Б – гистологический препарат бедренной кости. Окраска гематоксилином и эозином. Ув.х50
В 3-й группе на 48-е сутки при 3D-моделировании визуализировалась деформация бедренной кости справа (рис. 5А). На микропрепарате была обнаружена отслойка надкостницы, так называемый козырек Кодмана, с экстрамедуллярной опухолью. Вместе с тем виден костномозговой канал, в котором находятся фрагменты нормального костного мозга (рис. 5 Б).
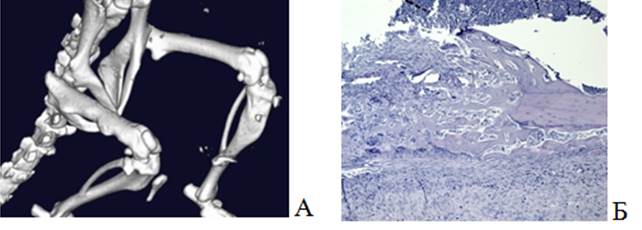
Рис. 5. Визуализация бедренной кости мыши с опухолью (группа 3): А – 3D-модель костей таза и нижних конечностей; Б – гистологический препарат бедренной кости. Окраска гематоксилином и эозином. Ув.х50
Ортотопическая PDX-модель, характеризующаяся гетерогенным клеточным составом и развивающаяся в естественной микросреде, сохраняет гистологические, генетические и патофизиологические характеристики донорской опухоли, что немаловажно для доклинических исследований [10]. У пациента-донора опухолевого материала была диагностирована СМТ с прорастанием в бедренную кость. В связи с этим в данной работе был выбран соответствующий данной клинической ситуации сайт имплантации – бедренная кость мыши.
Была предпринята попытка создать 2 варианта PDX-моделей СМТ на мышах линии Balb/c Nude. Однако при инъекции опухолевых клеток в бедренную кость не было обнаружено роста опухолевых узлов. Модель не была получена, так как, вероятнее всего, при введении клеточной суспензии в тело бедренной кости происходила утечка опухолевого материала и это, главным образом, было вызвано ограниченным интрамедуллярным пространством и повышенным интрамедуллярным давлением после инъекции опухолевых клеток. Такой отрицательный опыт был продемонстрирован и в зарубежной литературе. Так, в работе H. Sasaki с соавторами [10] не удалось создать PDX-модель путем инъекции опухолевых клеток, смешанных с матригелем, имеющим пониженное содержание фактора роста (BD Biosciences) в сбалансированном солевом растворе Хэнкса (HBSS) для того, чтобы позволить опухолевой клеточной суспензии зафиксироваться и в полости бедренной кости.
В исследовании авторы смогли получить PDX-модель только путем имплантации донорского фрагмента опухоли СМТ человека иммунодефицитным мышам Balb/c Nude. Фрагменты первичной опухоли включают в себя как злокачественные клетки, так и клетки, составляющие опухолевое микроокружение, которое, как известно, играет важную роль в онкогенезе. Ко-имплантация злокачественных клеток и клеток, составляющих микроокружение, вероятно, может способствовать увеличению частоты возникновения опухолей у мышей. Данная PDX-модель характеризовалась хорошей воспроизводимостью. Приживление материала было отмечено у 5 из 6 животных, что составило 83,3%. Полученные результаты соответствуют литературным данным, согласно которым процент успешной имплантации PDX иммунодефицитным мышам может варьировать от 10% до 90% в зависимости от типа опухоли, сайта имплантации, особенностей гистологических показателей опухоли пациента [11].
Заключение
В данной работе было продемонстрировано создание PDX-модели саркомы мягких тканей человека с прорастанием в кость путем имплантации фрагмента опухоли пациента. Модель PDX, созданная методом имплантации опухолевого фрагмента, характеризовалась высоким процентом воспроизведения. Такие модели являются незаменимым инструментом для исследования злокачественных новообразований человека.



