В настоящее время во всем мире возросло количество мужчин с диагнозом «аденокарцинома простаты» (АП). По данным авторов [1], у каждого пятого из них после терапии развивается рецидив. Механизмы адаптации клеток злокачественной опухоли к лечению остаются до сих пор неизвестными. Аутофагия является, возможно, одним из факторов сохранения клеток карциномы после воздействия терапией. Процесс защиты опухолевых клеток основан на частичной деградации и последующем восстановлении ее повреждения после терапии [2; 3]. В аутофагии участвует специальный белок LC3-II. При этом реализуется молекулярный механизм фагоцитоза, при котором мембраны фагосомы, за счет соединения с лизосомой, деградируют поврежденный компонент [4]. Аутофагия - это процесс, который осуществляет гомеостаз клетки. Клетки злокачественных опухолей в большей степени зависят от данного процесса, чем здоровые [5; 6]. В литературных источниках есть небольшое количество работ, где изучался маркер аутофагии как маркер прогноза АП [7], однако значение данного антитела в рецидиве остается мало изученным.
Цель исследования: изучить экспрессию маркера аутофагии LC3B у пациентов с диагнозом «аденокарцинома простаты» без признаков рецидива и с рецидивом после проведенной терапии.
Материалы и методы исследования
В исследовании, проведенном авторами, участвовали 72 пациента с клиническим диагнозом АП. Материалом служила пункционная биопсия простаты до и после проведенной терапии. Все случаи поделили на две группы: в первую группу вошел материал от 42 человек без признаков рецидива АП, во вторую группу вошел материал от 30 мужчин с признаками продолженного роста опухоли после проведенной терапии. Наличие рецидива подтверждали лабораторно уровнем простат-специфического антигена крови, результатами ультразвукового и биопсийного исследований. Пациенты первой группы получали различную терапию: 21 мужчина получал монотерапию высокоинтенсивным cфокусированным ультразвуком (HIFU), 11 мужчин получали гормональное лечение в виде максимальной андрогенной блокады и HIFU, 10 мужчин получали лучевую и гормональную терапии. Во вторую группу вошли 10 мужчин, получавших монотерапию HIFU, 10 мужчин после HIFU и гормональной терапии, 10 мужчин после лучевой и гормональной терапий. Рецидив АП подтверждался морфологическим исследованием. Материал для морфологического исследования проходил стандартный алгоритм изготовления гистологических стекол (фиксация, дегидратация, заливка в парафиновые блоки, изготовление тонких срезов на микротоме, депарафинизация, стандартная окраска гематоксилином и эозином. Иммуногистохимию делали с антителом Anti-LC3B antibody ab48394 (Rabbit polyclonal to LC3B, фирмы Abcam). Реакция данного маркера была в цитоплазме опухолевых клеток, клетках фиброзно-мышечной стромы простаты и стенке сосудов. В некоторых случаях положительная экспрессия данного антитела была в ядре. Для определения степени позитивной реакции с антителом использовали гистосчет (Hs).
Формула Hs = ∑ P х i,
где i - яркость полученного окрашивания от 0 до 3, P – процентное соотношение позитивных клеток и негативных.
Обработку полученных результатов авторы проводили с помощью прикладной программы SPSS 13.0 for Windows. Полученные показатели представлены в виде медианы с 25% и 75% квартилями, нормальность распределения выборки оценивали при помощи критерия Шапиро-Уилка. После проверки данных на нормальность распределения в дальнейшем использовали непараметрические методы. Для определения выраженности различий в полученных данных между группами мужчин с АП до и после терапии авторы применяли Т-критерий Вилкоксона. Значимость различия принималась при Т≤0,01.
Результаты исследования
Медиана экспрессии антитела к LC3B в первой группе в клетках АП до терапии составляла Hs=113, что соответствует умеренной реакции. Данная экспрессия наблюдалась у всех пациентов данной группы, преимущественно возле клеточной мембраны в цитоплазме опухолевых клеток. Также у 7% пациентов данной группы до терапии была слабая реакция в ядрах клеток АП и цитоплазме стромальных клеток Hs=52. У 9% мужчин была слабая экспрессия LC3B в кровеносных сосудах. При морфологическом исследовании она отмечалась чаще всего в области эндотелия, медиана составляла Hs=27.
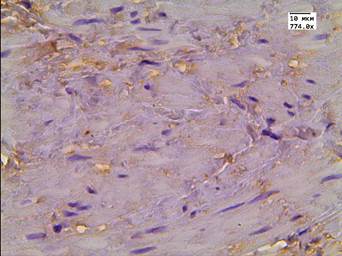
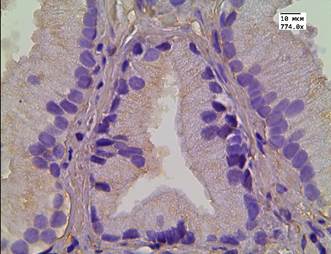
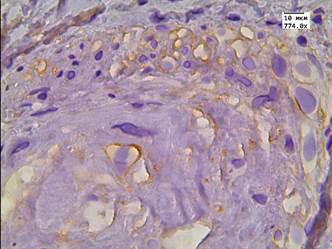
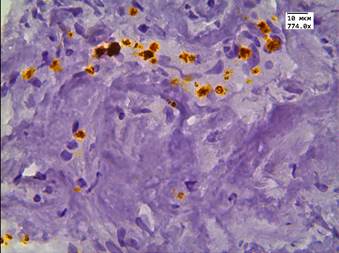
В данной группе пациентов после терапии высокоинтенсивным cфокусированным ультразвуком результаты иммуногистохимической реакции с LC3B: в клетках АП были отрицательными; в клетках стромы слабые - медиана Hs=78; в эндотелии сосудистой стенки слабые - медиана Hs=57 (рис. 1 А-В). После 26 мес. после HIFU-терапии у 10% пациентов отмечалась интенсивная очаговая внеклеточная экспрессия маркера аутофагии в строме (рис. 1Г).
В группе пациентов без рецидива после комбинированного лечения гормональной терапией и высокоинтенсивным cфокусированным ультразвуком (HIFU и МАБ) в клетках АП экспрессия маркера аутофагии была отрицательной у всех пациентов, в стромальных клетках и в стенке сосудов незначительной (медиана Hs 63 и 57 соответственно). После лучевой терапии и гормонального лечения реакция с аутофагальным белком в клетках карциномы отрицательная, а в клетках стромы и в стенке кровеносных сосудов слабой (медиана Hs = 68 и 40 соответственно).
|
|
|
||||
|
|
|
Рис. 1. Реакция с аутофагальным белком LC3B в группе пациентов без рецидива после терапии высокоинтенсивным cфокусированным ультразвуком и комбинированного лечения: А - LC3B в строме; Б - LC3B в цитоплазме эпителия и клетках стромы; В - LC3B в эпителии ацинарных клеток; Г - LC3B в мышечно-соединительнотканной строме после лечения HIFU. Ув. х774
При статистическом анализе данных иммуногистохимического исследования с аутофагальным белком после разных методов терапии АП критерий Вилкоксона показал, что экспрессия LC3B не зависела от выбранного метода лечения.
При изучении полученных результатов реакции аутофагального белка у пациентов в первой группе между зависимыми выборками (до и после терапии) Т-критерий Вилкоксона показал значимые отличия экспрессии в клетках АП, клетках стромы, в эндотелии сосудов (Тэмп<Ткр (0,01)).
|
|
|
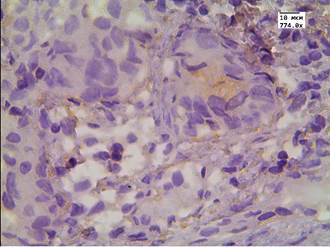
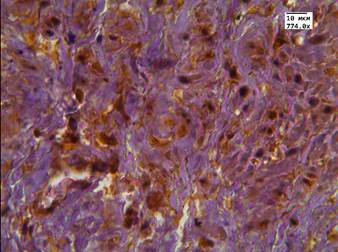
Рис. 2. Реакция маркера LC3B в АП с признаками рецидива после терапии высокоинтенсивным cфокусированным ультразвуком: А - экспрессия аутофагального белка в АП; Б - экспрессия аутофагального белка в АП и в строме. Ув. х774
При морфологическом исследовании биопсийного материала в группе с рецидивом АП медиана экспрессии в клетках опухоли до терапии составила Hs=141. Скопление аутофагального белка отмечалось чаще всего в периферической части цитоплазмы, у 93% пациентов. У 8,4% также слабая положительная экспрессия данного маркера отмечалась в ядрах АП. В строме простаты реакция маркера аутофагии была слабой, Hs=35, авторами она наблюдалась у 14% пациентов с АП. В сосудистой стенке реакция с маркером аутофагии была слабой и локализовалась в области эндотелия, Hs =25 у 9% пациентов.
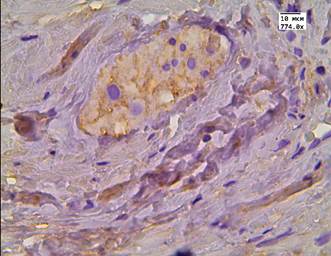
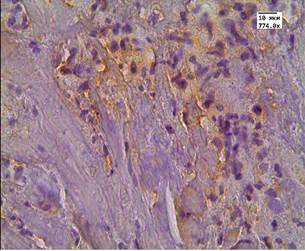
Во второй группе после проведенного лечения высокоинтенсивным cфокусированным ультразвуком медиана цитоплазматической экспрессии LC3B в АП составила Hs=279 и отмечалась у 100% пациентов (рис. 2 А, Б). В этой же группе в стромальных клетках медиана экспрессии маркера составляла Hs=135, а в стенке сосуда Hs=30. У пациентов после проведенного лечения андрогенной блокадой и HIFU-терапией в клетках АП медиана экспрессии была выраженной - Hs=261,5. Данная реакция была положительной у всех пациентов в цитоплазме, а в 72% случаев еще и в ядрах опухолевых клеток (рис. 3 А, Б). В клетках стромы реакция с маркером LC3B составила Hs=109, а в эндотелии сосудистой стенки Hs=52,5 (рис. 3 А, Б).
После проведенного лечения АП андрогенной блокадой и лучевой терапией медиана экспрессии маркера аутофагии в опухолевых клетках составила Hs=271. Данная экспрессия у всех пациентов была цитоплазматической, а в 87% ядерной. Медиана экспрессии данного маркера в строме составила Hs=129, в эндотелии сосудов Hs=42.
|
|
|
Рис. 3. Реакция маркера LC3B у пациентов второй группы в АП после комбинированной терапии: А - LC3B в АП; Б - LC3B в АП и клетках стромы. Ув. х774
У всех пациентов маркер LC3B был в цитоплазме клеток, а если проводилось лечение андрогенной блокадой и высокоинтенсивным cфокусированным ультразвуком или андрогенной блокадой и лучевой терапией, в клетках АП отмечалась еще и ядерная экспрессия.
При анализе полученных данных авторами было отмечено, что выраженность аутофагии в простате не зависела от метода выбранной терапии, критерий Вилкоксона находился вне зоны значимости.
При статистическом изучении результатов иммуногистохимического исследования с аутофагальным белком у мужчин в группе с рецидивом между двумя выборками (до и после терапии) Т-критерий Вилкоксона показал различия в клетках карциномы (Тэмп<Ткр(0,01)) и в стромальных клетках (Тэмп<Ткр(0,01)) (табл.).
Реакция LC3В в биопсийном материале пациентов с рецидивом и без рецидива АП
|
Реакция с LC3B (Hs) |
При комплексном исследовании не был выявлен рецидив АП |
При комплексном исследовании был выявлен рецидив АП |
||
|
до терапии Ме [25;75] |
после терапии Ме [25;75]
|
до терапии Ме [25;75] |
после терапии Ме [25;75] |
|
|
В опухолевой ткани |
112,5*[111;116] |
0* |
151,5*[130;161] |
258*[249;291] |
|
В строме |
48*[42;52,5] |
79*[68;82,5] |
33*[30,5;54] |
121*[101;129] |
|
В стенке сосудов |
25*[18;37,5] |
55*[42,5;58] |
24,5[18,5;35] |
43[29;61] |
* - значимое различие в группах у пациентов до и после терапии Тэмп<Ткр (0,01).
Антитело LC3B экспрессируется в клетках АП. Данные показатели совпадают с другими авторами [8]. В данном исследовании авторы отмечают умеренную цитоплазматическую экспрессию маркера LC3B в АП до лечения.
В биопсийном материале простат у мужчин в первой группе после лечения авторами отмечались признаки регенерации в мышечно-соединительнотканной строме и в эндотелии сосудов. Это проявлялось в виде экспрессии маркера аутофагии в данных локализациях. Так как у пациентов данной группы не было признаков рецидива АП, в опухолевой ткани реакция с маркером LC3B отрицательная. У второй группы пациентов авторы отмечали значимое увеличение маркера LC3B в клетках АП и в клетках мышечно-соединительнотканной стромы после лечения. У пациентов с признаками рецидива позитивная окраска к аутофагальному белку в ядрах клеток карциномы отмечалась только при комбинированной терапии: андрогенная блокада + высокоинтенсивный cфокусированный ультразвук, андрогенная блокада + лучевая терапия. Наиболее вероятно, это связано с тем, что рецепторы к андрогенам локализуются в ядрах клеток [9].
В обеих исследуемых группах пациентов выбор метода лечебного воздействия не влиял на интенсивность реакции с маркером LC3В.
В группе пациентов с рецидивом АП в раковых клетках резко увеличивалась интенсивность аутофагии, вероятно, это связано с тем, что клетки опухоли после воздействия на них пытаются восстановиться и выжить за счет аутофагии. В настоящее время много авторов изучает значение аутофагии в сохранении клеток опухоли после терапии [10], однако авторы не нашли работ, изучающих роль аутофагии в рецидиве АП.
Таким образом, при морфологическом изучении биопсийного материала пациентов с АП после проведенной терапии маркер аутофагии может быть применен как прогностический маркер рецидива [3; 11].
Заключение
Аутофагия - это один из факторов, способствующий сохранению и выживанию клеток АП после терапии. Маркер аутофагии LC3В может использоваться в иммуногистохимической панели маркеров пациентов с АП для выявления и оценки рецидива.