Введение
Цирроз печени (ЦП), осложненный портальной гипертензией (ПГ), нередко развивается на фоне вирусного гепатита С (HCV). Он является одной из актуальных медико-социальных проблем современной гепатологии. Способность возбудителя оказывать прямое цитопатическое действие на гепатоциты, его репликация в моноцитах и макрофагах часто приводят к развитию первично-хронического течения гепатита, трансформации в цирроз и первичную гепатокарциному и является причиной развития стойкой иммунной недостаточности [13,16,20,21,22]. Длительная вирусная инфекция (гепатит С) приводит к истощению иммунных механизмов, в частности к дефициту и истощению функций Th1 лимфоцитов, ответственных за выработку интерлейкина-2 [4,18,20,21]. Отмеченная особенность наиболее важна при хронической и тяжело протекающей патологии, когда применение традиционных иммуномодуляторов или синтетических индукторов синтеза цитокинов бессмысленно из-за истощения компенсаторных возможностей иммунной системы при необходимости дальнейшей хирургической коррекции внутрипеченочной ПГ [2,5,6,7,11,14,15,19]. Также нельзя не учитывать у данной категории пациентов явлений эндотоксемии, ишемию кишечника с микробной транслокацией, фармакологический анамнез и инвазивные манипуляции – как последовательность событий в формировании системного воспалительного ответа [1,3,8,12].
Появление синдрома портальной гипертензии (ПГ) имеет чрезвычайно важное значение в течение заболевания. Являясь приспособительным явлением в начале заболевания, ПГ с прогрессированием процесса приобретает роль ведущего патогенетического клинического фактора [23].
Асцит, рефрактерный к медикаментозным мероприятиям, встречается примерно у 10 % больных с ЦП [9]. С момента появления асцита у пациентов летальность составляет 42–70 % в течение года [17].
В ряде исследований последнего десятилетия установлена роль и значение гипопротеинемии как одного из основных факторов неблагоприятного исхода хирургического лечения больных с синдромом портальной гипертензии [10].
Наличие свободной жидкости в животе на фоне цирроза печени нередко сопровождается ее инфицированием – спонтанным бактериальным перитонитом. За последние годы частота этого осложнения значительно возросла и достигла 12–21 % [24,25].
Целью работы является улучшение результатов лечения пациентов с вирус-ассоциированнымHCV циррозом печени путём ликвидации гипо- и диспротеинемии, а также необходимостью предотвращения инфекционных осложнений и опасности развития генерализованной инфекции с проведением опережающего лечения, а именно – раннего применения интерлейкина-2 человеческого рекомбинантного при дальнейшей хирургической коррекции внутрипеченочной портальной гипертензии одним из известных способов.
Материалы и методы. В клинике хирургии Ростовского государственного медицинского университета с 1997 года пролечен 341 пациент с портальной гипертензией. Внутрипеченочная форма ПГ была у 297 (87,1 %) больных и у 2 (0,6 %) пациентов носила смешанный характер (внутрипеченочный и надпеченочный).
Из 299 больных внутрипеченочной ПГ у 287 был выявлен цирроз печени (у 227 из них в анамнезе выявлен вирусный гепатит), у 6 пациентов выявлена альфа-1-антитрипсиновая недостаточность, у одного редко встречающаяся гепатоцеребральная дистрофия (болезнь Вильсона – Коновалова), приведшие к развитию фиброза печени, у ребенка 8 лет ПГ развилась, как осложнение врожденного фиброза печени. У одного пациента регенеративный узел печени вызвал ПГ. Трем пациентам был поставлен диагноз полинодулярной трансформации печени. У двоих из них ПГ носила смешанный характер за счет гипоплазии нижней полой вены в области впадения печеночных вен с деформацией и стенозом их устьев в одном случае и сдавления печеночных вен и нижней полой вены в другом.
Из 297 больных внутрипеченочной формой ПГ у 74 (24,9 %) отмечена печеночно-клеточная недостаточность по Child-Turcotte-Pugh «А» класса, у 157 (52,9 %) – «В» класса, у 66 (22,2 %) – «С» класса. Варикозное расширение вен пищевода и кардиального отдела желудка имело место у всех обследованных больных: I степени выявлено у 51 (14,9 %) пациента, II степени – у 115 (33,7 %), III степени у 175 (51,3 %) больных. С признаками кровотечения из вен пищевода и желудка в клинику поступило 35 (10,2 %) больных. У 163 (47,8 %) пациентов в анамнезе было варикозное пищеводно-желудочное кровотечение. Спленомегалия выявлена у 317 (92,9 %) пациентов, признаки гиперспленизма установлены у 248 (72,7 %) больных. У 204 больных, что составляет 59,8 % наблюдений, заболевание сопровождалось разной степенью асцита.
Из 297 пациентов с внутрипеченочной ПГ было выполнено 79 операций спленоренального венозного шунтирования (СВШ) и 128 операций трансъюгулярного внутрипеченочного портосистемного шунтирования (ТВПШ). Помимо этого больным выполнялся лапароцентез с реинфузией концентрата асцитической жидкости (38).
Из 207 пациентов, которым выполнялась коррекция ПГ одним из вышеуказанных способов, у 79 (38,2 %) вирусный гепатит не был выявлен. У 9 (4,3 %) в анамнезе присутствовал вирусный гепатит А, у 26 (12,6 %) – вирусный гепатит В, у 75 (36,2 %) – вирусный гепатит С, различное сочетание двух или трех вирусных гепатитов было у 18 (8,7 %) больных. Подробная характеристика представлена на рис.1.
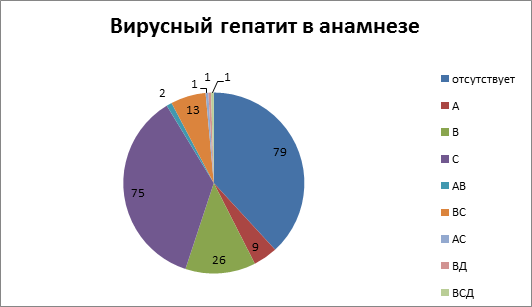
Рис.1. Этиология цирроза печени
Таким образом, вирус-ассоциированный цирроз печени присутствовал у 119 (67,5 %) больных, из них хронический вирусный гепатит С был выявлен у 89 (43,0 %) пациентов.
С целью предоперационной подготовки, ликвидации гипо- и диспротеинемии, а также заместительной терапии интерлейкином-2 и профилактики гнойных осложнений при дальнейшей хирургической коррекции ПГ одним из двух способов, связанных с риском инфицирования, 12 больным с вирус-ассоцированнымHCV циррозом печени, осложненным асцитом, выполняли лапароцентез с реинфузией концентрата асцитической жидкости (заявка на изобретение «Способ лечения больных с синдромом внутрипеченочной портальной гипертензии» №2013128527, приоритет от 21.06.2013 г.).
Сущность метода заключается в том, что внутривенно со скоростью перфузии 60 капель в минуту вводят 500 мл приготовленного концентрата асцитической жидкости с добавлением в него интерлейкина-2 человеческого рекомбинантного в дозе 500 МЕ, при необходимости оставшуюся часть концентрата вводят дробно по 500 мл интраоперационно и в первые сутки после хирургического лечения.
Результаты. 12 пациентам с вирус-ассоцированнымHCV циррозом печени и признаками иммунной недостаточности по клеточному типу с дефицитом CD3⁺- и CD4⁺-позитивных лимфоцитов, снижением содержания CD4⁺CD25⁺-лимфоцитов и NK-клеток, дисиммуноглобулинемией в предоперационном периоде была выполнена реинфузия концентрата асцитической жидкости по ранее заявленной методике.
Состав асцитической жидкости был исследован кроме данной группы еще у 26 больных с ЦП, всего у 38 пациентов. При биохимическом исследовании определялось содержание общего белка и белковых фракций, мочевины, креатинина и билирубина. Количество общего белка в асцитической жидкости составляло от 17,6 до 42,8 г/л (28,2±9,6 г/л). Низкое его содержание было у больных, которым ранее неоднократно выполнялся лапароцентез. Содержание альбумина в процентах составило 49,4±5,3, α-глобулина –14,1±2,4, β-глобулина – 13,4±1,9, γ-глобулина – 24,5±3,6, средние молекулы были в пределах 0,386±0,045 у.е.
В среднем показатели цитоза составляли 297±174 клеток в 1 мм3. Основную часть клеток при микроскопии осадка составляли лимфоциты (69 %), меньшую – сегментоядерные нейтрофилы (10 %), моноциты (2 %), макрофаги (2 %), мезотелиальные клетки (6 %), а также мононуклеары (11 %).
После ультрафильтрации объем асцитической жидкости уменьшался от 5 до 10 раз, содержание общего белка возрастало до 49,3±18,4 г/л. Фракция альбумина повышалась до 52,2±6,8 %, а количество γ-глобулина снижалось.
После выполнения реинфузии концентрата асцитической жидкости показатели общего белка плазмы крови составили 52,4±9,3 г/л до переливания и 58,8±8,4 г/л после, % содержание альбумина - 41,7±14,4 и 47,2±6,4 соответственно. Процент содержания гамма-глобулина – 32,6±7,5 до переливания и 28,4±5,4 после переливания. Коэффициент (отношение альбуминов к глобулинам) составил 0,62±0,04 и 1,1±0,03 соответственно.
После выполнения реинфузии перед операцией спленоренального венозного шунтирования (8) или трансъюгулярного внутрипеченочного портоситемного шунтирования (4) ни одному из 12 пациентов не понадобилось дополнительное введение альбумина, не было выявлено признаков гнойных осложнений, послеоперационные раны в 8 наблюдениях после СВШ зажили первичным натяжением, стабилизировались показатели биохимического анализа крови (табл.1).
Таблица 1
Изменения показателей крови больных ЦП до и после лечения
|
Показатель |
До лечения |
После лечения |
|
Общий белок, г/л |
52,4±9,3 |
61,8±7,2 |
|
Альбумин, % |
43,3±13,9 |
49,2±7,8 |
|
Протромбиновый индекс, % |
71,5±14,3 |
79,2±12,8 |
|
Тромбоциты, х10/л 9 |
92,3±64,8 |
196,6±44,8 |
|
Билирубин, ммоль/л |
25,3±8,97 |
22,7±7,68 |
|
Мочевина, ммоль/л |
7,2±1,4 |
6,1±1,2 |
|
Креатинин, мкмоль/л |
110,3±23,9 |
104,3±23,8 |
|
АЛТ, ммоль/л·ч |
1,05±0,3 |
0,76±0,2 |
|
АСТ, ммоль/л·ч |
0,92±0,23 |
0,78±0,18 |
Таким образом, концентрат асцитической жидкости может быть использован для коррекции гипопротеинемии, которая присутствует у всех пациентов с вирус-ассоциированным ЦП, осложненным асцитом. Осуществление данного способа позволяет повысить эффективность комплексного лечения данной категории больных за счет собственных резервов, коррегировать имеющуюся иммунологическую дисфункцию, снизить потери аутобелка, коллоидов, ферментов, гормонов за счет реинфузии концентрата асцитической жидкости, а также снизить риск развития инфекционных осложнений и генерализованной инфекции путем раннего применения интерлейкина-2 человеческого рекомбинантного.
Рецензенты:
Перескоков С.В., д.м.н., доцент кафедры хирургических болезней №2 ГБОУ ВПО «Ростовский государственный медицинский университет Минздрава России», г. Ростов-на-Дону.
Хоронько Ю.В., д.м.н., заведующий кафедрой оперативной хирургии и топографической анатомии ГБОУ ВПО «Ростовский государственный медицинский университет Минздрава России», г. Ростов-на-Дону.
Библиографическая ссылка
Сапронова Н.Г., Сапронова Н.Г., Лукьянов С.В., Чигаева Е.В. ОСОБЕННОСТИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ВИРУС-АССОЦИИРОВАННЫМ ЦИРРОЗОМ ПЕЧЕНИ // Современные проблемы науки и образования. 2013. № 6. ;URL: https://science-education.ru/ru/article/view?id=10856 (дата обращения: 14.02.2026).



