Микроорганизмы, ассоциированныес растениями, в последние годы стали объектами активных исследований. К настоящему времени накоплен большой экспериментальный материал, доказывающий значительную роль ризобактерий в жизнедеятельности многих сельскохозяйственных растений[1,4]. Активная секреция клетками корня различных веществ обеспечивает питательными субстратами микроорганизмы, образующие с ним прочные ассоциации как внутри корневых тканей, так и на корневой поверхности (ризоплане), а также в почве, непосредственно окружающей корни (ризосфере) [5, 13]. В связи с этим в ризосфере и ризоплане в значительных количествах концентрируются бактерии, актиномицеты, грибы, водоросли и нематоды, существенно превышая количество этих организмов в обычной почве [3, 15]. Для изучения взаимодействий растений с полезными формами бактерий в ризосфере продуктивна концепция, согласно которой ризобактерии образуют с растением единую растительно-микробную систему (ассоциацию) с новыми свойствами, детерминированными положительным взаимодействием партнеров [2, 6, 8].
В образуемом эктосимбиозе корневые экссудаты растений являются субстратом и факторами роста некоторых групп микробных сообществ, которые выполняют роль антифитопатогенов, утилизаторов нежелательных продуктов метаболизма растений, регуляторов общей концентрации микроорганизмов в почве, регуляторов подвижности и кругооборота минеральных веществ в агроэкосистеме [7, 9, 11]. Это проявляется в улучшении минерального питания растений, интенсификации партнерства хозяина с доминантным симбионтом за счет локальной продукции фитогормонов; в поддержании в почве пула потенциальных микросимбионтов при высвобождении спор доминантного симбионта и, наконец, прямой защите растений от фитопатогенов [14,12].
В настоящее время изучен микробиоценоз корневой системы у представителей семейств злаковые и бобовые [10, 16, 17], состав ризосферы и ризопланы других растений, имеющих агропромышленное значение остается неизвестным.
Цель: сравнительное изучение микробного сообщества ризосферы и ризопланы Lycopersicon esculentum Mill.
Материал и методы исследования
Объектом исследования явились микроорганизмы, выделенные из ризосферы и ризопланы томата (Lycopersicon esculentum Mill.). Для выделения микроорганизмов ризосферы и ризопланы использовали метод последовательных отмываний корней по Теппер. Из почвенных монолитов с растениями стерильным пинцетом и ножницами отобрали 1,0 г молодых корней (примерно одного диаметра) с приставшими к ним частицами почвы. Корни помещали в колбу со 100,0 мл стерильной водопроводной воды и взбалтывали в течение 2,0 мин. Стерильным крючком или пинцетом корни извлекали из колбы и переносили последовательно во вторую, третью, четвертую, пятую, шестую и седьмую колбы, также содержащие по 100,0 мл стерильной водопроводной воды. В каждой колбе корни отмывали по 2 мин. В последней (седьмой) колбе в воду перед стерилизацией добавляли 5,0-7,0 г песка. Из каждой колбы отдельно стерильной пипеткой брали по капле суспензии и делали посев на поверхность питательной среды на чашки Петри.
Для определения количественного и качественного состава микрофлоры растения пользовались методом посева полученной суспензии на плотные питательные среды: МПА, Эндо, Симмонса, культуры инкубировали при температуре 37°С в течении 48 ч. Идентификацию микроорганизмов осуществляли на основе изучения морфологических, тинкториальных, культуральных и биохимических свойств выделенных микроорганизмов с помощью программного обеспечения для автоматизированной идентификации бактерий производства ООО «НПО Диагностические системы».
В процессе идентификации у неферментирующих бактерий определяли подвижность, наличие оксидазы, окисление глюкозы OF, желатина, мочевины, лизиндекарбоксилазы, лактозы, чувствительность к пенициллину, образованию индола и сероводорода, рост на среде Симмонса.
Энтеробактерии идентифицировали по отношению к мочевине, малонату натрия, орнитиндекрбоксилазе, лизиндекарбоксилазе, фенилаламиндезаминазе, подвижность, образование индола, сероводорода, реакцию Фогеса-Проскауэра и окисление глюкозы OF.
Для идентификации бацилл определяли подвижность, наличие спор, наличие каталазы, маннита, крахмала, мочевины, способность к гемолизу и реакцию Фогес-Проскауэра.
Результаты исследования и их обсуждение
Проведенные исследования показали, что в состав микробиоценоза корней томатов входили неферментирующие бактерии, энтеробактерии и бациллы.
Неферментирующие бактерии были представлены родами Acinetobacter, Pseudomonas и Alcaligenes. Бактерии имели палочковидную форму, по Граму окрашивались отрицательно, обладали типичной ферментативной активностью (табл. 1).
Таблица 1
Биохимические свойства неферментирующих бактерий ризосферы и ризопланы томатов
|
|
Виды микроорганизмов |
подвижность |
оксидаза |
окисление глюкозы ОF |
желатин |
мочевина |
лизиндекарбоксилаза |
аргигидекарбоксилаза |
10% лактоза |
чувствительность к пенициллину |
индол |
Симмонса |
сероводород |
|
1. |
AcinetobacterIwofii |
- |
- |
щ/- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
|
2. |
Pseudomonas pseudoalcaligenes |
+ |
+ |
щ/- |
- |
+ |
- |
+ |
- |
- |
- |
+ |
- |
|
3. |
Acinetobactercalcoaceticus |
+ |
+ |
+/- |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
|
4. |
Alcaligenesfaecalis |
+ |
+ |
-/- |
- |
- |
- |
- |
- |
+ |
- |
+ |
- |
Сем. Enterobacteriaceae и в ризоплане, и в ризосфере было представлено только одним видом – Enterobacter aerogenes. При микроскопии данные бактерии имели палочковидную форму, по Граму окрашивались отрицательно, обладали подвижностью и выраженной ферментативной активностью, связанной с образованием многочисленных сахаролитических, протеолитических и других ферментов. Они не обладали способностью к образованию индола и сероводорода, не расщепляли мочевину, не выделяли фенилазаминдезаминазу. Энтеробактерии давали положительную пробу с цитратом натрия на среде Симмонса, Фогеса-Проскауера, синтезировали малонат натрия, орнитиндекарбоксилазу, лизиндекарбоксилу, вызывали окисление глюкозы.
Род Bacillus на поверхности корней и в прилегающей к ним почве был представлен двумя видами –Bacillus subtilis и Bacillus megaterium, имеющими типичные морфологические, тинкториальныеи биохимические свойства (табл. 2).
Таблица 2
Характеристика биологических свойств бацилл
|
Вид |
наличие спор |
подвижность |
каталаза |
лецитиназа |
гемолиз |
маннит |
крахмал |
мочевина |
реакция ФогесПроскауера |
|
Bacillus subtilis |
+ |
|
+ |
- |
- |
+ |
+ |
- |
+ |
|
Bacillus megaterium |
+ |
+ |
|
- |
- |
- |
+ |
+ |
- |
Сравнительное исследование состава микробиоценоза ризосферы и ризопланы томата (Lycopersicon esculentum Mill.) показало, что количественные показатели бактерий Acinetobacter Iwofii ризосферы были в 1,13 раз больше, чем ризопланы, а Acinetobacter calcoaceticus– в 1,18 раза. Плотность колонизации Pseudomonas pseudoalcaligenes больше в 1,14 раза в ризосфере, по сравнению с ризопланой, а Alcaligenes faecalis– в 1,40 раза.
Показатели плотности колонизацииEnterobacter aerogenes в ризосфере были в 1,24раза, Bacillus subtilis– в 1,76 раз, Bacillus megaterium– в 1,22 раза выше, чем в ризоплане (табл. 3).
Таблица 3
Показатели плотности колонизации микробиоты ризосферы и ризопланы Lycopersicon esculentum Mill. (lgКОЕ/мл)
|
№ |
Виды |
Ризосфера (lgКОЕ/мл) |
ризоплана (lgКОЕ/мл) |
|
1 |
AcinetobacterIwofii |
3, 48±0,47* |
3,08±0,11 |
|
2 |
Acinetobacter calcoaceticus |
3,08±0,13* |
2,60±0,17 |
|
3 |
Pseudomonas pseudoalcaligenes |
3,18±0,50* |
2,78±0,30 |
|
4 |
Alcaligenesfaecalis |
2,60±0,19* |
2,00±0,15 |
|
5 |
Enterobacteraerogenes |
2,48±0,27* |
2,00±0,14 |
|
6 |
Bacillus subtilis |
2,08±0,23* |
1,18±0,12 |
|
7 |
Bacillus megaterium |
2,18±0,18 |
1,79±0,16 |
*– показатель достоверности различий показателей плотности колонизации микробиоты ризосферы и ризопланы Lycopersicon esculentum Mill. ( р <0,05).
Частота встречаемости исследуемых микроорганизмов в ризосфере и ризоплане была следующая: Acinetobacter Iwofii 61% и 57%, Acinetobacter calcoaceticus 59% и 53%, Pseudomonas pseudoalcaligenes 58% и 51%, Alcaligenes faecalis 44% и 43%, Enterobacter aerogenes 39% и 37%Bacillus subtilis 48% и 35%, Bacillus megaterium 51% и 42% соответственно (рисунке).
Показатели частоты встречаемости видового состава микроценоза ризосферы и ризопланы Lycopersicon esculentum Mill. (%)
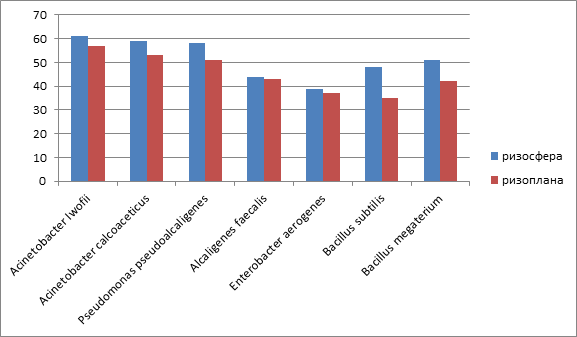
В результате сравнительного изучения микробиоценоза корней томатов установлено, что качественный состав ризосферы и ризопланы одинаков, но имеются количественные различия микробного населения, ризосфера является более плотно заселенной нишей по сравнению с ризопланой.
Выводы
1.Видовой cостав ризосферы и ризопланы томатов представлен неферментирующими бактериями – Acinetobacte rIwofii, Pseudomonas pseudoalcaligenes, Acinetobacter calcoaceticus, Alcaligenes faecalis; энтеробактериями – Enterobacter aerogenes и бациллами –Bacillus subtilis, Bacillus megaterium.
2. Доминирующими видами и ризосферы являются Acinetobacter Iwofii, частота встречаемости которых составляет 61% и Pseudomonas pseudoalcaligenes,с частотой встречаемости 58%.
3.Доминирующими видами ризопланы являются Acinetobacter Iwofii, частота встречаемости которых составляет 57% и Pseudomonas pseudoalcaligenes, с частотой встречаемости 51%.
4. Наиболее плотнозаселенной нишей из изученных биотопов является ризосфера. Наибольший уровень плотности колонизации имеет вид Acinetobacter Iwofii, его показатели и в ризосфере, и в ризоплане составляет 3,48±0,47 lgКОЕ/мл и 3,08±0,11 lgКОЕ/мл соответственно (р < 0,05).
Рецензенты:
Золотухин В.В., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И. Н. Ульянова», г. Ульяновск;
Артемьева Е.А., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И. Н. Ульянова», г. Ульяновск.
Библиографическая ссылка
Алексеева А.С., Потатуркина-Нестерова Н.И. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МИКРОБИОЦЕНОЗА РИЗОСФЕРЫ И РИЗОПЛАНЫ LYCOPERSICON ESCULENTUM MILL. // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16597 (дата обращения: 31.01.2026).



